快速制备高掺杂CuO/SiO2复合气凝胶
许维维 杜 艾 唐 俊 陈 珂 邹丽萍 张志华 沈 军 周 斌
(同济大学物理科学与工程学院,上海市特殊人工微结构材料与技术重点实验室,上海200092)
快速制备高掺杂CuO/SiO2复合气凝胶
许维维 杜 艾*唐 俊 陈 珂 邹丽萍 张志华 沈 军 周 斌*
(同济大学物理科学与工程学院,上海市特殊人工微结构材料与技术重点实验室,上海200092)
通过环氧丙烷预反应法,以乙腈为溶剂快速制备了高掺杂的氧化铜/二氧化硅复合气凝胶.在典型的合成过程中,将正硅酸甲酯(TMOS)、乙腈、去离子水和环氧丙烷混合进行预反应,然后将该溶液与氯化铜的乙腈-水溶液混合并添加环氧丙烷,在35°C烘箱中静置0.5 h后转化为湿凝胶,再经过CO2超临界流体干燥和热处理即可获得黑色块状CuO/SiO2复合气凝胶.最终气凝胶样品密度约为180 mg·cm-3,比表面积高达625 m2· g-1,平均掺杂比为19.91%±2.42%(Cu:Si摩尔比),压缩模量为1.639 MPa,具有成型性好、分散均匀等优点,是良好的背光源靶材料.本论文还通过对比实验对凝胶化过程的机理进行分析,结果表明,通过改变溶剂和采用环氧丙烷预催化均衡了两种不同前驱体的反应速率,实现了共凝胶的目的.此外,该方法还有望为其它金属氧化物/二氧化硅复合气凝胶的制备提供新思路.
预反应;高掺杂;氧化铜;复合气凝胶;环氧丙烷;共凝胶
1 引言
气凝胶是一种由纳米量级的胶体粒子或高聚物分子聚集而成的纳米多孔三维网络结构材料,因其特殊的性能从而在很多领域得到广泛应用.1例如, Al2O3、Cr2O3和TiO2等金属氧化物气凝胶作为一种优良的纳米多孔功能材料,2-7已经用在高效催化、8隔热保温、9以及惯性约束聚变(ICF)靶材料等领域.10,11然而,还有很多种类的单元金属氧化物气凝胶制备技术尚不成熟,存在稳定性和成型性差、密度高、分散度低等缺点,难以得到实际应用.而氧化硅气凝胶作为一种理想的纳米载体,具有密度在一定范围内可调、稳定性高、成型性好、比表面积高、力学性能良好等优点,是理想的吸附载体和保温隔热材料.12-14结合以上两类气凝胶的特点,近年来,以互支撑或自支撑三维网络为骨架结构的金属氧化物/二氧化硅复合气凝胶已经通过各种复合方法获得.这种兼具两种气凝胶优点的低密度二元复合气凝胶在很多领域都有应用,如在惯性约束聚变中可作为靶丸材料、黑腔靶腔壁以及填充传输层材料、高效诊断光源等.15-18在硬X射线转换实验中,低密度二元气凝胶可以提高X射线的转换效率.另外,复合气凝胶也可用于高效催化剂.
目前,CuO/SiO2复合气凝胶的常用制备方法主要有离子掺杂法、浸渍法、酸碱两步法.19-23然而,通过上述方法所获得复合气凝胶的掺杂铜元素一般是以离子的形式嵌在二氧化硅基底中,没有胶凝化,导致其复合气凝胶掺杂浓度范围相对较窄、均匀性差(金属离子在凝胶和老化过程中容易流失)、以及成型性差等缺点.劳伦斯·利弗莫尔国家实验室24曾报导以乙醇为溶剂,采用共凝胶方法来制备以金属为主要骨架的金属氧化物/二氧化硅复合气凝胶的方法.这种方法所得的气凝胶掺杂均匀,掺杂比例精确可控,但凝胶成型性较差.而本文在上述工艺的基础上尝试以乙腈为溶剂,采用环氧丙烷预反应法这种简单工艺来快速制备高掺杂CuO/ SiO2复合气凝胶,并进一步研究了整个凝胶化过程的机理.通过改变溶剂以及采用环氧丙烷预反应,25,26均衡了两种不同前驱体的反应速率,达到了共凝胶的目的.此方法与传统凝胶复合工艺相比具有掺杂量高、分散均匀、杂质离子参与凝胶、成型性好等优点,是理想的背光源靶材料.另外,该工艺还有望为其它二元复合凝胶的制备提供新思路.
2 实验部分
2.1 实验试剂
正硅酸甲酯(methoxy silane,TMOS),二水合氯化铜(copper chloride,CuCl2·2H2O),乙腈(acetonitrile,CH3CN),环氧丙烷(propylene oxide,PO),以上试剂均为分析纯(纯度均≥99%,购于国药),以及去离子水(H2O).
2.2 20%掺杂量的氧化铜/二氧化硅复合气凝胶的制备
本实验中掺杂量均为铜与硅元素的摩尔比,将10 mL正硅酸甲酯(98%(w))溶于10 mL的乙腈中,并加入0.18 mL去离子水和3 mL环氧丙烷,在25°C下均匀搅拌15 min,作为溶液A.同时,将2.267 g的二水合氯化铜(CuCl2·2H2O)溶于20 mL乙腈中,并加入1.912 mL去离子水(其中H2O与Cu2+摩尔比≥6),在25°C下均匀搅拌10 min,作为溶液B.将溶液A加到溶液B中混合均匀,并缓慢加入4 mL PO搅拌20 min,然后混合溶液放入35°C烘箱中静置,0.5 h后形成共凝胶,凝胶为暗褐色且相对较硬.将湿凝胶放在常温下老化48 h,凝胶慢慢变成深蓝色,并有少量反应残留液体析出,初步分析是由于凝胶孔洞在老化过程中发生相对收缩引起的.然后用无水乙醇浸泡样品约一周,其中至少换乙醇4次,将凝胶内部的水和反应残留化学试剂替换出来,然后将样品进行二氧化碳超临界流体干燥(CO2超临界点31.8°C, 7.3 MPa),干燥后的样品为深蓝色块状铜基/二氧化硅复合气凝胶,最后将样品放入马弗炉中,以1°C· min-1的速率升到500°C,保持4 h,最终得到黑色块体的氧化铜/二氧化硅复合气凝胶(AG-1).
2.3 参比样品的制备
为了进一步研究在整个溶胶-凝胶过程中,溶剂和环氧丙烷对反应过程的影响.在本实验的基础上,做了两个对比性的实验,其中实验试剂的用量以及反应条件均不变,在样品(AG-2)的制备过程中,以乙醇为溶剂,将TMOS溶于乙醇-水溶液中搅拌,作为溶液A.二水合氯化铜(CuCl2·2H2O)溶于乙醇-水溶液中搅拌,作为溶液B.将溶液A加到溶液B中,等混合均匀后缓慢加入7 mL的PO进行搅拌, 20 min后将混合溶液放入35°C烘箱中静置,12 h后变为深蓝色凝胶.样品(AG-3)是在样品AG-1制备的基础上,将乙腈换成乙醇,4.5 h后凝胶.两种参比样品用与AG-1同样的方法进行老化、溶剂替换、二氧化碳超临界干燥以及热处理,即得到复合气凝胶AG-2和AG-3.
2.4 样品的表征
本论文中对三种方法最终所获得的复合气凝胶进行了表征,通过称重法测得样品的密度,采用日本JEOL公司JEM-2011型透射电子显微镜(TEM)和荷兰Philips公司Philips-XL30型扫描电子显微镜(SEM)以及所配备的X射线能谱(EDX)仪分别用来分析样品内部多级结构和元素分布.采Rigaku D/ max2550VB3+/PC型X射线衍射(XRD)仪对样品的结晶度和结晶成分分析,美国的Perkin Elmer公司动态热机械分析仪(dynamic thermomechanical analysis apparatus,DMA)来分析最终样品的应力-应变过程,从而研究气凝胶的力学性能.采用美国Quantachrome公司的Autosorb-1MaP型全自动物理吸附比表面仪分析液氮温度下(77 K)样品的氮气吸附-脱附等温线,并根据BET(Brunauer-Emmett-Teller)和BJH(Barrett-Joyner-Halenda)方法分析计算样品的比表面积、总孔体积和孔径分布.
3 结果和讨论
3.1 不同制备方法对气凝胶的密度和凝胶时间的影响
对不同的方法制得气凝胶的颜色和时间进行了对比,如表1所示,三种方法最终的凝胶时间有着很大的差别,在环氧丙烷预反应法中,同种反应过程以乙醇为溶剂的凝胶时间是乙腈为溶剂凝胶时间的9倍,这主要与溶剂的极性以及对离子配位作用的差异有关.乙腈溶剂的极性大于乙醇,且以乙腈为溶剂可能改变了Si的配位环境,加速了TMOS的反应.

表1 不同方法所制备样品的凝胶时间和密度Table 1 Gelation time and density of samples via different methods
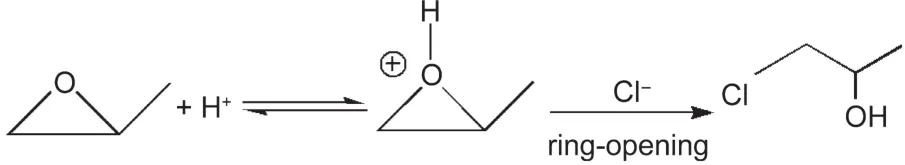
对样品AG-2、AG-3比较可知,在溶液A中,通过加入PO进行预反应加速了TMOS的水解.主要反应式如下:

环氧丙烷本身发生了开环加成反应,是一种不可逆的质子捕获剂,24它对TMOS水解过程中生成的氢离子的结合能力大于甲氧基,导致TMOS水解后生成的H+离子迅速被PO捕获,并且反应产物有一个羟基化的三元碳氧化环,不稳定易于发生开环反应并与溶液中甲氧基结合成为稳定的羟基化合物,从而使得TMOS水解平衡向右移动.另一方面,混合溶液加入PO后,水合铜离子([Cu(H2O)6]2+)水解过程中生成的氢离子迅速被PO捕获,发生开环反应与溶液中的Cl-离子结合成为稳定的羟基化合物,使得铜离子的水解平衡向生成水合氢氧化铜的方向移动,PO作为凝胶促进剂主要反应如下:
经过PO预反应的溶液A在与溶液B混合后能够很快形成硅的凝胶骨架.而多聚硅酸网络的作用与聚丙烯酸(PAA)相仿,具有分散能力,提供了空间位阻,反应较快的铜凝胶颗粒能够更加均匀的分布.6
3.2 样品的微观结构
通过透射电镜(TEM)对最终样品AG-1和AG-3的微观初级结构(图1)分析表明,CuO/SiO2复合气凝胶主要是由规则球形或者近球形团簇颗粒组成的互支撑骨架结构,电子衍射不能形成光斑或光环,呈无定形状态.样品AG-1两种不同凝胶颗粒分布相对较均匀,且相对比较致密,凝胶粒子的直径在1-10 nm范围内均有分布,为典型的气凝胶结构.而样品AG-3中铜的凝胶颗粒团聚较为明显,这主要是由于以乙醇为溶剂时水合铜离子水解缩聚速率比TMOS快,从而造成了铜凝胶颗粒的局部团聚.
3.3 样品微观形貌及其能谱分析
通过不同制备方法得到的样品照片如图2所示,经过500°C处理后,样品AG-1为均匀的轻质黑色块体,其线性收缩率约为15%,密度为180 mg· cm-3,而样品AG-2为硬块状蓝黑色固体,收缩约为50%.由肉眼观察发现凝胶分布相对不均匀,图中可以说明在一开始的凝胶过程中由于形成配位体的水合铜离子([Cu(H2O)6]2+)22水解缩聚速率比TMOS快,从而导致局部铜基凝胶颗粒发生团聚,并且样品AG-2在整个老化和超临界干燥过程中体积收缩相对较大,这说明不同的凝胶骨架生长速率差异较大,造成了凝胶结构的不均匀.

图1 PO预反应法不同溶剂所制得样品AG-1和AG-3的TEM图Fig.1 TEM images of samplesAG-1 andAG-3 with different solvents via PO pre-reaction method(a)AG-1 with acetonitrile as solvent,(b)AG-3 with ethanol as solvent

图2 (a)乙腈为溶剂PO预反应法所制得样品AG-1及(b)乙醇为溶剂PO一步法所得样品AG-2的图片Fig.2 Photographs of(a)sampleAG-1 with ethanol as solvent via PO pre-reaction method and(b)sampleAG-2 with acetonitrile as solvent via PO one-step method
从样品的SEM图片(图3)可知,三种样品的微观形貌有着明显差别,其中PO预反应法不同溶剂所获得的样品(如图3(a,b)所示)均为一种典型的气凝胶形貌,整个样品是由纳米级球形颗粒均匀堆积成三维网络结构,其直径大部分分布在50-100 nm范围内,形成数个颗粒堆积的小团簇结构,其中,样品AG-1的多孔形貌相对AG-3较为明显.而样品AG-2显示出另外一种形貌,整个样品由相对致密的胶体颗粒堆积而成,但球形或近球形的凝胶颗粒形貌尚在.这主要由于铜凝胶颗粒在硅凝胶基底中分散不均,导致样品在老化和干燥过程中凝胶网络中孔结构受力不均而发生塌陷,整个样品发生严重收缩,27最终导致不同样品的密度有着很大的差异.

图3 不同方法所制得样品的SEM图片Fig.3 SEM images of samples via different methods(a)AG-1 with acetonitrile as solvent via PO pre-reaction method,(b)AG-3 with ethanol as solvent via PO pre-reaction method, (c)AG-2 with ethanol as solvent via PO one-step method
为了进一步研究最终样品中元素的分布情况,将样品AG-1在扫描电镜下对不同点做能量散射X射线谱(EDS)元素分析谱(如图4所示,其中一个测试点处EDS谱),通过对不同点EDS能谱中原子数比例统计可知,最终样品的平均掺杂比为19.91%± 2.42%,与理论值的偏差仅为0.45%,这说明复合气凝胶中氧化铜能相对均匀地分布在二氧化硅基底中,该方法基本解决了高掺杂复合凝胶掺杂量精确控制问题.
3.4 样品的XRD分析
经XRD分析,两种不同方法制得的复合凝胶经500°C处理后的样品除了呈现出一些典型的弥散衍射峰外,还包含一些尖锐的衍射峰.如图5所示,样品AG-1及AG-2在低衍射角处都有一个较宽的峰,这是无定形二氧化硅的典型图样.而样品AG-2在2θ>30°时基本不存在尖锐的衍射峰,说明该方法不能获得结晶度较高的氧化铜/二氧化硅复合气凝胶.而对于样品AG-1在2θ为35.5°和38.0°处出现两个尖锐的衍射峰,分别对应着单斜晶CuO(标准卡片PDF-892531)的(002)、(111)晶面,结晶度相对较高.据文献6报导没有热处理前铜主要以碱式氯化铜的形式存在,500°C热处理时,碱式氯化铜发生了热分解并在高温下逐步晶化,分子排列趋向于有序结构,其成分为单斜晶氧化铜.
3.5 样品的DMA性能测试
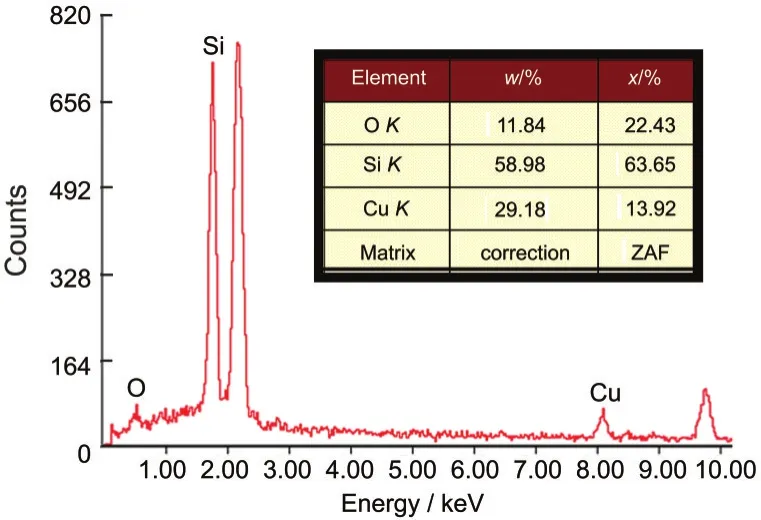
图4 乙腈为溶剂PO预反应法所制得样品AG-1的EDS能谱Fig.4 EDS spectrum of sampleAG-1 with acetonitrile as solvent via PO pre-reaction methodEDS:energy-dispersive X-ray spectroscopy
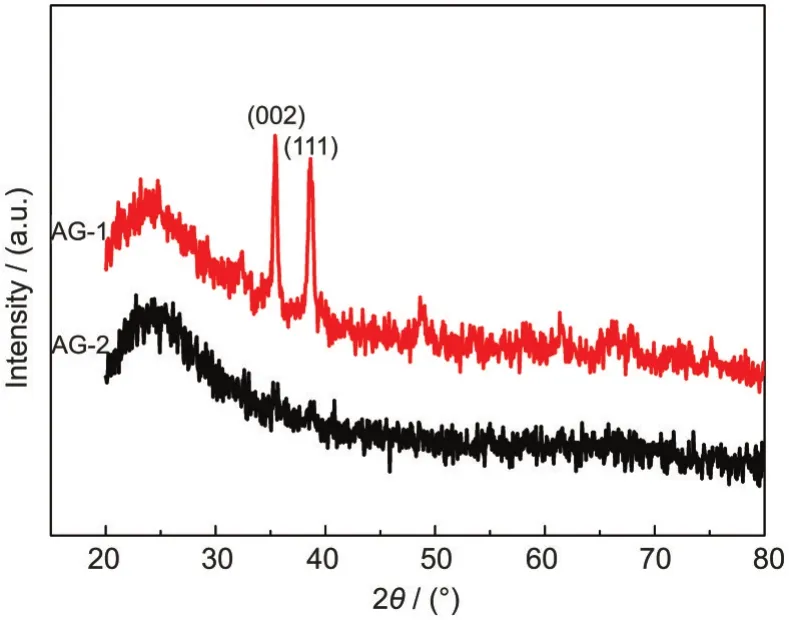
图5 样品AG-1和AG-2的XRD图Fig.5 XRD patterns of samplesAG-1 andAG-2
气凝胶的力学性能是决定其能否在一些重要领域得到应用的关键,例如,在激光X射线转换实验中,气凝胶作为靶材料对其力学性能有着很高的要求.由于样品AG-2、AG-3力学性能相对较差,本论文最终对样品AG-1的力学性能进行了分析,通过切割、打磨等工艺将样品AG-1制成高度为5 mm,底面半径为3.5 mm的小圆柱.采用DMA 8000型动态热机械分析仪(DMA,应力-应变模式)对气凝胶样品的弹性模量进行测量.如图6所示,图中横坐标为应变,纵坐标为应力,曲线的斜率即为模量.样品的整个应力应变过程分为三个阶段,A点之前的部分主要为弹性形变区域,其弹性模量通过斜率分析可得为1.639 MPa,A到B点之间主要为塑性形变区,B点之后是一条类似抛物线的曲线,这一段样品的内部结构逐渐破坏.该方法制得的样品具有良好的成型性和力学性能,有望用于高效激光X光转换实验和冲击波低密度泡沫材料的超声传输特性的研究中.
3.6 样品的比表面积和孔径分布
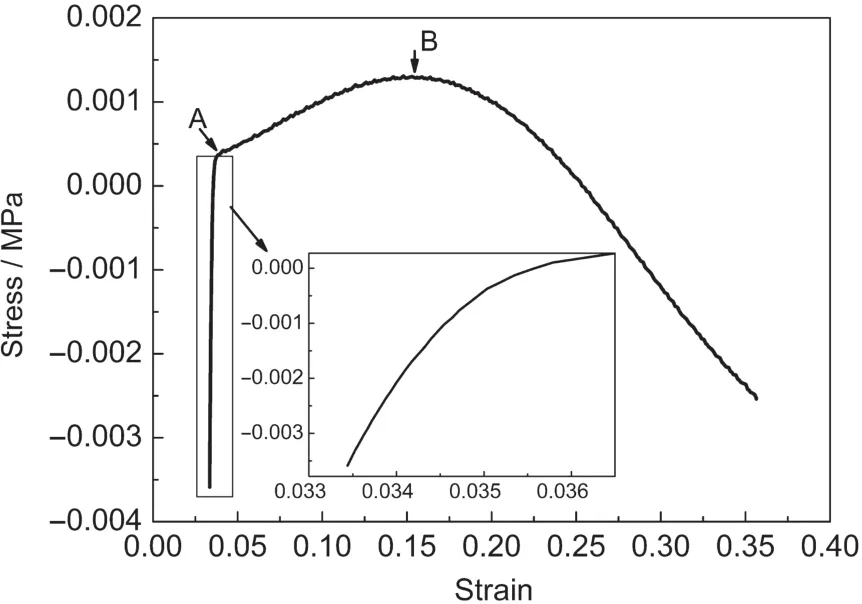
图6 乙腈为溶剂PO预反应法所制得样品AG-1的应力-应变图Fig.6 Stress-strain curve of sampleAG-1 with acetonitrile as solvent via PO pre-reaction method
通过氮气吸附-脱附比表面积分析仪来对样品AG-1的比表面积、孔径分布以及孔体积进行分析.如图7所示样品等温吸附-脱附等温线可知,由于吸附时在中孔和大孔内产生毛细凝聚现象,从而使得脱附过程中出现滞后环.样品AG-1具有典型的IV类等温线,为典型的介孔结构特征.等温线还显示了接近H1型的回滞环,28说明孔径分布范围相对较集中.最终样品的总孔体积为2.063 cm3·g-1,平均孔径为13.2 nm,孔径分布范围主要在20-30 nm范围内,还存在少量小于5 nm的孔,说明样品具有典型的介孔材料的特征.通过BET对样品的比表面积分析可知,最终样品的比表面积达到625 m2·g-1,有望用于高效催化剂.
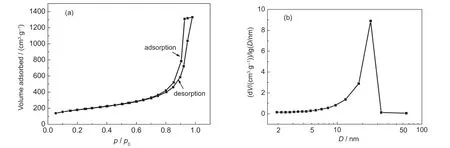
图7 乙腈为溶剂PO预反应法所制得样品AG-1的吸附-脱附等温线(a)和孔径分布(b)Fig.7 Adsorption-desorption isotherms(a)and pore size distribution(b)of sampleAG-1 with acetonitrile as solvent via PO pre-reaction method
4 结论
本研究以正硅酸甲酯和二水合氯化铜为前驱体,乙腈为有机溶剂,通过环氧丙烷预反应法,并结合CO2超临界流体干燥和热处理工艺,得到含有氧化铜单斜晶的块状CuO/SiO2复合气凝胶.该工艺利用不同溶剂的极性和配位作用的差异对前驱体溶解和凝胶速率的影响,并通过PO预反应法来均衡两种不同前驱体的凝胶速率,从而达到快速、均匀共凝胶的目的.其凝胶时间为0.5 h,仅为传统方法凝胶时间的4%左右.这种方法所获得的氧化铜/二氧化硅复合气凝胶通过多种表征可知,最终得到的气凝胶样品的密度约为180 mg·cm-3,其比表面积高达到625 m2·g-1,平均掺杂比为19.91%±2.42%(Cu: Si摩尔比),压缩模量为1.639 MPa,具有成型性好,力学性能优良等特点.并且这种制备方法有望解决其它高掺杂金属氧化物/二氧化硅复合气凝胶的制备问题.
(1) Chen,L.W.;Gan,L.H.Chemistry 1997,8,21.[陈龙武,甘礼华.化学通报,1997,8,21.]
(2)Zu,G.Q.;Shen,J.;Wei,X.Q.;Ni,X.Y.;Zhang,Z.H.;Wang, J.C.;Liu,G.W.J.Non-Cryst.Solids 2011,357,2903.doi: 10.1016/j.jnoncrysol.2011.03.031
(3)Xu,Z.J.;Gan,L.H.;Pang,Y.C.;Chen,L.W.Acta Phys.-Chim.Sin.2005,21,221. [徐子颉,甘礼华,庞颖聪,陈龙武.物理化学学报,2005,21,221.]doi:10.3866/PKU. WHXB20050204
(4)Du,A.;Zhou,B.;Zhong,Y.H.;Zhu,X.R.;Gao,G.H.;Wu,G. M.;Zhang,Z.H.;Shen,J.J.Sol-Gel Sci.Technol.2011,58, 225.doi:10.1007/s10971-010-2381-8
(5) Zhao,Z.Q.;Jiao,X.L.;Chen,D.R.J.Mater.Chem.2009,19, 3078.doi:10.1039/b819849g
(6) Du,A.;Zhou,B.;Shen,J.;Gui,J.Y.;Liu,C.Z.;Fan,G.L.; Zhang,Z.H.Energy Sci.Technol.2010,44,1006. [杜 艾,周 斌,沈 军,归佳寅,刘春泽,范广乐,张志华.原子能科学技术,2010,44,1006.]
(7) Du,A.;Zhou,B.;Shen,J.;Gui,J.Y.;Zhong,Y.H.;Liu,C.Z.; Zhang,Z.H.;Wu,G.M.New J.Chem.2011,35,1096.doi: 10.1039/c0nj00909a
(8) Rotter,H.;Landau,M.V.;Carrera,M.;Goldfarb,D.;Herskowitz, M.Appl.Catal.B 2004,47,111.doi:10.1016/j.apcatb. 2003.08.006
(9) Wittwer,V.J.Non-Cryst.Solids 1992,145,233.doi:10.1016/ S0022-3093(05)80462-4
(10)Zhou,B.;Shen,J.;Wu,G.M.;Sun,Q.;Huang,Y.D.;Wang,J. Atmoic Energy Sci.Technol.2004,38,125. [周 斌,沈 军,吴广明,孙 骐,黄耀东,王 钰.原子能科学技术,2004,38, 125.]
(11) Du,A.;Zhou,B.;Wu,Y.H.;Xiao,S.F.;Liu,C.Z.;Shen,J.;Ni, X.Y.Atomic Energy Sci.Technol.2008,42,794.[杜 艾,周 斌,吴越华,肖淑芳,刘春泽,沈 军,倪星元.原子能科学技术,2008,42,794.]
(12) Chen,L.W.;Gan,L.H.;Hou,X.H.Acta Phys.-Chim.Sin. 2003,19,819.[陈龙武,甘礼华,侯秀红.物理化学学报, 2003,19,819.]doi:10.3866/PKU.WHXB20030908
(13) Gui,J.Y.;Zhou,B.;Zhong,Y.H.;Du,A.;Shen,J.J.Sol-Gel Sci.Technol.2011,58,470.doi:10.1007/s10971-011-2415-x
(14) Tillotson,T.M.;Hrubesh.L.W.J.Non-Cryst.Solids 1992,145, 44.doi:10.1016/S0022-3093(05)80427-2
(15)Abecassis-Wolfovich,M.;Rotter,H.;Landau,V.;Korin,E.; Erenburg,A.L.;Mogilyansky,D.;Garshtein,E.Stud.Surf.Sci. Catal.2003,146,247.doi:10.1016/S0167-2991(03)80373-7
(16) Gash,A.E.;Tillotson,T.M.;Satcher,J.H.,Jr.;Hrubesh,L.W.; Simpson,R.L.J.Non-Cryst.Solids 2001,285,22.
(17) Skapin,T.;Kemnitz,E.J.Non-Cryst.Solids 1998,225,163. doi:10.1016/S0022-3093(98)00037-4
(18) Du,A.;Zhou,B.;Li,L.X.;Zhu,X.R.;Li,Y.N.;Shen,J.;Gao, G.H.;Zhang,Z.H.;Wu,G.M.Atomic Energy Sci.Technol. 2012,46,842.[杜 艾,周 斌,李龙翔,朱秀榕,李宇农,沈 军,高国华,张志华,吴广明.原子能科学技术,2012,46, 842.]
(19) Mohanan,J.L.;Brock,S.L.Chem.Mater.2003,15,2567.doi: 10.1021/cm021741x
(20) Oh,Y.J.;Nam,B.A.Solid State Sci.2011,13,1579.doi: 10.1016/j.solidstatesciences.2011.06.002
(21) Zheng,M.F.;Zhao,T.B.;Xu,W.G.;Li,F.Y.;Yang,Y.J.Sol-Gel Sci.Technol.2006,39,151.doi:10.1007/s10971-006-9172-2
(22) Feng,Y.Y.;Gu,M.;Du,Y.G.Acta Chim.Sin.2012,70,831. [冯砚艳,辜 敏,杜云贵,化学学报,2012,70,831.] doi:10.6023/A1111151
(23)Gan,L.H.;Li,G.M.;Yue,T.Y.;Zhang,M.;Wu,J.W.;Chen, L.W.Acta Phys.-Chim.Sin.1999,15,588.[甘礼华,李光明,岳天仪,张 明,吴建文,陈龙武.物理化学学报,1999,15, 588.]doi:10.3866/PKU.WHXB19990703
(24) Clapsaddle,B.J.;Sprehn,D.W.;Gash,A.E.;Satcher,J.H.,Jr.; Simpson,R.L.J.Non-Cryst.Solids 2004,350,173.doi: 10.1016/j.jnoncrysol.2004.06.025
(25) Li,G.P.;Li,N.K.;Luo,Y.J.;Gao,K.;Chen,R.J.J.Beijing Inst.Technol.2011,31,1335. [李国平,李念珂,罗运军,高 坤,陈人杰.北京理工大学学报,2011,31,1335.]
(26) Gash,A.E.;Satcher,J.H.,Jr.;Simpson,R.L.J.Non-Cryst. Solids 2004,350,145.doi:10.1016/j.jnoncrysol.2004.06.030
(27) Rao,A.V.;Hegde,N.D.;Hirashima,H.J.Colloid Interface Sci. 2007,305,124.doi:10.1016/j.jcis.2006.09.025
(28)Sing,K.S.W.;Everett,D.H.;Haul,R.A.W.Pure Appl.Chem. 1985,57,603.doi:10.1351/pac198557040603
July 23,2012;Revised:September 12,2012;Published on Web:September 28,2012.
Rapid Preparation of Highly Doped CuO/SiO2Composite Aerogels
XU Wei-Wei DUAi*TANG Jun CHEN Ke ZOU Li-Ping ZHANG Zhi-Hua SHEN Jun ZHOU Bin*
(Shanghai Key Laboratory of Special Artificial Microstructure Materials and Technology,School of Physical Science and Engineering,Tongji University,Shanghai 200092,P.R.China)
Highly doped CuO/SiO2composite aerogels were prepared via a propylene oxide pre-reaction method with acetonitrile as solvent.In a typical synthesis process,tetramethoxysilane(TMOS),acetonitrile, deionized water,and propylene oxide were mixed together for pre-reaction.The solutions were then mixed with a CuCl2acetonitrile-water solution,with added propylene oxide.The mixed solutions were transformed to the wet gels after being kept in the oven for 0.5 h at 35°C.The dark monolithic CuO/SiO2composite aerogels were obtained after drying with supercritical CO2and following thermal treatment.The density, specific surface area,average doping concentration,and compression modulus of the final aerogel samples were about 180 mg·cm-3,625 m2·g-1,19.91%±2.42%(Cu:Si molar ratio),and 1.639 MPa, respectively.The aerogels,which were ideal materials for backlight targets,featured good formability and uniform dispersion.The gelation mechanism was also discussed by comparing our typical synthetic process with reference experiments.The results demonstrated that the reaction rates of the two precursors were balanced by changing the solvent and using the propylene oxide pre-reaction method,which realized the co-gelation.In addition,the method may inspire new synthetic ideas for preparation of other metal-oxide/silica composite aerogels.
Pre-reaction;Highly doping;Copper oxide;Composite aerogel;Propylene oxide; Co-gelation
10.3866/PKU.WHXB201209282
∗Corresponding authors.ZHOU Bin,Email:zhoubin863@tongji.edu.cn;Tel:+86-21-65982762.DUAi,Email:duai@tongji.edu.cn.
The project was supported by the National Natural Science Foundation of China(51102184,51172163),National High Technology Research and Development Program of China(863),National Key Technology Research and Development Program of China(2009BAC62B02),Program for Young Excellent Talents in Tongji University,China(2010KJ068),and Doctoral Fund of Ministry of Education of China(20090072110047, 20100072110054).
国家自然科学基金(51102184,51172163),国家高技术研究发展计划(863),国家科技支撑计划(2009BAC62B02),同济大学青年优秀人才培养行动计划(2010KJ068)和教育部博士点基金(20090072110047,20100072110054)资助项目
O648

