新疆野生党参总黄酮体内抗氧化及抗疲劳作用研究
汪建红,原 慧,李雪红
1新疆师范大学生命科学学院,乌鲁木齐830054;2新疆兽药饲料监察所,乌鲁木齐830063
党参为桔梗科植物党参属党参Codonopsis pilosula(Franch.)Nannf.多年生草本。其抗寒性、抗旱性、适生性都很强。中国东北、华北、西北各地都有分布。传统医学认为,党参具有补中益气、生津止渴、活血化瘀、调理脾胃、健脾益肺等作用,因而,党参除了药用以外,已成为广大民众日常食用、饮用的补品。现代药理研究发现,党参可以增强体质,提高人体免疫力,具有抗衰老、抗氧化、抗缺氧、抗疲劳、抗肿瘤、增强记忆和提高学习能力等功能;现代药学试验证明,党参含有多糖、皂甙、生物碱、黄酮、挥发油等多种天然药理活性成分[1-5]。黄酮是其主要药效成分之一[6]。新疆野生党参Codonopsis clematidea (Schrenk)Clarke.生于海拔1500~2500 m的山坡及云杉林下[7]。南北疆均有分布,资源丰富。然而,有关新疆野生党参的研究报道很少见。尤其是对新疆野生党参黄酮体内抗氧化抗疲劳的研究还未见报道。研究发现运动疲劳的产生与运动时产生的自由基对机体的损害、能源物质的耗竭及代谢产物的堆积有关,故本实验选择了超氧化物歧化酶(SOD)、丙二醛(MDA)、肝糖原、肌糖原、血清尿素氮等指标进行检测,用于探讨新疆野生党参黄酮类化合物的抗氧化抗疲劳生理功效,旨在为合理开发利用新疆野生党参植物资源提供实验依据。
1 实验材料
1.1 主要仪器
FC204电子分析天平(上海天普分析仪器有限公司);722N可见分光光度计(上海精密科学仪器有限公司);TDL-60B型低速台式离心机(上海安亭科学仪器厂);HWS2B型电热恒温水浴锅(上海一恒科技有限公司);RE-52旋转蒸发器(上海青浦泸西仪器厂);聚酰胺(30~60目,150~200目);聚酰胺薄膜(浙江台州四清化工厂生产);Sephadex LH-20(Pharmmacia公司产品,进口分装);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司)。
1.2 实验试剂
超氧化物歧化酶(SOD)测定试剂盒、丙二醛(MDA)测定试剂盒、血清尿素氮测定试剂盒、考马斯亮兰蛋白测定试剂盒(南京建成生物工程研究所);甲醇、乙醇、乙酸乙酯等均为RA级(天津试剂公司生产)
1.3 实验样品与动物
实验样品:新疆野生党参采自乌鲁木齐市南山水西沟,自然风干,总黄酮由本实验室提取,提取方法见李云志,曾凡骏黄酮提取法[8](提取工艺流程:秤取一定量自然风干研碎的新疆野生党参粉末,用95%的乙醇回流加热提取,提取液用石油醚萃取,直至醚层无色,然后用乙酸乙酯多次萃取,直至酯层无色,合并提取液并减压浓缩至膏状,将萃取物用水溶解,抽滤,上聚酰胺柱(30~60目),先用去离子水洗脱,再用甲醇梯度洗脱,分部收集,TLC检测,归并。薄层溶剂系统:甲醇∶氯仿∶丁酮=3∶7∶0.5,30~50%的甲醇部分上聚乙酰柱(150~200目),收集50%部分,蒸馏水溶解,上Sephadex LH-20柱,乙醇梯度洗脱,纯化得黄色粉末。含量测定:经分光光度法,以芦丁为标准品绘出标准曲线,在510 nm处测定吸光度值,由回归方程计算出黄酮含量为39.64%)。样品用蒸馏水溶解,稀释至所需浓度,置冰箱4℃保存备用。
实验动物:昆明种小白鼠,雄性,体重18~22 g,购于新疆医科大学实验动物中心。
2 实验方法
取体重18~22 g的健康昆明种雄性小鼠160只,在实验条件下适应喂养5 d后开始实验:随机将小鼠分为4组,空白对照组、低剂量组、中剂量组与高剂量组。给每只小鼠标号分组,称体重,换算灌胃剂量,以后每天定时给小鼠灌胃,观察小鼠状况,并且每三天称体重确定继续灌胃量。低剂量组、中剂量组、高剂量组每天分别一次性灌胃0.25、0.5、1 mg/kg体重新疆野生党参黄酮溶液,空白对照组灌胃生理盐水。连续灌胃25 d,灌胃期间自由取水和饮食。
2.1 小鼠血清、肝脏SOD、MDA值测定
灌胃处理25 d后,每组随机选取10只小鼠,于末次灌胃30 min后,摘眼球取血,分离血清用于测定血清SOD、MDA值;颈椎脱臼处死小鼠,迅速解剖取出肝脏制备肝组织匀浆用于测定肝脏SOD、MDA值。
2.1.1 超氧化物歧化酶(SOD)的测定
采用黄嘌呤氧化酶法测定并计算出被测样品的SOD活力。
2.1.2 丙二醛(MDA)
采用硫代巴比妥酸法(Thibabituric acid,TBA)测定并计算出被测样品的MDA含量。
2.1.3 蛋白质含量测定
采用考马斯亮兰显色法测定并计算出肝组织蛋白质含量。
2.2 负重游泳实验
连续灌胃25 d后,每组各选取10只小鼠,于末次灌胃30 min后,尾跟部负荷5%体重的铅皮,置小鼠于水深30 cm,直径15 cm,水温27~30℃的玻璃缸中,记录小鼠自入水开始到头部全部没入水中8 s不能浮出水面为止的时间,作为小鼠游泳的时间。
2.3 小鼠肝糖原、肌糖原的测定
灌胃处理25 d后,每组随机选取10只小鼠,于末次灌胃30 min后,颈椎脱臼处死小鼠,迅速取出小鼠肝脏和后腿肌肉,生理盐水漂洗,滤纸吸干,精确称取0.5 g,提取糖原进行肝糖原与肌糖原的测定。采用蒽酮硫酸比色法分别测定并计算出被测样品的肝糖原、肌糖原含量。
2.4 小鼠血清尿素氮(BUN)测定
连续灌胃25 d后,每组各选取10只小鼠,于末次灌胃30 min后,置小鼠于水深30 cm,直径15 cm,水温27~30℃的玻璃缸中游泳30 min,摘眼球采血,分离血清用于血清尿素氮的测定。采用Fearon反应比色法测定并计算出被测样品的尿素氮(BUN)含量。
2.5 统计学处理
3 结果
3.1 新疆野生党参黄酮类化合物对小鼠SOD活力的影响
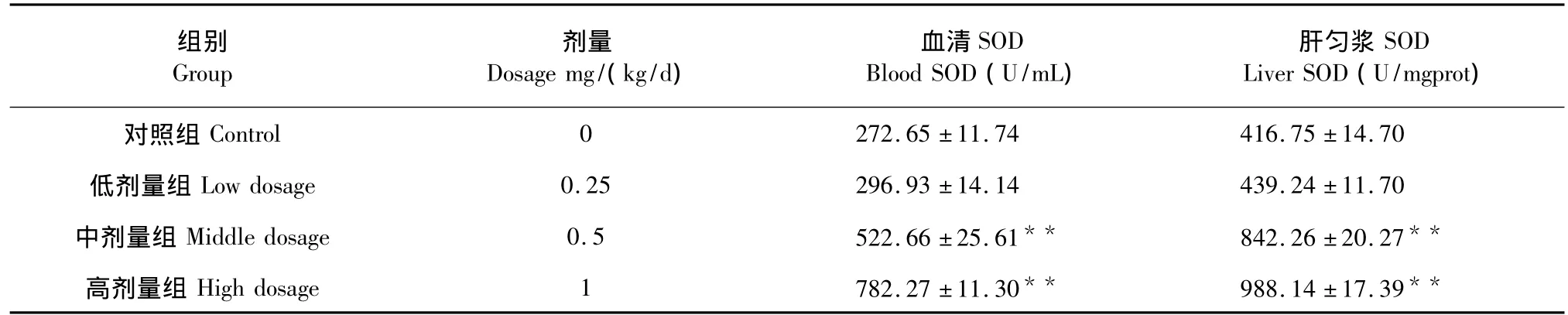
表1 新疆野生党参黄酮类化合物对小鼠SOD活力的影响(n=10)Table 1 Effect of C.clematidea flavonoid on SOD activities of mice(n=10)
由表1数据可知,与对照组比较,低剂量组、中剂量组、高剂量组的血清 SOD活力分别升高8.90%、91.70%、186.91%,其中中剂量组和高剂量组有极显著差异(P<0.01);与对照组比较,低剂量组、中剂量组、高剂量组的肝匀浆SOD活力分别升高5.40%、102.10%、137.11%,其中中剂量组和高剂量组均有极显著差异(P<0.01)。低剂量组血清SOD活力与肝匀浆SOD活力与对照组比较有所升高,但均无显著性差异(P>0.05)。
3.2 新疆野生党参黄酮类化合物对小鼠MDA值的影响
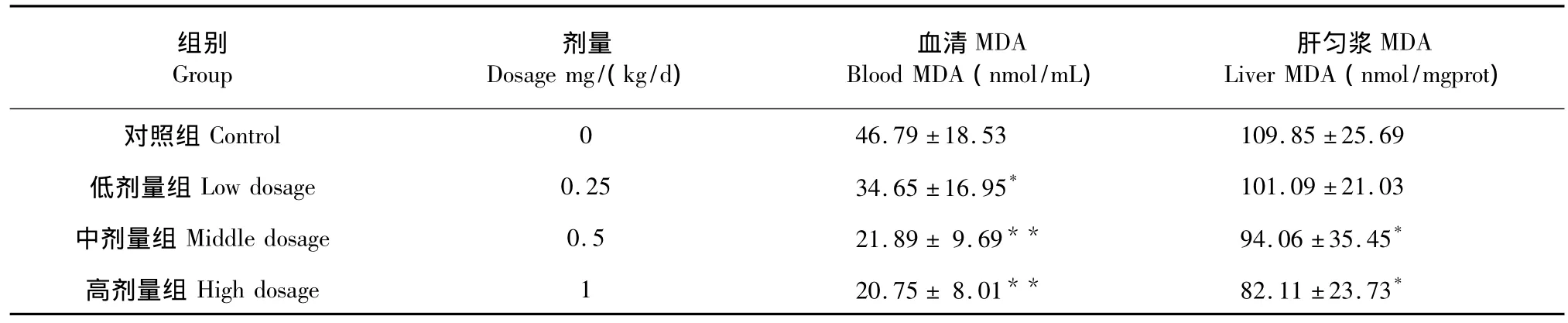
表2 新疆野生党参黄酮类化合物对小鼠MDA值的影响(n=10)Table 2 Effect of C.clematidea flavonoid on MDA content of mice(n=10)
由表2数据可知,与对照组比较,低剂量组、中剂量组、高剂量组血清MDA值分别降低25.95%、53.22%、55.65%,高剂量组、中剂量组均有极著差异(P<0.01),低剂量组有显著差异(P<0.05);低剂量组、中剂量组、高剂量组肝组织匀浆MDA值分别降低7.97%、14.37%、25.25%,高剂量组和中剂量组有显著差异(P<0.05),低剂量组肝匀浆MDA含量与对照组比较有所降低,但无显著性差异(P>0.05)。
3.3 新疆野生党参黄酮类化合物对负重小鼠游泳时间的影响
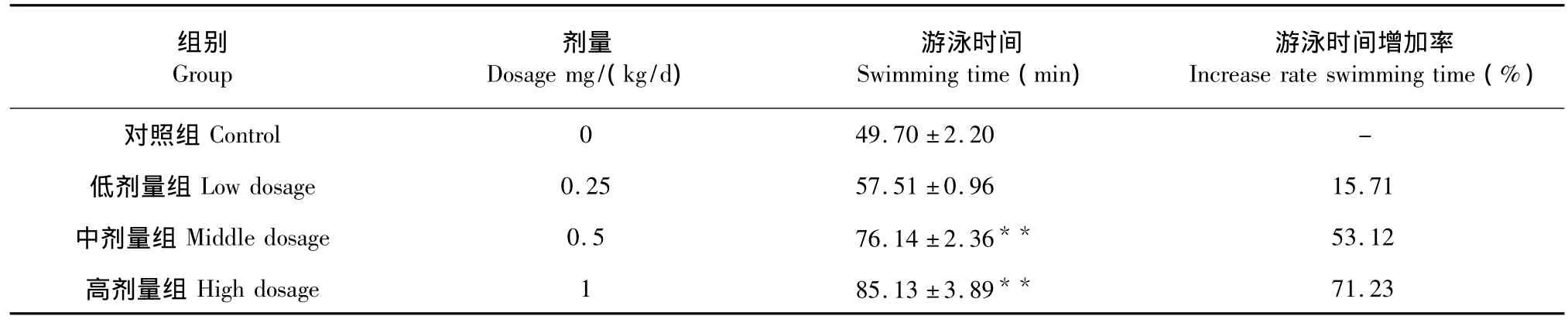
表3 新疆野生党参黄酮类化合物对小鼠负重游泳时间的影响(n=10)Table 3 Effect of C.clematidea flavonoid on swimming time of loaded mice(n=10)
由表3数据可知,低剂量组、中剂量组、高剂量 组比对照组小鼠游泳时间分别增加了15.71%、 53.20% 、71.29%,其中,中剂量组、高剂量组游泳时间与对照组比较有极显著差异(P<0.01),表明能极显著延长小鼠游泳时间,低剂量组与对照组比较游泳时间有所升高,但无显著差异(P>0.05)。
3.4 新疆野生党参黄酮类化合物对小鼠肝糖原、肌糖原的影响

表4 新疆野生党参黄酮类化合物对小鼠肝糖原、肌糖原的影响(n=10)Table 4 Effect of C.clematidea flavonoid on liver glycogen and muscle glycogen of mice(n=10)
由表4数据可知,低剂量组、中剂量组、高剂量组的肝糖原含量比对照组分别升高 11.43%、52.86%和105.71% ,其中高剂量组有极显著差异(P<0.01)、中剂量组有显著差异(P<0.05)、低剂量组虽有所上升,但无显著差异(P>0.05);与对照组比较,低剂量组、中剂量组、高剂量组的肌糖原含量分别升高56.52%、143.48%和147.83%,低剂量组、中剂量组、高剂量组均有极显著差异(P<0.01)。
3.5 新疆野生党参黄酮类化合物对小鼠血清尿素氮的影响
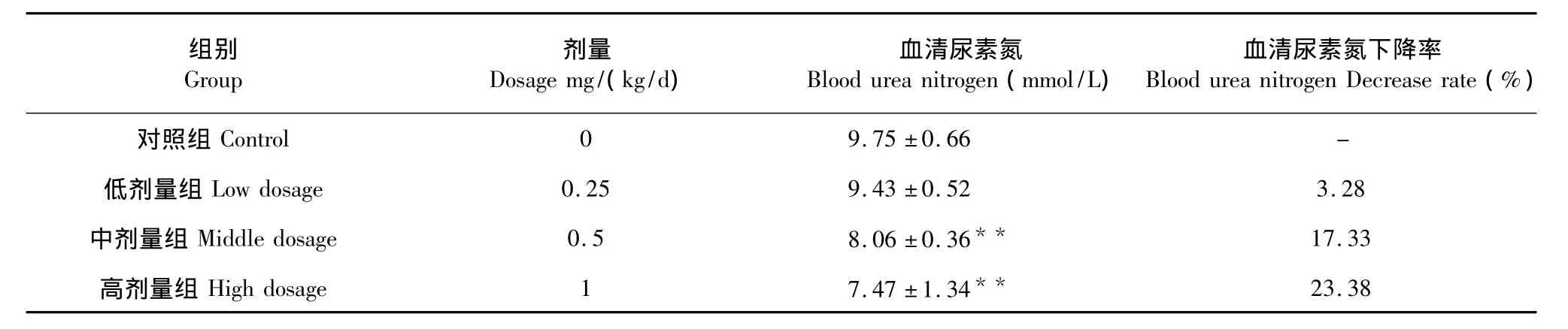
表5 新疆野生党参黄酮类化合物对小鼠血清尿素氮的影响(n=10)Table 5 Effect of C.clematidea flavonoid on blood urea nitrogen of mice(n=10)
从表5得知,低剂量组、中剂量组、高剂量组与对照组相比较,运动后小鼠低剂量组、中剂量组、高剂量组的血清尿素氮含量分别降低 3.28%、17.33%和23.38%,其中高剂量组、中剂量组均有极显著差异(P<0.01),低剂量组虽有所下降,但无显著差异(P>0.05)。
4 讨论
近些年来,随着对自由基研究的不断深入,衰老的自由基学说,运动疲劳运动损伤的自由基学说相继被提出。药用植物的有效成分如多糖、皂甙、黄酮等,作为天然抗氧化剂备受广大学者的关注。黄酮类化合物的抗氧化作用是指其对单线态氧(1O2)和含氧自由基的清除能力。生物体内含氧自由基包括超氧阴离子自由基(O-·2)、羟基自由基(·OH)和脂质过氧化自由基(ROO·)[9]。此类自由基可与体内大量生命所必需的分子(如核酸、蛋白质)相互作用,从而对后者产生毒害作用[10]。类黄酮作为非常强的自由基消除剂以及单线态氧消除剂,可抑制脂质的过氧化作用。而且,类黄酮与过氧化自由基相反应,还终止了自由基的链式反应。Bombardelli和Morazzoni[11]观察到,当一种多不饱和脂肪酸产生自动氧化时,类黄酮主要通过以下几点显出它们的抗氧化作用:(1)抗自由基活性(·OH,羟基;O2-·,超氧化物);(2)抗脂质氧化活性(R·,烷基;ROO·,过氧基;RO·,烷氧基);(3)抗氧活性(O2-·;1O2); (4)金属鳌合活性。
SOD是机体清除氧自由基的重要酶,直接反映机体抗氧化水平。MDA是自由基引起的脂质过氧化的主要产物之一,MDA含量可间接表现机体抗氧化能力及清除氧化产物的能力。负重游泳实验是评价抗运动性疲劳的重要指标。近来有学者提出运动引起的脂质过氧化反应加强而产生较多的自由基,会导致肌纤维膜及线粒体膜等生物膜完整性丧失及损伤,从而引发一系列细胞代谢机能紊乱,细胞广泛性损害及病理变化,使肌肉工作能力下降产生疲劳。研究发现用药物抑制动物体内的SOD活性后,大鼠肌肉最大强直张力减少28%~52%,而给动物注射几种自由基清除剂后可明显降低自由基反应,显著延长大鼠游泳时间[12]。本试验研究表明短期灌胃新疆野生党参黄酮类化合物三个浓度剂量组均可以延长负重小鼠的游泳时间,提高小白鼠的运动能力,而且,在一定范围内,随浓度增加游泳时间增加明显。以中剂量组(0.5 mg/kg/d)和高剂量组(1 mg/ kg/d)效果最佳(P<0.01)(见表3)。本试验研究3.1数据表明,短期灌胃新疆野生党参黄酮类化合物后,中、高剂量给药组的血清SOD活力明显高于对照组(P<0.01);高、中剂量给药组小鼠肝脏的SOD活力与对照组相比有极显著升高(P<0.01) (见表1);与对照组相比,高、中剂量给药组小鼠的血清MDA值有极显著降低(P<0.01),低剂量给药组小鼠的血清MDA值有显著降低(P<0.05);高、中剂量给药组小鼠肝脏中的MDA值与对照组相比有明显降低(P<0.05)(见表2)。该结果表明新疆野生党参黄酮类化合物能提高SOD活力,减少自由基的堆积,有助于体内脂质过氧化物的清除,从而延缓疲劳出现,推测这是服药组小鼠游泳耐力显著提高的重要机制之一。
糖原是运动中最重要的能源物质,机体剧烈运动后大量糖原被消耗,因此糖原储备可作为评价机体抗疲劳的另一重要指标。本研究分别测试了新疆野生党参黄酮类化合物三个浓度剂量组对小鼠肝糖原、肌糖原的影响,并与对照组比较。结果显示,中、高剂量给药组的肝糖原含量有显著升高(中剂量组:P<0.05,高剂量组:P<0.01),低剂量组、中剂量组、高剂量组给药组小鼠的肌糖原含量均有极显著升高(P<0.01)(见表4)。该结果提示,新疆野生党参黄酮类化合物对维持肝糖原、肌糖原含量的水平有积极作用,从而延缓疲劳的出现。研究表明机体血尿素含量随劳动及运动负荷的增加而增加,机体对负荷的适应能力越差,血尿素的增加就越明显。本研究结果显示,游泳后中、高剂量给药组的血清尿素氮含量水平显著低于对照组(P<0.01)(见表5),提示新疆野生党参黄酮类化合物能使小鼠的运动负荷能力提高,不易发生疲劳。
1 He Q(贺庆),Zhu EY(朱恩圆),Wang ZT(王峥涛),et al.Study on chemical constitutes of Codonopsis pilosula.Chin Pharm J(中国药学杂志),2006,41:10-12.
2 Jin XJ(晋小军),Huang HY(黄惠英),Li GQ(李国琴),et al.Effect of different package onsaponins content of Codeonopsis filosulsa.Chin Wild Plant Resourse(中国野生植物资源),2002,21(5):57-59.
3 Zhu EY(朱恩圆),He Q(贺庆),Wang ZT(王峥涛),et al.Chemical study on the root of Codonopsis pilosula.J Chin Pharm Univ(中国药科大学学报),2001,32(2):94-95.
4 Chen KK(陈克克).Research progress in Codonopisis pilosula.J Xi'an Arts Sci Coll,Nat Sci(西安文理学院学报(自然科学版)),2008,11(2):33-39.
5 Cao L(曹丽),Luo CN(罗崇念),Bian QY(卞庆亚),et al.Promotive effect of Codonopsis pilosula polysaccharide on IL-2 inductive activity and lymphocyte proliferative reaction in chickens.J Tradit Chin Vet Med(中兽医医药杂志),2004,23:3-4.
6He Q(贺庆),Zhu EY(朱恩圆),Wang ZT(王峥涛).Flavones isolated from Codonopsis xundianensis.Chin Pharm Sci (中国药学),2004,13:212-213.
7 Li D(李都),Yin LK(尹林克).Wild plant of Chinese Xin Jiang(中国新疆野生植物).Urumuqi:Juvenile Publishing House 2006.90.
8 Li YZ(李云志),Zeng FJ(曾凡骏).Isolation and structure identification of theflavonoid from the leaves of acer truncatum bunge.Nat Prod Res Dev(天然产物研究与开发),2006,18:426-427.
9 Jia DY(贾冬英),Yao K(姚开),Lv YP(吕远平),et al.Antioxidant activity research development of Citrus flavonoid.Guangdong Food Ind(广东食品工业),2002,18 (4):66-68.
10 Benavente-García O,Castillo J,Marin FR,et al.Uses and propertis of Citrus flavonoids.J Agric Food Chem 1997,45: 4505-4516.
11 Benavente-García O,Castillo J,del Rio Conesaet JA.Changes in neodiosmin levels during the development of Citrus aurantium leaves and fruits.Postulation of a neodiosmin biosynthetic pathway.J Agric Food Chem,1993,41:1916-1919.
12 Wang ZY(王竹影).Effect of FDP fructose upon the capacity of exercise and resisting fatigue.J Chengdu Phys Educ Insit (成都体育学院学报),2002,28(3):94-96.

