成人生长激素缺乏症患者骨保护素水平的研究
李林蔓,任 伟,李金超,刘静婧,刘秀蓉,刘德珍,王玲莉
近年来,流行病学研究表明骨质疏松与动脉硬化存在密切联系。Kiel等[1]在对554人进行了长达25年的追踪观察发现,骨量丢失严重的老年女性同时有腹主动脉钙化严重的表现,提示两者存在一定相关性。Shaffer等[2]为了解骨质疏松和动脉硬化之间关系,对890人的骨密度和颈动脉内膜厚度 (IMT)关系进行研究发现,老年人降低的骨密度与增高的IMT相关。临床上,许多慢性炎症性疾病患者以及绝经后的妇女和老年人也表现为同时增高的动脉粥样硬化和骨质疏松发生率。这些研究结果提示,有一个共同的通路同时影响着骨代谢和心血管疾病[3]。1997年,骨保护素 (osteoprotegerin,OPG)作为骨代谢的一个重要调节因子被发现,它属于肿瘤坏死因子超家族成员,主要通过与核因子-κB受体活化因子配体 (RANKL)竞争破骨细胞分化因子受体 (RANK)从而抑制破骨细胞分化和活动,起到抑制骨质破坏和吸收的重要作用[4]。Bucay等[5]研究发现OPG缺乏 (OPG-/-)的小鼠模型出现严重的骨质疏松和意想不到的显著的血管钙化,而转录入OPG基因可减少骨量的丢失和动脉粥样硬化的发生[6]。因此,推测OPG也许是联系骨和血管疾病的关键环节。成人生长激素缺乏症(AGHD)同样也是同时表现出骨代谢改变以及心血管疾病的发病率和病死率增高的慢性炎症性疾病,其骨代谢方面表现为骨密度降低、骨质疏松和增加近3倍的骨折发生率[7];而心血管疾病更是影响生存时间的主要并发症。本研究通过测定AGHD患者血清OPG水平,了解其在AGHD患者中的水平及其与体质指数 (BMI)、血压、空腹血糖 (FPG)、空腹胰岛素(FINS)、血脂、超敏C反应蛋白 (hs-CRP)的关系,明确以动脉粥样硬化和骨质疏松为主要临床表现的AGHD患者的身体组成改变,及其是否存在OPG水平的改变以及OPG变化是否与心血管疾病的发病风险增加有关。
1 对象与方法
1.1 研究对象 选择重庆医科大学附属第一医院2009年6月—2012年6月复诊的垂体腺瘤术后患者37例 (术后>6个月)和席汉综合征患者8例为AGHD组,其中男14例,女31例;平均年龄 (51.3±10.8)岁。除生长激素以外存在其他激素缺乏的患者均进行了充分、稳定的激素替代治疗半年以上。均进行胰岛素低血糖-生长激素刺激试验 (ITT试验)[8]确诊为AGHD。另选择性别、年龄与AGHD组匹配的40例体检健康者为对照组,其中男12例,女28例;平均年龄 (47.2±12.1)岁。均除外恶性肿瘤、糖尿病、心脏病、肝肾功能障碍、严重高血压、癫痫、精神病等病史[9]。纳入对象对试验均知情同意。
1.2 研究方法
1.2.1 基础资料收集 被测量者去鞋,穿轻薄衣物。测量身高、体质量、血压、腰围、臀围,通过生理电阻抗分析(BIA)方法测定身体脂肪率,并计算BMI和腰臀比。
1.2.2 血生化指标检测 所有受试者空腹12 h后次晨抽静脉血,乙二胺四乙酸 (EDTA)抗凝分离血浆后-80℃保存,用于OPG的测定。空腹新鲜血清采用葡萄糖氧化酶法测定FPG,采用化学发光法测定FINS;采用酶法测定总胆固醇 (TC)、三酰甘油 (TG)、高密度脂蛋白胆固醇 (HDL-C)、低密度脂蛋白胆固醇 (LDL-C);采用散色比浊法测定hs-CRP。以稳态模型评价胰岛素抵抗指数 (HOMA-IR=FPG×FINS/22.5)及β细胞胰岛素分泌指数〔HOMA-β=FINS×20/(FPG -3.5)〕。
1.3 统计学方法 采用SPSS 17.0统计软件包进行统计学处理,计量资料以±s)表示,采用t检验;相关性分析采用Pearson相关及多元线性回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 临床指标比较 AGHD组腰臀比高于对照组,差异有统计学意义 (P<0.05);两组性别、年龄、BMI、体脂率、血压比较,差异均无统计学意义 (P>0.05,见表1)。
2.2 实验室检查指标比较 AGHD组FPG、HDL-C水平低于对照组,hs-CRP、OPG水平高于对照组,差异均有统计学意义 (P <0.05);两组 FINS、HOMA - β、HOMA-IR、TC、TG、LDL-C水平比较,差异均无统计学意义 (P>0.05,见表2)。
2.3 OPG的相关和线性回归分析 OPG与hs-CRP呈正相关(r=0.353,P <0.05),与HDL -C呈负相关 (r= -0.245,P<0.05)(见图1),与年龄、性别、BMI、体脂率、腰臀比、SBP、DBP、FPG、FINS、HOMA - β、HOMA-IR、TC、TG、HDL-C、LDL-C无直线相关性 (P>0.05)。
以OPG为应变量,以hs-CRP、HDL-C为自变量,行多元线性回归分析,HDL-C进入回归方程,Y=158.144+4.894 × XHDL-C(R2=0.126,P <0.05)。
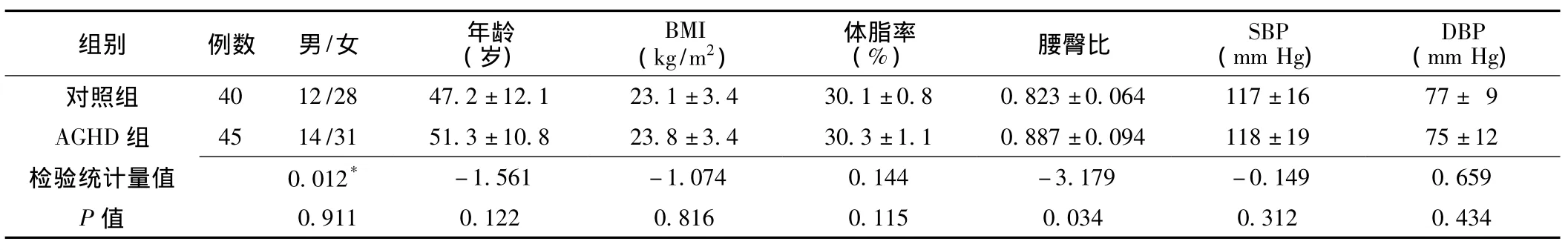
表1 对照组与AGHD组临床指标比较Table 1 Comparison of clinical indexes between control group and AGHD group
表2 对照组与AGHD组实验室检查指标比较 ±s)Table 2 Comparison of biochemical indexes between control group and AGHD group
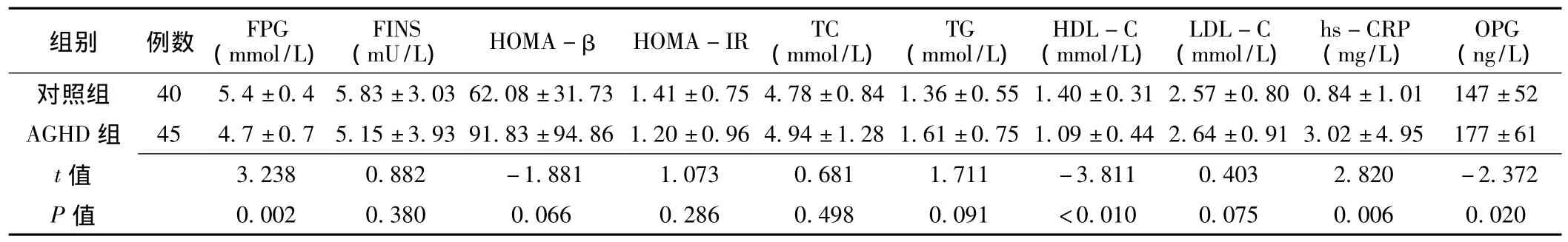
表2 对照组与AGHD组实验室检查指标比较 ±s)Table 2 Comparison of biochemical indexes between control group and AGHD group
注:FPG=空腹血糖,FINS=空腹胰岛素,HOMA-β=β细胞胰岛素分泌指数,HOMA-IR=胰岛素抵抗指数,TC=总胆固醇,TG=三酰甘油,HDL-C=高密度脂蛋白胆固醇,LDL-C=低密度脂蛋白胆固醇,hs-CRP=超敏C反应蛋白,OPG=骨保护素
组别 例数 FPG(mmol/L)(mU/L) HOMA-β HOMA-IR TC(mmol/L)FINS TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)hs-CRP(mg/L)OPG(ng/L)±1.01 147 ±52 AGHD 组 45 4.7 ±0.7 5.15 ±3.93 91.83 ±94.86 1.20 ±0.96 4.94 ±1.28 1.61 ±0.75 1.09 ±0.44 2.64 ±0.91 3.02 ±4.95 177 ±61 t对照组 40 5.4 ±0.4 5.83 ±3.03 62.08 ±31.73 1.41 ±0.75 4.78 ±0.84 1.36 ±0.55 1.40 ±0.31 2.57 ±0.80 0.84 75 0.006 0.020 403 2.820 -2.372 P 值 0.002 0.380 0.066 0.286 0.498 0.091 <0.010 0.0值3.238 0.882 -1.881 1.073 0.681 1.711 -3.811 0.
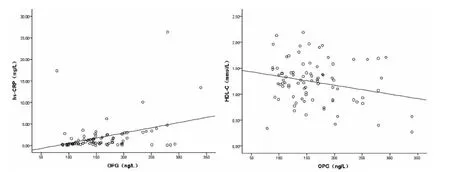
图1 OPG与hs-CRP、HDL-C的相关关系Figure 1 Relationship between OPG and hs-CRP,HDL-C
3 讨论
生长激素作用极为广泛,生物效应复杂,在儿童主要起促进生长发育的作用,在成人主要起调节物质代谢的作用。因此生长激素缺乏对成人的身体组分、脂代谢、糖代谢、骨代谢以及生活质量都有一系列的影响。
AGHD患者在身体组分上的改变常表现为肌肉量减少,脂肪量增多,出现中心性肥胖[10]。本研究结果显示,AGHD组的体脂率与对照组无差异,然而其腰臀比高于对照组。已有较多研究提示腰臀比的增大是动脉粥样硬化[11]和心血管事件[12]的预测因子之一。Chagas等[13]为观察人体测量指标,如腰围、臀围、颈围、BMI、腰臀比、腰高比 (WHtR)等与冠状动脉严重程度的关系,对337位行冠脉血管造影的受试者以Friesinger Score(FS)评分对冠脉病变的严重程度进行评估,FS评分越高表示冠脉病变程度越重。结果发现,腰臀比与FS评分显著相关,提示在动脉粥样硬化的代谢危险上,脂肪组织的定位比肥胖本身更重要。本研究中,AGHD患者的体脂率尚无明显增高,而其腰臀比显著增大,提示AGHD患者增高的心血管事件的发生率可能与其腰臀比的增大有关。
在日本进行的对110例AGHD患者的一项回顾性研究表明,41%的患者有高胆固醇血症,41%的患者有高三酰甘油血症,48%的患者 LDL-C水平升高,47%的患者HDL-C降低[14],提示AGHD患者易出现血脂谱的紊乱。本研究表明,AGHD组患者的HDL-C水平低于对照组,而TC、TG、LDLC尚无差异。流行病学调查表明,2/3的冠心病患者LDL-C水平虽已降低至目前血脂防治指南的标准,但仍会发生冠心病或冠心病事件[15]。因此目前认为,除其他危险因素外,较低的HDL-C水平是引起心血管事件发生的另一重要因素。Després等[16]对 2 013位受试者进行了为期 5年的随访也显示,HDL-C水平每下降10%,冠心病危险性将增加13%。因此,HDL-C的降低对AGHD患者的心血管事件的发生可能有重要关系。
在糖代谢的改变方面,由于生长激素具有降低葡萄糖利用率起到调节血糖的功能,因此,缺乏生长激素的患儿常出现低血糖的现象。然而,Jørgensen等[17]发现AGHD患者反而表现为胰岛素抵抗和糖耐量的异常。Markussis等[18]认为,这可能是生长激素分泌减少引起的中心性肥胖所致。本研究发现AGHD组与对照组相比,其FINS水平无差异,FPG水平降低,与生长激素拮抗胰岛素作用是一致的。
越来越多的研究表明,炎性因子在心脑血管疾病的发生、发展过程中起到重要作用[19]。作为炎症标志物之一的hs-CRP日益受到关注,被认为是动脉粥样硬化和心脑血管疾病的独立危险因子。一项20年的前瞻性研究表明,在健康成人中,血清hs-CRP水平升高预示未来发生心脑血管疾病的风险明显增加[20]。本研究表明AGHD患者的hs-CRP水平明显高于对照组,表明AGHD人群存在内源性炎症反应,而这提示AGHD患者动脉粥样硬化的发生、发展有慢性炎症的参与。
OPG是1997年Tsuda等[21]在研究胎鼠的cDNA序列的时候首次发现并分离出来的一种分泌型糖蛋白。骨组织的OPG主要由成骨细胞产生,而血管系统的OPG主要由内皮细胞及平滑肌细胞产生。1998年,Lacey等[22]发现了OPG的同源配体,一种Ⅱ型跨膜蛋白——RANKL。其以膜结合和可溶性形式合成于成骨系细胞,免疫细胞以及一些癌细胞。由成骨细胞分泌的RANKL通过与破骨细胞表面受体RANK结合,促使肿瘤坏死因子受体相关因子 (TRAF)2,5和6结合于细胞质,导致了核因子 (NF) -κB活化并迁移到细胞核。NF-κB增加c-Fos的表达,后者与活化T细胞核因子 (NFAT)c1结合促使了破骨细胞的基因转录[23]。而成骨细胞所分泌的OPG则作为RANKL的诱饵受体来阻止RANKL与RANK的结合,控制RANKL的t1/2,从而阻断RANKL的生物学效应。因此,一直以来认为OPG是骨代谢的一个重要调节因子,然而,近来许多研究发现共亦是一种重要的血管调节因子,与动脉粥样硬化和血管钙化关系密切,可能在心血管系统疾病的发生发展中起重要作用[24-27]。
国内外学者对血清OPG水平与冠心病及外周动脉粥样硬化的关系研究表明,血清OPG水平不但与冠心病、动脉粥样硬化的存在显著相关,而且与其严重程度也显著相关,高血清OPG水平是发生冠心病和心血管疾病的独立危险因素,血清OPG水平可以作为评估冠状动脉病变风险及危险分层的指标[28]。并且,推测OPG是联系骨代谢疾病和血管疾病的关键因子。
同样,AGHD患者也是同时易出现骨代谢改变以及心血管疾病的发病率和病死率显著增高的慢性炎症性疾病。诸多研究表明,AGHD患者骨密度降低,易出现骨质疏松症和骨折,其骨折发病率是同年龄正常人群的2.7倍[29]。其机制可能与体内骨转换和骨矿物含量明显降低有关[30]。而AGHD患者心血管疾病病死率增加,那么,AGHD是否存在OPG水平改变及其与增高的心血管疾病发病危险性的关系是怎样的?本研究表明,AGHD患者的OPG水平高于对照组,并且与心血管危险因素hs-CRP、HDL-C相关,HDL-C进入回归方程,提示OPG在AGHD患者心血管疾病发生发展中起到重要作用。
而进一步研究还需在出现心血管并发症的AGHD患者中进行,以明确其心血管疾病的严重程度是否与OPG水平的改变相关,OPG到底是心血管损害负性调节的标志物,起到限制心血管疾病进展的作用,还是活化因子进而起到促进心血管疾病发展的作用以及生长激素替代治疗对AGHD患者体内OPG水平的改变又是怎样的。
1 Kiel DP,Kauppila LI,Cupples LA,et al.Bone loss and the progression of abdominal aortic calcification over a 25 years period:the Framingham Heart Study [J].Calcif Tissue Int,2001,68(5):271 -276.
2 Shaffer JR,Kammerer CM,Rainwater DL,et al.Decreased bonemineral density is correlated with increased subclinical atherosclerosis in older,butnot younger,Mexican American women and men:the San Antonio Family Osteoporosis Study [J].Calcif Tissue Int,2007,81(6):430-441.
3 Kiel DP,Kauppila LI,Cupples LA,et al.Bone loss and the progression of abdominal aortic calcification over a 25 year period:the Framingham Heart Study[J].Calcif Tissue Int,2001,68(5):271-276.
4 Collin-Osdoby P.Regulation of vascular calcification by osteoclast regulatory factors RANKL and osteoprotegerin [J].Circ Res,2004,95(11):1046-1057.
5 Bucay N,Sarosi I,Dunstan CR,et al.Osteoprotegerin -deficientmice develop early onset osteoporosis and arterial calcification[J].Genes Dev,1998,12(9):1260-1268.
6 Min H,Morony S,Sarosi I,et al.Osteoprotegerin reverses osteoporosis by inhibiting endosteal osteoclasts and prevents vascular calcification by blocking a process resembling osteoclastogenesis [J].J Exp Med,2000,192(4):463-474.
7 Rosén T,Wilhelmsen L,Landin - Wilhelmsen K,et al.Increased fracture frequency in adult patients with hypopituitarism and GH deficiency[J].Eur JEndocrinol,1997,137(3):240-245.
8 Consensus guidelines for the diagnosisand treatmentof adultswith growth hormone deficiency:summary statement of the Growth Hormone Research Society Workshop on Adult Growth Hormone Deficiency[J].J Clin Endocrinol Metab,1998,83(2):379-381.
9 Ho KK,2007 GH Deficiency Consensus Workshop Participants.Consensus guidelines for the diagnosis and treatment of adults with GH deficiencyⅡ:a statement of the GH Research Society in association with the European Society for Pediatric Endocrinology,Lawson Wilkins Society,European Society of Endocrinology,Japan Endocrine Society,and Endocrine Society of Australia [J].Eur J Endocrinol,2007,157(6):695-700.
10 Molitch ME,Clemmons DR,Malozowski S,et al.Evaluation and treatment of adult growth hormone deficiency:an Endocrine Society clinical practice guideline[J].JClin Endocrinol Metab,2011,96(6):1587-1609.
11 See R,Abdullah SM,McGuire DK,et al.The association of differing measures of overweight and obesity with prevalent atherosclerosis:the Dallas Heart Study[J].JAm Coll Cardiol,2007,50(8):752 -759.
12 Yusuf S,Hawken S,Ôunpuu S,et al.Obesity and the risk ofmyocardial infarction in 27000 participants from 52 countries:a case-control study[J].Lancet,2005,366(9497):1640 -1649.
13 Chagas P,Caramori P,Barcellos C,et al.Association of different anthropometricmeasures and indices with coronary atherosclerotic burden[J].Arq Bras Cardiol,2011,97(5):397 -401.
14 Itoh E,Hizuka N,Fukuda I,et al.Metabolic disorders in adult growth hormone deficiency:a study of110 patientsata single institute in Japan [J].Endocr J,2006,53(4):539-545.
15 Barter P,Gotto AM,LaRosa JC,et al.HDL cholesterol,very low levels of LDL cholesterol,and cardiovascular events[J].N Engl J Med,2007,357(13):1301-1310.
16 Després JP,Lemieux I,Dagenais GR,et al.HDL - cholesterol as a marker of coronary heart disease risk:the Québec cardiovascular study[J].Atherosclerosis,2000,153(2):263 -272.
17 Jørgensen JO,Vestergaard E,Gormsen L,et al.Metabolic consequences of GH deficiency [J].J Endocrinol Invest,2005,28(5 Suppl):47-51.
18 Markussis V,Beshyah SA,Fisher C,et al.Detection of premature atherosclerosis by high-resolution ultrasonography in symptom-free hypopituitary adults [J].Lancet,1992,340(8829):1188 -1192.
19 Momiyama Y,Ohmori R,Fayad ZA,et al.Association between plasma C-reactive protein levels and the severities of coronary and aortic atherosclerosis[J].JAtheroscler Thromb,2010,17(5):460 -467.
20 Curb JD,Abbott RD,Rodriguez BL,et al.C - reactive protein and the future risk of thromboembolic stroke in healthymen [J].Circulation,2003,107(15):2016-2020.
21 Tsuda E,Goto M,Mochizuki S,et al.Isolation of a novel cytokine from human fibroblasts that specifically inhibitsosteoclastogenesis [J].Biochem Biophys Res Commun,1997,234(1):137-142.
22 Lacey DL,Timms E,Tan HL,et al.Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation [J].Cell,1998,93(2):165-176.
23 Caetano-Lopes J,Canhão H,Fonseca JE.Osteoblasts and bone formation [J].Acta Reumatol Port,2007,32(2):103-110.
24 Vaccarezza M,Bortul R,Fadda R,et al.Increased OPG expression and impaired OPG/TRAIL ratio in the aorta of diabetic rats[J].Med Chem,2007,3(4):387-391.
25 Xiang GD,Sun HL,Zhao LS.Changes of osteoprotegerin before and after insulin therapy in type1 diabetic patients[J].Diabetes Res Clin Pract,2007,76(2):199 -206.
26 SimonetWS,Lacey DL,Dunstan CR,et al.Osteoprotegerin:a novel secreted protein involved in the regulation of bone density [J].Cell,1997,89(2):309-319.
27 BrownerWS,Lui LY,Cummings SR.Associations of serum osteoprotegerin levels with diabetes, stroke, bone density, fractures, and mortality in elderly women [J].JClin Endocrinol Metab,2001,86(2):631-637.
28 Omland T,Ueland T,Jansson AM,et al.Circulating osteoprotegerin levels and long- term prognosis in patients with acute coronary syndromes[J].JAm Coll Cardiol,2008,51(6):627 -633.
29 Wüster C.Fracture rates in patients with growth hormone deficiency[J].Horm Res,2000,54(Suppl 1):31 -35.
30 Elbornsson M,Götherström G,Bosæus I,et al.Fifteen years of GH replacement increases bone mineral density in hypopituitary patients with adult-onset GH deficiency [J].Eur JEndocrinol,2012,166(5):787-795.

