聚乳酸及其共聚物脑靶向载药纳米粒的研究进展
蒋伟,朱宏(南京工业大学材料学院,南京 210009)
近年来,中枢神经系统疾病发病率不断升高,特别是脑部肿瘤和神经退行性疾病发病率及死亡率持续上升。随着生物技术的发展,生化药物在治疗脑部疾病方面发挥着越来越重要的作用,但由于血脑屏障(Blood-brain barrier,BBB)的存在,98%小分子化合物和几乎所有大分子都不能进入脑病变部位,限制了其对脑病的治疗[1]。聚乳酸及其共聚物(PLA/PLGA)是经美国FDA批准作为注射用微球、微囊及组织埋植剂的载体材料,是制备纳米粒(Nanoparticles,NP)药物载体常用的高分子材料之一。在脑靶向载药NP方面,PLA/PLGA由于其良好的生物相容性和生物可降解性,是最为常用的制备材料。目前,脑靶向给药系统正引起越来越多的关注,且已成为靶向给药系统研究的前沿领域之一。为此,本文介绍了BBB的结构和脑靶向递送药物入脑机制,简介了目前PLA/PLGA载药NP的主要制备方法、脑靶向功能分子与载药NP的连接以及PLA/PLGA载药NP脑靶向递药的体内外评价。
1 药物入脑的生理学基础:BBB
BBB是血液循环和脑组织之间的屏障,主要是指脑毛细血管内阻止某些物质由血液进入脑组织的结构。解剖学上,BBB是一层连续的、覆盖在99%脑毛细血管表面的内皮细胞膜,由3个部分组成:最内层为脑毛细血管内皮细胞(Brain microvessel endothelial cells,BMVEC)及其之间的紧密连接,中间为基质和周细胞,最外层是星形胶质细胞和细胞外基质[2]。BMVEC具有明显区别于外周血管的独有特征结构,构成了BBB的机械屏障;此外,其还存在独特的酶系统、高效的外排系统、丰富的线粒体等。BBB如此独特的解剖构造,是维持其生理功能的基础,这样不仅可以十分“挑剔”地吸收脑组织所必需的物质,同时还可以排出有害或过剩物质,保持脑的内部环境稳定,对脑组织起到有效的保护作用[3]。
2 脑靶向递送药物入脑机制
脑靶向递送药物入脑主要是通过受体、吸附或转运体3种介导机制来实现,其中受体介导入脑是目前最为成熟的脑靶向给药机制。此外,鼻腔给药也是一种有效的入脑机制。脑靶向给药系统的各种入脑机制见表1。

表1 脑靶向给药的各种入脑机制
3 PLA/PLGA脑靶向载药NP系统现状及评价
3.1 载药NP制备方法
PLA/PLGA载药NP的制备方法有很多[4],主要有乳化溶剂挥发法(溶媒挥发法)、复乳法(液中干燥法)、溶剂扩散法、盐析法、界面沉积法(相分离法、溶媒-非溶媒法)等。近年来文献[5-22]报道的PLA/PLGA载药NP的制备情况见表2。
乳化溶剂挥发法主要用于脂溶性药物PLA/PLGA载药NP的制备。Gao XL等[23]采用乳化溶剂挥发法制备了载量子点的NP,先将嵌段共聚物聚乙二醇(PEG)-PLA和马来酰亚胺-聚乙二醇-聚乳酸(MAL-PEG-PLA)的混合物溶于含量子点的二氯甲烷溶液中作为有机相,将其加入到胆酸钠水溶液中超声形成乳液,乳液磁力搅拌分散5 min后减压蒸馏除去二氯甲烷,即得到100 nm左右的载量子点NP。载量子点NP表面麦胚凝集素修饰后可用于细胞内的行为示踪及动物脑部的活体成像。
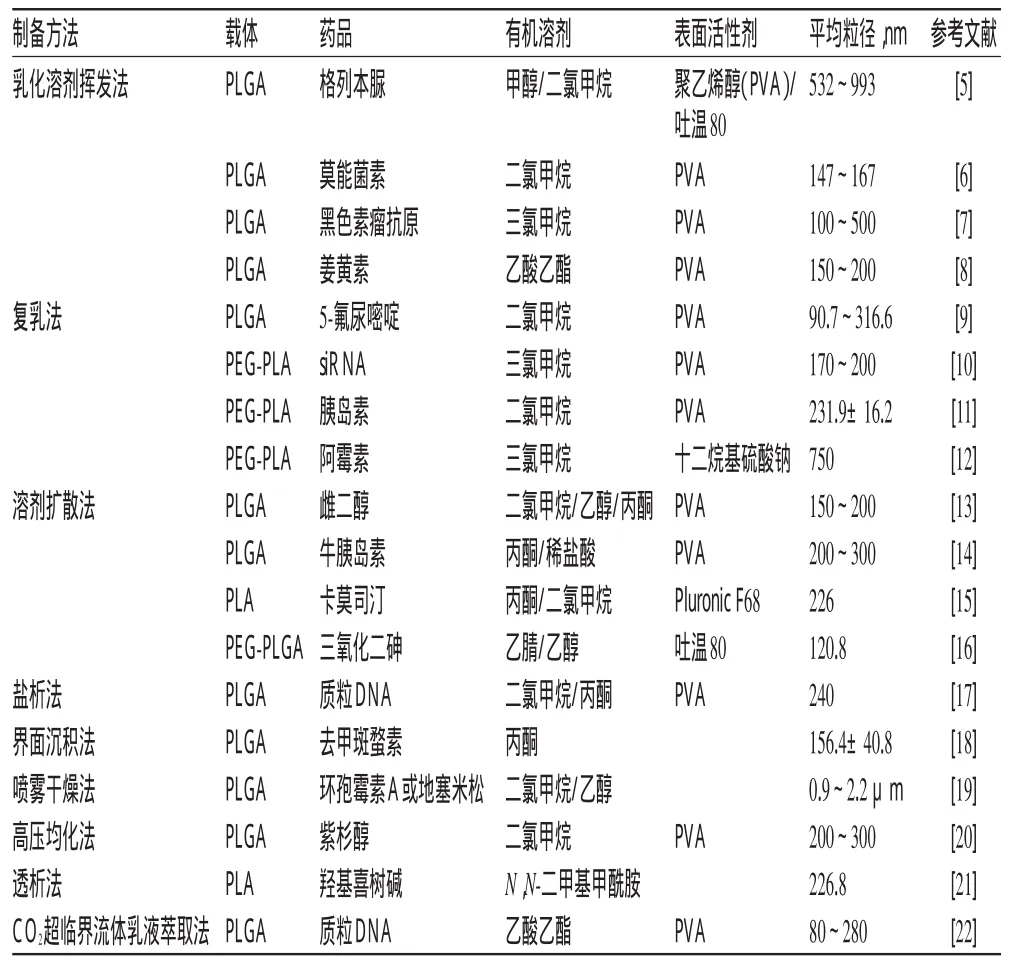
表2 PLA/PLGA载药NP的主要制备方法
复乳法主要用于水溶性药物PLA/PLGA载药NP的制备。Lu W等[24]以PEG-PLA为载体,pORF-hTRAIL(肿瘤坏死因子相关的诱导凋亡配体基因)溶于TE缓冲液为内水相,PEG-PLA二氯甲烷溶液为油相,1%胆酸钠溶液为外水相,以复乳法制备了载质粒DNA的NP,用于脑胶质瘤的基因治疗。
溶剂扩散法也称溶剂萃取法,是在溶剂挥发的同时加上溶剂萃取,可加快微球的形成,制备粒径较小的NP。Tahara K等[25]用此法制备了载多柔比星PLGA-NP,平均粒径230 nm左右,载药量达到7%。细胞试验证实了此法制备的多柔比星PLGA-NP表面用吐温80修饰后,可迅速提高脑胶质瘤细胞的药物摄取量。
3.2 脑靶向功能分子的连接
PLA/PLGA脑靶向载药NP一般由3个部分构成:脑靶向功能分子、PLA/PLGA、药物分子。脑靶向功能分子的连接是指采用某种形式将脑靶向功能分子修饰到载药系统表面的一种制备过程。据国内外文献的报道,PLA/PLGA脑靶向载药NP的靶分子的连接主要分为共价键结合和非共价键连接2种方法。
3.2.1 共价键结合。共价键结合方式是利用靶向功能分子上的巯基、氨基、羧基或马来酰亚胺等活性基团与PLA或PLGA对应基团进行共价结合,形成脑靶向载药NP。Hu KL等[26]借助巯基与马来酰亚胺加成反应的连接方式构建了一种新型可生物降解脑内递药系统——乳铁蛋白(Lactoferrin,Lf)-聚乙二醇聚乳酸纳米粒(PEG-PLA-NP)。PEG-PLA-NP与用2-亚氨基噻吩巯基化的Lf共价连接制得Lf-PEG-PLA-NP,其具有优良的脑靶向特征,酶联免疫吸附试验(ELISA)也证实了Lf-NP表面共价连接有Lf,且每个Lf-NP表面平均连有55个Lf。Guo JW等[27]则采用1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐/N-羟基琥珀酰亚胺(EDC/NHS)活化体系活化PLGA载紫杉醇(PTX)-NP表面的羧基,再与末端有氨基的靶向功能分子AS1411(AS1411是一种核酸适配体,能特异性地与胶质瘤细胞膜上高表达的核仁素相结合)形成酰胺键共价相连接,即得到具有靶向脑胶质瘤细胞的载药NP:AS1411-PTX-PLGANP。
3.2.2 非共价键连接。非共价键结合方式与共价键结合不同的是无化学反应发生,但靶向功能分子连接到载药系统表面后同样也具有较好的脑靶向性。目前利用非共价结合赋予载药系统寻靶能力的策略很少,主要是生物素-亲和素体系脑靶向递药。生物素-亲和素体系靶向给药系统的构建是利用生物素-亲和素之间的强结合力实现靶向功能分子与载药系统的连接。每个亲和素能结合4个分子的生物素,二者之间的亲和力极强,比抗原与抗体间的亲和力至少高1万倍,因此二者的结合特异性高且稳定性好[28]。由于亲和素分子质量大,直接引入到靶分子上会影响其靶向性,因此,通常将生物素引入至靶向功能分子和载药系统上,然后再利用亲和素作桥连剂实现靶向递药系统的构建。Townsenda SA等[29]先分别生物素化PEG-PLGA纳米粒、破伤风毒素C端片段,然后将生物素化的PEG-PLGA纳米粒与亲和素溶液室温孵化一定时间,离心洗涤去除游离的亲和素,再将一定量生物素化的破伤风毒素C端片段与其在室温下搅拌,再离心去除游离的生物素化靶向功能分子,即制得破伤风毒素C端片段-PEG-PLGA脑靶向NP。
3.3 体外评价
脑靶向递药的体外评价主要是建立BBB的体外细胞模型,因为BBB体外细胞模型能够进行机制性研究,还可以进行大规模的药物筛选,预测药物跨越BBB的能力,为评价载药系统的入脑效率提供非常有价值的数据。常用的BBB的体外细胞模型包括大鼠BMVEC单层培养模型及BMVEC-星形胶质细胞共培养模型。
3.3.1 BMVEC单层培养模型。原代培养细胞或永生化的细胞株都可以形成细胞单层,如BMVEC的bEnd.3细胞。如果形成的细胞单层的紧密连接能够完全限制细胞间转运,那么就可以评价载药NP从BMVEC血管侧向脑侧进行的细胞通道转运效率。该模型一般使用培养瓶、微孔滤膜或Transwell插件的垂直培养系统。使用明胶或纤维结合蛋白培养细胞,细胞间紧密连接时,插件的上侧为血管侧,下侧为脑侧。Hu KL等[26]采用bEnd.3作为BBB细胞模型进行了Lf-PEG-PLA脑内递药特性的体外研究,加入包裹有荧光探针的PEG-PLA-NP,用荧光显微镜观察发现,用Lf修饰的NP更容易被吸收。BMVEC单层培养模型的缺点是原代细胞和永生化的细胞在培养过程中会出现基因下调的现象。同时在使用该培养模型评价时,可能会忽略另外一些影响转运的相关因素。
3.3.2 BMVEC-星形胶质细胞共培养模型。BMVEC单层培养由于技术上不易形成致密连接,因此不适用于低透过性物质的研究。由于星形胶质细胞在BBB发育过程中起到至关重要的作用,所以相对于单纯的BMVEC单层培养,星形胶质细胞与BMVEC共培养系统具有更严密的紧密连接,而且相关蛋白的表达水平也更接近人体正常水平,因此更适用于跨BBB的药物入脑研究。该培养模型有2种培养方式,一种是用Transwell插件,使BMVEC生长在培养池的上方,星形胶质细胞生长在培养池下方;另一种是直接接触培养,使BMVEC和星形胶质细胞分别生长在插件的两侧。陆伟[30]在体外建立了大鼠BMVEC和星形胶质细胞共培养模型,阳离子白蛋白(CBSA)结合PEG-PLA-NP,以香豆素6作为示荧光探针,结果其穿透BBB的能力是BSA-PEG-PLA-NP的7.76倍。
3.4 体内评价
载药NP经血管内给药后迅速分布到体内各器官和组织,其在脑内分布如何,需要通过体内评价来考察其脑靶向效率。脑靶向载药NP体内评价是指NP经放射性核素或荧光染料标记后,通过光学成像技术考察其在体内的分布及过程,并用药动学评价技术测定药物在不同时间在体内不同组织的量从而得到体内药物分布的动态数据。
光学成像技术一般有荧光显微镜、活体荧光成像和放射自显影法。荧光显微镜和活体荧光成像考察的是用荧光素和香豆素等荧光染料标记的脑靶向NP,而放射自显影法考察的是用125I、3H、14C等放射性核素标记的脑靶向NP。其中,荧光显微镜和放射自显影法需要采集脑组织样本制成脑组织切片,通过观察脑组织切片标记物的强度来分析药物在脑内的吸收和分布;光学成像技术是定性评价载药NP的脑靶向性,而药动学技术则是定量评价载药NP的脑靶向性。动物给药后,测定不同时间脑组织及血浆中的药物浓度,通过药动学参数的计算,最终得到各种脑摄取参数,从而定量地描述药物的入脑情况。胡凯莉[31]用荧光显微镜观察了载荧光探针香豆素6的Lf-PEG-PLGA、PEG-PLGA 2种NP在大鼠脑组织中的分布和荧光强度,并用高效液相色谱法测定了大鼠不同时间点全血、脑、心、肝、脾、肺、肾中的香豆素6的浓度,最终根据各组织的香豆素6浓度-时间曲线图计算出各组织的曲线下面积。结果Lf-PEG-PLGA与PEG-PLGA相比,前者的入脑效果要明显好于后者。
4 展望
PLA/PLGA载药NP能穿过组织间隙并被细胞摄取,可通过毛细血管壁和血脑屏障进入脑内,在脑内靶向递药方面显示出良好的应用前景。但脑靶向效率偏低是目前脑靶向研究的普遍问题,也是最大的问题。与临床应用药物或普通非靶向载药系统相比,脑靶向系统的脑内递药效率通常仅有数倍的提高,尚未达到质的飞跃。其次PLA/PLGA载药NP中PLA/PLGA较多,体内降解速度慢,长期使用会导致其单体和降解产物的聚集,产生蓄积毒性。因此,提高脑靶向的靶向效率、提高载药量、减少PLA/PLGA的用量、改善PLA/PLGA纳米粒体内降解性能和增加稳定性是今后脑靶向PLA/PLGA载药NP研究的重点方向。
[1]Pardridge WM.Drug targeting to the brain[J].Pharm Res,2007,24(9):1733.
[2]Abbott NJ,Patabendige AA,Dolman DE,et al.Structure and function of the blood-brain barrier[J].Neurobiology of Disease,2010,37(1):13.
[3]Bernacki J,Dobrowolska A,Nierwinska K,et al.Physiology and pharmacological role of the blood-brain barrier[J].Pharmacological Reports,2008,60(5):600.
[4]Lassalle V,Ferreira ML.PLA nano-and microparticles for drug delivery:an overview of the methods of preparation[J].Macromolecular Bioscience,2007,7(6):767.
[5]Behera A,Sahoo SK.Development and in vitro,in vivo evaluation of controlled release,bioco-mpatible nanoparticles[J].Digest Journal of Nanomaterials and Biostructures,2012,7(1):217.
[6]Surolia R,Pachauri M,Ghosh PC.Preparation and characterization of monensin loaded PLGA nanoparticles:in vitro anti-malarial activity against plasmodium falciparum[J].J Biomed Nanotechnol,2012,8(1):172.
[7]Ma W,Chen M,Kaushal S,et al.PLGA nanoparticlemediated delivery of tumor antigenic peptides elicits effective immune responses[J].Int J Nanomedicine,2012,7:1475.
[8]Mathew A,Fukuda T,Nagaoka Y,et al.Curcumin loaded-PLGA nanoparticles conjugated with Tet-1peptide for potential use in alzheimer’s disease[J].PLoS ONE,2012,7(3):e32616.
[9]Ashjari M,Khoee S,Mahdavian AR.A multiple emulsion method for loading 5-fluorouracil into a magnetite-loaded nanocapsule:a physicochemical investigation[J].Polymer International,2012,61(5):850.
[10]Yang XZ,Dou S,Sun TM,et al.Systemic delivery of siRNA with cationic lipid assisted PEG-PLA nanoparticles for cancer therapy[J].Journal of Controlled Release,2011,156(2):203.
[11]Giovino C,Ayensu I,Tetteh J,et al.Development and characterisation of chitosan films impregnated with insulin loaded PEG-b-PLA nanoparticles(NPs):a potential approach for buccal delivery of macromolecules[J].International Journal of Pharmaceutics,2012,428(1/2):143.
[12]Lu TC,Jing XB,Song XF,et al.Doxorubicin-loaded ultrafine PEG-PLA fiber mats against hepatocarcinoma[J].Journal of Applied Polymer Science,2011,123(1):209.
[13]Esmaeili F,Atyabi F,Dinarvand R.Preparation and characterization of estradiol-loaded PLGA nanoparticles using homogenization-solvent diffusion method[J].Daru-Journal of Pharmaceutical Sciences,2008,16(4):196.
[14]Shi K,Cui F,Yamamoto H,et al.Optimized formulation of high-payload PLGA nanoparticles containing insulin-lauryl sulfate complex[J].Drug Development and Industrial Pharmacy,2009,35(2):177.
[15]Yan CH,Yuan XB,Kang CS,et al.Preparation of carmustine-loaded PLA ultrasmall-nanoparticles by adjusting micellar behavior of surfactants[J].Journal of Applied Polymer Science,2008,110(4):2446.
[16]Wang ZQ,Liu W,Xu HB,et al.Preparation and in vitro studies of stealth PEGylated PLGA nanoparticles as carriers for arsenic trioxide[J].Chinese Journal of Chemical Engineering,2007,15(6):795.
[17]Fay F,Quinn DJ,Gilmore BF,et al.Gene delivery using dimethyldidodecylammonium bromide-coated PLGA nanoparticles[J].Biomaterials,2010,31(14):4214.
[18]Zeng QB,Sun M.Poly(lactide-co-glycolide)nanoparticles as carriers for norcantharidin[J].Development of Nanostructures for Medicine Special Issue,2009,29(3):708.
[19]Schafroth N,Arpagaus C,Jadhav UY,et al.Nano and microparticle engineering of water insoluble drugs using a novel spray-drying process[J].Colloids and Surfaces B-Biointerfaces,2012,90:8.
[20]Dong Y,Feng SS.Poly(D,L-lactide-co-glycolide)(PLGA)nanoparticles prepared by high pressure homogenization for paclitaxel chemotherapy[J].International Journal of Pharmaceutics,2007,342(1/2):208.
[21]罗颖,李乐,王衍戈,等.透析法制备载羟基喜树碱-聚乳酸纳米粒及其理化性质研究[J].厦门大学学报,2010,49(6):832.
[22]Mayo AS,Ambati BK,Kompella UB.Gene delivery nanoparticles fabricated by supercritical fluid extraction of emulsions[J].International Journal of Pharmaceutics,2010,387(1/2):278.
[23]Gao XL,Chen J,Chen JY,et al.Quantum dots bearing lectin-functionalized nanoparticles as a platform for in vivo brain imaging[J].Bioconjugate Chemistry,2008,19(11):2189.
[24]Lu W,Sun Q,Wan J,et al.Cationic albumin-conjugated pegylated nanoparticles allow gene delivery into brain tumors via intravenous administration[J].Cancer Research,2006,66(24):11878.
[25]Tahara K,Kato Y,Yamamoto H,et al.Intracellular drug delivery using polysorbate 80-modified poly(D,L-lactide-co-glycolide)nanospheres to glioblastoma cells[J].Journal of Microencapsulation,2011,28(1):29.
[26]Hu KL,Li JW,Shen YH,et al.Lactoferrin-conjugated PEG-PLA nanoparticles with improved brain delivery:in vitro and in vivo evaluations[J].Journal of Controlled Release,2009,134(1):55.
[27]Guo JW,Gao XL,Su LN,et al.Aptamer-functionalized PEG-PLGA nanoparticles for enhanced anti-glioma drug delivery[J].Biomaterials,2011,32(31):8010.
[28]高翔.生物素-亲和素放大酶联免疫快速检测动物组织中莱克多巴胺残留[D].杨凌:西北农林科技大学,2009:4-7.
[29]Townsenda SA,Evronyb GD,Gu FX,et al.Tetanus toxin C fragment-conjugated nanoparticles for targeted drug delivery to neurons[J].Biomaterials,2007,28(34):5176.
[30]陆伟.阳离子白蛋白结合聚乙二醇-聚乳酸纳米粒的脑内递药研究[D].上海:复旦大学,2005:45-67.
[31]胡凯莉.乳铁蛋白修饰生物可降解纳米粒的脑内递药研究[D].上海:复旦大学,2009:123-140.

