紫外分光光度法在没食子酸体外还原Fe3+能力检测中的应用及其意义
伍翔群,于 兰,于 杰,黄彩婷,许维国,牛凤兰
(1.吉林大学公共卫生学院卫生检验学教研室,吉林 长春 130021;2.长春中医药大学附属医院脑病科,吉林 长春 130021;3.吉林大学中日联谊医院电诊科,吉林 长春 130033)
没食子酸(gallic acid,GA)是一种广泛存在于水果和中草药等植物中的天然酚酸类化合物,是没食子、余甘子、藏青果、红景天和诃子等中药材的药理活性组分,也是一些纯中药制剂的有效成分。研究[1-4]表明:GA具有较强的抗氧化性,具有抗菌、抗病毒和抗肿瘤作用。研究[5-7]证明:GA通过抗氧化作用抑制小鼠红细胞溶血活性,抑制小鼠脑、肾匀浆脂质过氧化作用,对大鼠的缺血-再灌注损伤起保护作用,对与1型糖尿病相关的心肌损伤的治疗有效等。大多数人工合成抗氧化剂均具有一定的毒副作用,与此相比,GA作为天然的抗氧化剂安全无毒并具有良好的生理功效。因此,检验GA的抗氧化性可为其应用提供实验依据。抗坏血酸,即维生素C(vitamin C,Vc),为水溶性维生素,具有极强的还原性,在食品加工业中被广泛使用,故本研究采用Vc作为抗氧化对照药。H2O2/Fe2+体系可通过Fenton反应使邻二氮菲-Fe2+被羟自由基氧化为邻二氮菲-Fe3+[8],因此,应用紫外分光光度计检测Vc或GA还原Fe3+的产物的吸光度(A)值,可间接检测其抗氧化能力。在铁氰化钾-Fe3+体系中以Fe3+做氧化剂,定量氧化Vc或GA并生成Fe2+,后者可在一定条件下与显色剂生成蓝色配合物 KFe3+[Fe2+(CN)6]。通过分光光度法测定该配合物的A值,建立间接测定受试物抗氧化能力的方法[9]。本研究采用上述2种体系测定GA的体外抗氧化能力,结果报道如下。
1 材料与方法
1.1 主要试剂与仪器 邻二氮菲(天津市北方天医化学试剂厂),配置成浓度为5mmol·L-1邻二氮菲乙醇溶液;30%过氧化氢(北京化工厂),配置成1%过氧化氢溶液;铁氰化钾(天津市化学试剂一厂),配置成10g·L-1铁氰化钾溶液;自制0.01和0.10mol·L-1PBS缓冲溶液;盐酸(北京化工厂)12mol·L-1,用去离子水稀释10000倍后为1.2×10-3mol· L-1和稀释100倍后 为0.12mol·L-1;GA(北京化工厂)、Vc(吉林显峰科技制药有限公司),各配置成浓度为1.6g·L-1溶液;硫酸亚铁(北京化工厂),配置成浓度为7.5mmol·L-1硫酸亚铁溶液;氯化铁(北京化工厂),配置成1g·L-1氯化铁溶液。所有试剂均为分析纯,水为二次去离子水。PE Lambda 900紫外可见分光光度计(美国PE公司),水浴箱和电子天平(上海实验仪器厂),超声波振荡器(昆山市超声仪器有限公司)。
1.2 紫外分光光度法验证GA和Vc体外抗氧化性的可行性 为了确定最佳测试条件,排除干扰因素,用紫外分光光度计对GA和Vc溶液进行全波长扫描。
1.3 GA和Vc在邻二氮菲-Fe2+体系中还原Fe3+能力的检测 在1~9号容量瓶中均依次精密加入邻二氮菲溶液1.5mL,0.01mol·L-1PBS缓冲溶液4mL,硫酸亚铁溶液1mL,立即混匀备用。其中1~4号容量瓶为GA组,5~8号为Vc组,9号为control 1组。在GA组中按顺序依次准确加入GA溶液0.25、0.50、0.75和1.00mL,使1~4号瓶 GA浓度分别为0.04、0.08、0.12 和0.16g·L-1。在Vc组中按顺序依次准确加入Vc溶液0.25、0.50、0.75和1.00mL,使5~8号的Vc浓度分别为0.04、0.08、0.12和0.16g·L-1。随后向1~9号容量瓶中加入过氧化氢溶液各1mL。所有容量瓶用去离子水定容至刻度,混匀,37℃水浴1h。利用紫外分光光度计,于波长为536nm处,用1cm比色皿,以试剂空白为对照,检测其A值。重复3次取平均值。
1.4 乙醇对GA和Vc在邻二氮菲-Fe2+体系中还原Fe3+能力影响的检测 取2只洁净容量瓶标记为A和B,向其中各加入邻二氮菲溶液1.5mL,0.01mol·L-1PBS缓冲溶液4mL,硫酸亚铁溶液1mL,混匀备用。A容量瓶用乙醇定容至刻度,B容量瓶用去离子水定容至刻度,混匀,37℃水浴1h。利用紫外分光光度计,于波长为536nm处,用1cm比色皿检测其A值。重复3次取平均值。
1.5 GA和Vc在铁氰化钾-Fe3+体系中还原Fe3+能力的检测 在11~19号10mL容量瓶中均依次精密加入氯化铁溶液0.5mL,铁氰化钾溶液2mL,0.01mol· L-1PBS 溶 液 2mL,1.2×10-3mol·L-1盐酸溶液0.5mL,混匀备用。其中11~14号容量瓶为GA组,15~18号为Vc组,19号为control 2组。
在GA组中按顺序依次准确加入GA溶液0.25、0.50、0.75和1.00mL,使 GA 浓度分别为0.04、0.08、0.12和0.16g·L-1。在 Vc组中按顺序依次准确加入 Vc溶液0.25、0.50、0.75和1.00mL,使Vc浓度分别为0.04、0.08、0.12和0.16g·L-1。所有容量瓶用去离子水定容至刻度,混匀,室温反应30min。利用紫外分光光度计,于波长为700nm处,用1cm比色皿,以试剂空白为对照,检测其A值。重复3次取平均值。
1.6 GA和Vc在不同H+浓度的铁氰化钾-Fe3+体系中还原Fe3+能力的检测 在41~48号、C号、D号10mL容量瓶中均依次加入0.1mol·L-1PBS溶液2mL,氯化铁溶液0.5mL,铁氰化钾溶液2mL。在41~44号容量瓶中加入0.12mol·L-1盐酸0.7mL,在45~48号容量瓶中加入0.12mol·L-1盐酸0.8mL,混匀备用。41~44号容量瓶为GA组,45~48号为Vc组,49号为control 3组,50号为control 4组。
在GA组中按顺序依次准确加入GA溶液0.25、0.50、0.75和1.00mL,使其终浓度分别为0.04、0.08、0.12和0.16g·L-1。在 Vc组中按顺序依次准确加入 Vc溶液0.25、0.50、0.75和 1.00mL,使其终浓度分别为 0.04、0.08、0.12和 0.16g·L-1。在C号容量瓶中加入0.12mol·L-1盐酸0.75mL,GA 0.50mL。在D号容量瓶中加入0.12mol·L-1盐酸0.75mL,Vc 0.50mL。在49和50号10mL容量瓶中依次加入0.1mol·L-1PBS溶液2mL,氯化铁溶液0.5mL,铁氰化钾溶液2mL。在49号容量瓶中加入0.12mol·L-1盐酸0.7mL,在50号容量瓶中加入0.12mol·L-1盐酸0.8mL。所有容量瓶用去离子水定容至刻度,混匀,室温反应30min。利用紫外分光光度计,于波长为700nm处,用1cm比色皿,以试剂空白为对照,检测其A值。重复3次取平均值。
1.7 盐酸对GA和Vc在铁氰化钾-Fe3+体系中还原Fe3+能力影响的检测 在21~40号10mL容量瓶中均依次加入0.1mol·L-1PBS溶液2mL,氯化铁溶液0.5mL,铁氰化钾溶液2mL。21~30号容量瓶为GA组,31~40号为Vc组。在GA组中按顺序依次准确加入0.12mol·L-1盐酸0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80、0.90 和 1.00mL,使其终浓度分别为0.12×10-2、0.24×10-2、0.36×10-2、0.48×10-2、0.60×10-2、0.72×10-2、0.84×10-2、0.96×10-2、1.08×10-2和1.20×10-2mol·L-1;Vc组同GA组操作。在GA组容量瓶中均加入GA溶液0.5mL,Vc组容量瓶中均加入Vc溶液0.5mL。所有容量瓶用去离子水定容至刻度,混匀,室温反应30min。利用紫外分光光度计,于波长为700nm处,用1cm比色皿,检测其A值。重复3次取平均值。
1.8 统计学分析 应用SPSS 17.0软件包进行统计分析,GA与VC组检测指标以表示,组间比较采用two-way ANOVA方差分析。
2 结 果
2.1 紫外分光光度法验证GA和Vc体外抗氧化性的可行性 对GA和Vc溶液进行全波长扫描测得最大吸收峰分别为267.05和260.95nm,而在实验测试条件536及700nm处均无明显吸收,不会对测定结果造成干扰。因此,用比色法测定GA和Vc体外抗氧化能力可行。
2.2 GA和Vc在邻二氮菲-Fe2+体系中还原Fe3+的能力 采用SPSS分析得:GA和Vc溶液间A值的比较,均方 MS=0.005,F=56.315,P<0.05,GA组和Vc组A值差异有统计学意义。GA组和Vc组不同浓度溶液A值的比较,均方MS=0.030,F=358.194,P<0.05,GA 组和Vc组不同浓度溶液A值差异有统计学意义(P<0.05)。见表1。在此体系中所有药物浓度下,GA组的A值均大于Vc组。表明在此体系中GA的体外还原Fe3+能力强于Vc。
2.3 乙醇作用下GA和Vc在邻二氮菲-Fe2+体系中还原Fe3+的能力 用纯乙醇定容的反应液所测A值为1.5491,用去离子水定容的反应液所测A值为1.7278。结果表明:乙醇对试剂的A值有影响。
2.4 GA和Vc在铁氰化钾-Fe3+体系中还原Fe3+的能力 采用SPSS分析得:GA和Vc溶液间A值的比较,均方 MS=1.130,F=15.568,P<0.05,GA组和Vc组A值差异有统计学意义。GA组和Vc组不同浓度溶液A值的比较,均方MS=0.897,F=12.355,P<0.05,GA 组和Vc组不同浓度溶液A值差异有统计学意义。见表2。
在0.04g·L-1浓度时,GA的A值大于Vc的A值,即GA的体外还原Fe3+的能力强于Vc。其余浓度下GA的A值均小于Vc,即在此体系此浓度下GA的体外还原Fe3+的能力弱于Vc。
2.5 GA和Vc在不同H+浓度的铁氰化钾-Fe3+体系中还原Fe3+的能力 采用SPSS分析得:GA和Vc溶液间A值的比较,均方MS=0.543,F=6.871,P<0.05,GA组和Vc组A值差异有统计学意义。GA组和Vc组不同浓度溶液A值比较,均方 MS=0.539,F=6.815,P<0.05,GA组及和Vc组不同浓度溶液A值差异有统计学意义。见表3。在此体系中不同药物浓度下,GA组的A值均大于Vc组。表明在此体系中GA的体外还原Fe3+能力强于Vc。
表1 GA和Vc在Fenton羟自由基体系中的A值Tab.1 The A values of GA and Vc in the Fenton hydroxyl radicals system (n=3,)
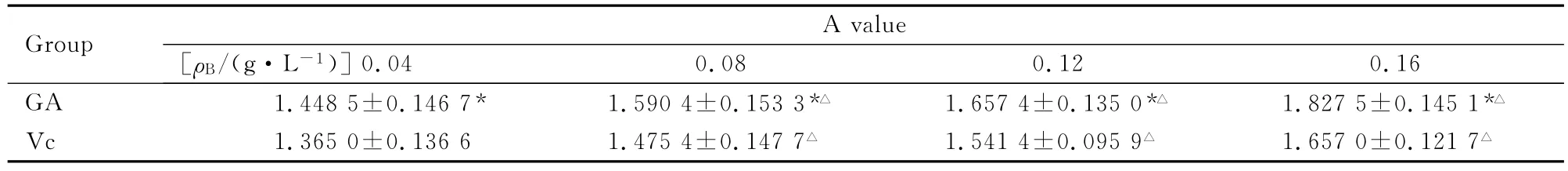
表1 GA和Vc在Fenton羟自由基体系中的A值Tab.1 The A values of GA and Vc in the Fenton hydroxyl radicals system (n=3,)
The A value of control 1was 1.2355±0.0411.* P<0.05compared with Vc group;△P<0.05compared with 0.04g·L-1 group.
Group 0.04 0.08 0.12 0.16 GA 1.4485±0.1467* 1.5904±0.1533*△ 1.6574±0.1350*△ 1.8275±0.1451*A value[ρB/(g·L-1)]△Vc 1.3650±0.1366 1.4754±0.1477△ 1.5414±0.0959△ 1.6570±0.1217△
表2 GA和Vc在铁氰化钾-Fe3+体系中的A值Tab.2 The A values of GA and Vc in the potassium ferricyanide-Fe3+system (n=3,)

表2 GA和Vc在铁氰化钾-Fe3+体系中的A值Tab.2 The A values of GA and Vc in the potassium ferricyanide-Fe3+system (n=3,)
The A value of control 2was 0.0669±0.0000.* P<0.05compared with Vc group;△P<0.05compared with 0.04g·L-1 group.
Group 0.04 0.08 0.12 0.16 GA 0.3055±0.0017*△ 0.4966±0.0044*△ 0.6734±0.0008*△ 0.8864±0.0008*A value[ρB/(g·L-1)]△Vc 0.0861±0.0008△ 1.1845±0.0056△ 1.5919±0.0010△ 1.6257±0.0006△
表3 GA和Vc在不同H+浓度的铁氰化钾-Fe3+体系中的A值Tab.3 The A values of GA and Vc in the potassium ferricyanide-Fe3+system with different concentrations of H+(n=3,)

表3 GA和Vc在不同H+浓度的铁氰化钾-Fe3+体系中的A值Tab.3 The A values of GA and Vc in the potassium ferricyanide-Fe3+system with different concentrations of H+(n=3,)
The A value of control 3was 0.0618±0.0001;the A value of control 4was 0.0606±0.0000;the A value of C was 1.5917±0.0026;the A value of D was 0.1334±0.0009.* P<0.05compared with Vc group;△P<0.05compared with 0.04g·L-1 group.
Group 0.04 0.08 0.12 0.16 GA 0.1381±0.0038* 0.2239±0.0041 0.8755±0.0023*△ 1.7094±0.0014*A value[ρB/(g·L-1)]△Vc 0.1009±0.0047 0.2802±0.0058 0.4521±0.0014△ 0.5473±0.0017△
2.6 不同浓度盐酸作用下GA和Vc在铁氰化钾-Fe3+体系中还原Fe3+的能力 采用SPSS分析得:GA和Vc溶液间A值的比较,均方MS=0.112,F=1.920,P>0.05,GA组和Vc组A值差异无统计学意义。GA组和Vc组不同盐酸浓度溶液A值的比较,均方 MS=1.022,F=17.524,P<0.05,GA组和Vc组不同盐酸浓度溶液A值差异有统计学意义。见表4。在相同浓度的盐酸溶液中GA和Vc的A值差别大。Vc组盐酸浓度为0.84×10-2和0.96×10-2mol·L-1的溶液 A值呈跳跃性改变,跃至A值最大值。
3 讨 论
氧化应激是指机体活性氧物质产生过多,机体抗氧化能力降低,氧化系统和抗氧化系统平衡紊乱导致组织或细胞损伤的病理过程。在病理条件下或衰老时,细胞内活性氧的增加超过抗氧化防御能力,就会引起脂质、蛋白质和DNA的氧化损伤,可能导致动脉粥样硬化、心力衰竭、高血压等心血管疾病的发生[10]。研究[11]显示:临床上现有的具有抗氧化作用的药物治疗效果具有一定局限性,从中药或者天然植物药中筛选抗氧化活性成分,以此为基础开发新药是解决此问题的有效途径之一。在体外模拟氧化体系下GA的抗氧化作用研究成为关注的焦点。在邻二氮菲-Fe2+体系中,加入硫酸亚铁溶液后必须立即混匀,否则会使局部颜色过浓影响实验结果的重复性。较多的乙醇对实验结果有影响,故在邻二氮菲-Fe2+体系中测定物质抗氧化性时应考虑乙醇的还原性,对乙醇的影响进行校正或更换溶剂。在铁氰化钾-Fe3+体系中,低浓度GA在H+浓度较小的环境下体外还原Fe3+能力较强,高浓度GA在H+浓度较大的环境下体外还原Fe3+能力较强。Vc则在H+浓度较小的环境下体外还原Fe3+能力较强。因此,在GA的应用中应考虑剂量与体系H+浓度对其抗氧化性的影响。
表4 不同浓度盐酸作用下GA和Vc在铁氰化钾-Fe3+体系中的A值Tab.4 The A values of GA and Vc in the potassium ferricyanide-Fe3+ system after treated with different concentrations of HCl (n=3,)

表4 不同浓度盐酸作用下GA和Vc在铁氰化钾-Fe3+体系中的A值Tab.4 The A values of GA and Vc in the potassium ferricyanide-Fe3+ system after treated with different concentrations of HCl (n=3,)
* P<0.05compared with 0.12×10-2 mol·L-1 group.
Group 0.24 0.36 0.48 0.60 GA 0.2085±0.0043 0.2676±0.0011 0.2236±0.00 A value(×10-2 mol·L-1)0.1258 0.2127±0.0037 0.2067±0.0033 Vc 0.0609±0.0021 0.0625±0.0031 0.0624±0.0022 0.0716±0.0060 0.0772±0.0018 Group 0.84 0.96 1.08 1.20 GA 0.1986±0.0009 1.2607±0.0056* 1.5134±0.0019* 1.6326±0.0003* 1.6165±0.0008 A value(×10-2 mol·L-1)0.72*Vc 0.0842±0.0035 0.2310±0.0025* 1.7380±0.0034* 1.7040±0.0006* 1.7525±0.0012*
本实验结果显示:Vc组盐酸浓度为0.84×10-2和0.96×10-2mol·L-1的溶液 A值呈跳跃性改变,跃至 A值最大值。盐酸浓度为0.84×10-2mol·L-1时为GA反应的适宜酸度,此条件下Vc组溶液的A值过小,不利于低剂量Vc反应液的A值检测。C号溶液即GA的A值为1.5917,接近实验可得最大A值,而D号溶液即Vc的A值为0.1334,接近实验可得最小吸光度。可见,GA和Vc的最佳反应体系的条件并不一致,可能是两者本身化学结构差异所致。研究[12]表明:没食子酸在碱性、中性、强氧化条件下不稳定,在酸性环境、强光、高温条件下稳定,而不同的抗氧剂对其均有保护作用。且盐酸浓度对实验结果影响很大,试剂加入顺序也对实验结果有一定的影响。研究[13]表明:Fe3+在不同pH值条件下的化学形态不同,催化活性差异较大,影响化学发光特性。因此在实验过程中应控制盐酸浓度。
本实验结果表明:GA在体外一定条件下的抗氧化能力强于Vc,而Vc是公认的抗氧化剂,说明GA在抗氧化方面具有良好的应用前景。
[1]郑民实,孔庚星,张 鑫,等.没食子酸抗 HBsAg/HBeAg的实验研究[J].实用中医药杂志,1998,14(1):5-7.
[2]何文飞,何大维,马 超,等.没食子酸抑制人神经母细胞瘤增殖作用的实验研究[J].第三军医大学学报,2011,33(2):107-110.
[3]吕 喆,龚守良,牛凤兰,等.3,4,5-三羟基苯甲酸对肿瘤细胞凋亡及细胞周期进程的影响[J].吉林大学学报:医学版,2008,34(1):90-92.
[4]吕 喆,牛凤兰,郗艳丽,等.三羟基苯甲酸纯化物及其化合物对Jurkat细胞周期进程及凋亡的影响[J].吉林大学学报:医学版,2010,36(5):904-907.
[5]牛淑敏,李 巍,李 乐.玫瑰花中两种抗氧化成分的分离鉴定与活性测定[J].南开大学学报,2006,39(1):90-94.
[6]于艳华,卜丽梅,赵丽红,等.没食子酸对缺血再灌注损伤大鼠的保护作用[J].中国老年学杂志,2010,30(20):2935-2937.
[7]Patel SS,Goyal1RK.Cardioprotective effects of gallic acid in diabetes-induced myocardial dysfunction in rats [J].Pharmacognosy Res,2011,3(4):239-245.
[8]刘凤喜,李志东,李 娜,等.Fenton法中的羟基自由基的测定技术简介[J].环境研究与监测,2007,20(4):1-5.
[9]郝 亮,党亚婷,惠晓娇,等.铁氰化钾-Fe(Ⅲ)分光光度法测定抗坏血酸的含量[J].光谱实验室,2011,28(4):1713-1715.
[10]吴 蕊,徐 玲.氧化应激与心血管疾病[J].心血管病学进展,2007,28(1):110-113.
[11]熊江波,孙柳燕,王如伟.临床治疗心脑血管疾病的中药与天然植物药[J].中国药业,2009,18(13):3-6.
[12]吴雪钗,于波涛,侯艾林,等.没食子酸稳定性研究[J].西南国防医药,2006,16(5):484-485.
[13]方卢秋,李海芳,郑国金.流动注射化学发光法测定中药材中没食子酸[J].分析化学,2010,38(8):1110-1114.

