米根霉Fp-6 利用红薯发酵生产L-乳酸
黄筱萍,黄国昌,印培民
(江西省科学院微生物研究所,江西 南昌,330029)
乳酸是世界上三大有机酸之一,在化工、医药、食品加工等领域有着广泛的用途。目前,工业化生产L-乳酸多发玉米、大米和木薯淀粉糖为原料。随着粮食来源食物作物的淀粉糖价格不断攀升,乳酸发酵工业的利润逐渐降低,因此开发低成本发酵工艺,尤其是采用各种廉价非粮生物质原料进行发酵生产是降低乳酸生产成本,促进聚乳酸产业快速发展的重要技术趋势。
目前国内外尚未见有关以红薯为原料进行L-乳酸发酵的报道,主要以细菌发酵菊芋、木质纤维素、木薯原料的研究居多,但是L-乳酸光学纯度不如以米根霉生产菌高[1-3]。我们通过引进高产优质的红薯品种进行栽培,筛选出高淀粉产量的红薯品种,并以之为原料进行了L-乳酸发酵的研究。
1 材料和方法
1.1 材料
1.1.1 菌种
米根霉Fp-6(Rhizopus oryzae Fp-6),由江西省科院生物技术有限责任公司分离保存。
1.1.2 红薯品种
①梅营1 号;②秦薯5 号;③FL-19;④苏薯303;⑤豫薯王;⑥徐薯22;⑦红星431;⑧秦薯4 号。
1.1.3 培养基
(1)斜面培养基(%):马铃薯斜面(PDA)培养基,马铃薯200,蔗糖20,琼脂20,水1 000 mL,pH自然。
(2)种子培养基(%):玉米淀粉5.0,葡萄糖5.0,(NH4)2SO40.135 ,无机盐微量,CaCO31.0,115 ~120 ℃灭菌30 min。
(3)基础发酵培养基(%):淀粉12,(NH4)2SO41.35,无机盐 微量,消泡剂0.01 ~0.03,CaCO3在发酵过程中补加。
1.2 方法
1.2.1 培养方法
(1)斜面菌种培养:用少量无菌水(约5 ~10 mL)洗脱斜面孢子制成悬液,或直接挑取菌丝,接种于PDA 斜面上,于28℃培养10 ~14 d。
(2)一级种子液培养:将斜面孢子洗脱液接入锥形瓶中,使培养基中孢子终浓度为1.0 ×106~2.0 ×106CFU/mL。于30℃,200 r/min 摇床培养12 ~16 h。
(3)二、三级种子液培养:接种量5%,培养温度,35 ℃,空气流量0.1 ~0.25 vvm,转速300 r/min,培养9 ~15 h。
(4)发酵:接种量5%,培养温度35 ℃,通气量:0.05 ~0.2 vvm,采用间断添加25% ~30% 的无菌CaCO3溶液的方法控制pH 在5.5 ±0.5。
1.2.2 红薯的预处理
(1)红薯淀粉制备[4]:称取红薯100 kg,清洗,粉碎,用石磨研磨成浆,用2 ~3 倍体积的清水洗2 次,先后分别用20 目和100 目筛过滤,滤液静置沉淀过夜,弃上清液,沉淀用清水清洗后静置沉淀,弃上清液,沉淀置烘箱中烘干即为红薯淀粉。
(2)去皮红薯液化液的制备:红薯蒸煮,去皮,磨碎,液化,浓缩备用。
(3)红薯液化液的制备:红薯蒸煮,磨碎,液化,浓缩备用。
(4)去有机N 红薯液化液制备:红薯洗净称重,加水粉碎,浆液静置过夜,弃上清液,加水搅匀后静置沉淀,弃上清液,液化,测定含糖量和总N 量,浓缩备用。
1.2.3 分析方法
(1)L-乳酸、富马酸、甘油等含量分析:LC-10Avp型液相色谱仪(日本岛津),检测器RID-10A 示差检测器,色谱柱OAapak-A,柱温40 ℃,流动相0.75 mmol/L H2SO4,分析流速1 mL/min,进样量20 μL。
(2)L-乳酸光学纯度分析:LC-10Avp 型液相色谱仪,检测器SPD-10Avp 紫外检测器,色谱柱SUMICHIRAL OA-5000(φ 4.6 mm×150 mm),柱温40 ℃,波长254 nm,流动相1 mmol/L CuSO4溶液,分析流速1 mL/min,进样量10 μL。
(3)残糖测定:发酵液于10 000 r/min 离心5 min,取上清液,采用DNS 显色法测定糖浓度。
(4)淀粉含量测定[5]:参照GB/T5009.9 -2003。红薯洗净去皮后,切成细丝,称取100 g 左右,并加入等量的水,用豆浆机打成匀浆,立刻称取匀浆10 g,参照GB/T5009.9—2003 中酸水解法进行检测。
(5)水分测定[6]:参照GB/T 5009.3—2003。
(6)N 含量测定[7]:凯氏定氮法,参照GB/T 5009.5—1985。
2 结果与讨论
2.1 高淀粉红薯品种的筛选和组分分析
共种植了8 个品种的红薯,产量和组分见表1。
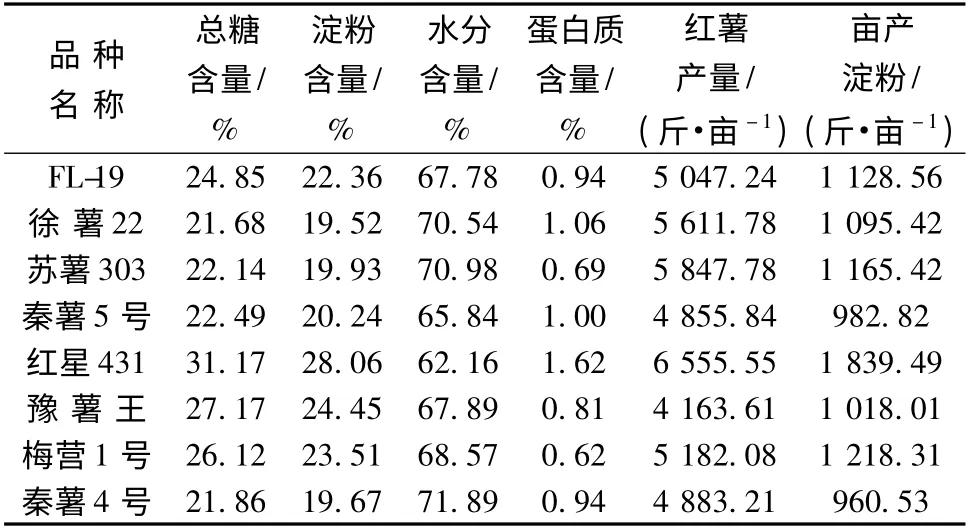
表1 不同品种红薯亩产量和淀粉产量Table 1 Acre yield and starch acre yield of sweet potato varieties
红星431 淀粉量最高,其次是豫薯王、梅营1 号、FL-19、秦薯5 号,其他低于20%,红星431 淀粉含量和亩产淀粉量最高,但其含N 量也最高,虽然豫薯王淀粉含量比梅营1 号稍高,但其亩产量低,亩产淀粉亦低于梅营1 号,因此选用红星431 和梅营1 号作为发酵试验优质品种。
2.2 红薯淀粉的制备
分别取红星431 和梅营1 号鲜薯各100 kg,制备发酵用粗红薯淀粉原料,分别测定淀粉提取收率。
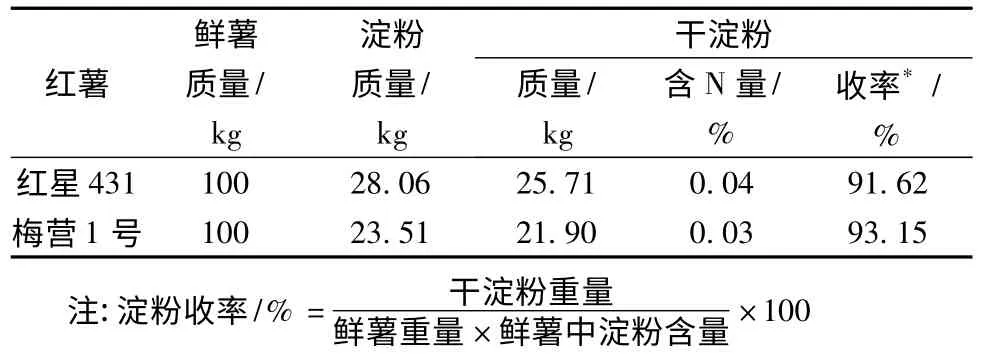
表2 鲜薯制备淀粉过程中各参数Table 2 Parameters in the process of starch preparation with fresh sweet potato
影响淀粉收率的原因可能有以下2 种:(1)红薯的粉碎程度,颗粒粉碎的大小可能影响红薯中的淀粉完全释放出来;(2)在滤渣的洗涤过程中,由于洗涤条件限制,淀粉可能不能完全洗至水中,部分淀粉被带到废渣中而影响最后的淀粉收率。改进粉碎红薯和洗涤设备可提高淀粉收率。
2.3 摇瓶发酵产酸试验
2.3.1 不同预处理红薯对L-乳酸产量的影响
以3 种不同预处理的红薯为原料,折成淀粉量为120 g/L,分别液化后,配制发酵培养基,采用一级种发酵,接种量10%,200 r/min,35 ℃培养48 h,发酵结束后发酵液定容至100 mL,分别测定光学纯度、乳酸含量、残糖量和菌体干重。
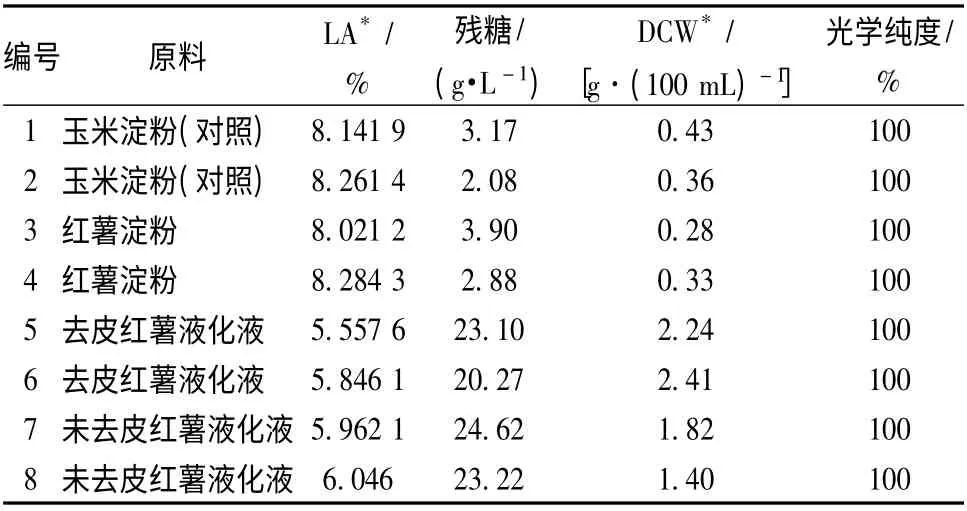
表3 不同预处理红薯原料对L-乳酸产量的影响Table 3 The effect of sweet potato starch with different pre-preparation on L-Lactic acid yield
与对照玉米淀粉为原料的产酸水平相比,摇瓶发酵48 h,利用红薯淀粉为原料发酵产酸水平、菌体干重和残糖浓度均与玉米淀粉相同。而使用红薯液化液发酵过程中,菌丝体量大大增加,为淀粉原料的4~6 倍,且菌丝体缠绕成大块的团状,产酸水平大大下降,这可能是由于红薯中含有较丰富的有机N 源,米根霉在富有机N 培养基中过度繁殖生长,在摇瓶培养过程中菌丝体缠绕成大块的团状,影响O2的传质,不利乳酸的生成。去皮红薯液化液为原料的培养液中其菌体浓度最高,表明红薯皮中可能含有可抑制菌体生长的因子。虽然利用红薯淀粉发酵生产L-乳酸产量与玉米淀粉相似,产量最高,但从发酵成本考虑,制备红薯淀粉生产流程长,且会造成一部分淀粉流失,同时有大量有机废水排放,增加发酵原料成本和废水处理运行成本,因此以下试验均采用红薯液化糖作为发酵原料。
2.3.2 红薯中的有机氮浓度对米根霉菌丝体的生长和产L-乳酸产量的影响
在玉米淀粉为原料的发酵基础培养基中添加不同浓度的有机N 源,有机N 来源为制备红薯淀粉(红星431)时的上清废液,试验Ⅰ组的有机N 的添加量分别为1.0,0.75,0.5,0.25 和0.125 g/L,不加无机N,试验Ⅱ组除添加有机N 源外,再按常量添加无机N,分别考察有机氮浓度对菌体生长和产酸的影响,以及在不同有机N 浓度的条件下无机N 对米根霉发酵产酸的影响,结果见表4。
2 组试验结果均表明,随着红薯中有机N 浓度的增加,菌体量明显增加,为正常发酵菌量的2 ~6 倍。在未添加无机N 的条件下,发酵液中有机N 浓度低于0.5 g/L 时对产酸影响不大,但菌体量随着有机N浓度的增加而明显增加。当发酵液中有机N 浓度高于0.5 g/L 时,菌体生长过盛,严重影响产酸,产酸量明显下降。在试验Ⅱ组的结果与试验Ⅰ组相似,但在相同的有机N 浓度条件下,添加无机N 能明显促进乳酸的生成,尤其是在有机N 浓度低于0.5 g/L 时,加入无机N 源对产酸影响更加显著。因此在以红薯液化糖为原料发酵生产L-乳酸时,控制发酵液中有机N 浓度在0.5 g/L 内比较适宜。同时添加无机N 源有利于发酵产酸。
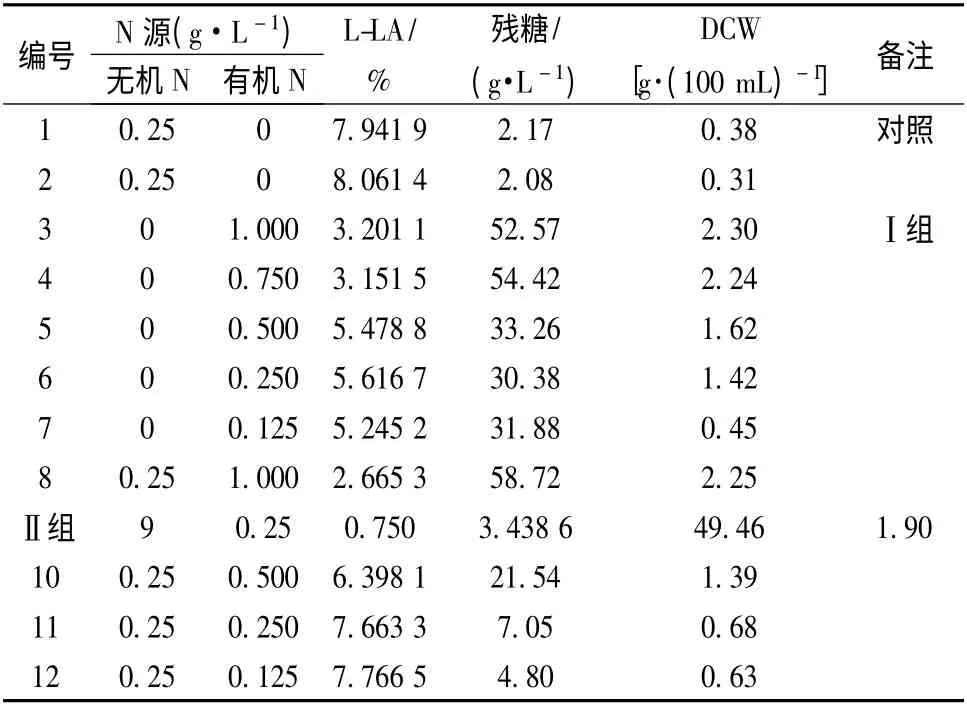
表4 有机N 和无机N 对米根霉发酵产酸的影响Table 4 The effects of organic N and inorganic N on L-Lactic acid fermenting by Rhizopus oryzea
2.3.3 C/N 比对L-乳酸发酵的影响
梅营1 号红薯液化糖浓度为120 g/L 时,液化糖液中有机N 含量为0.51 g/L。玉米淀粉中有机N含量为0.13 g/L,(NH4)2SO4的添加分为2 组,一组按正常的添加量全部添加,另一组根据原料配比中的有机N 量,添加一定量的无机N 量,保持C/N=90。摇瓶发酵48 h,结果见表5。
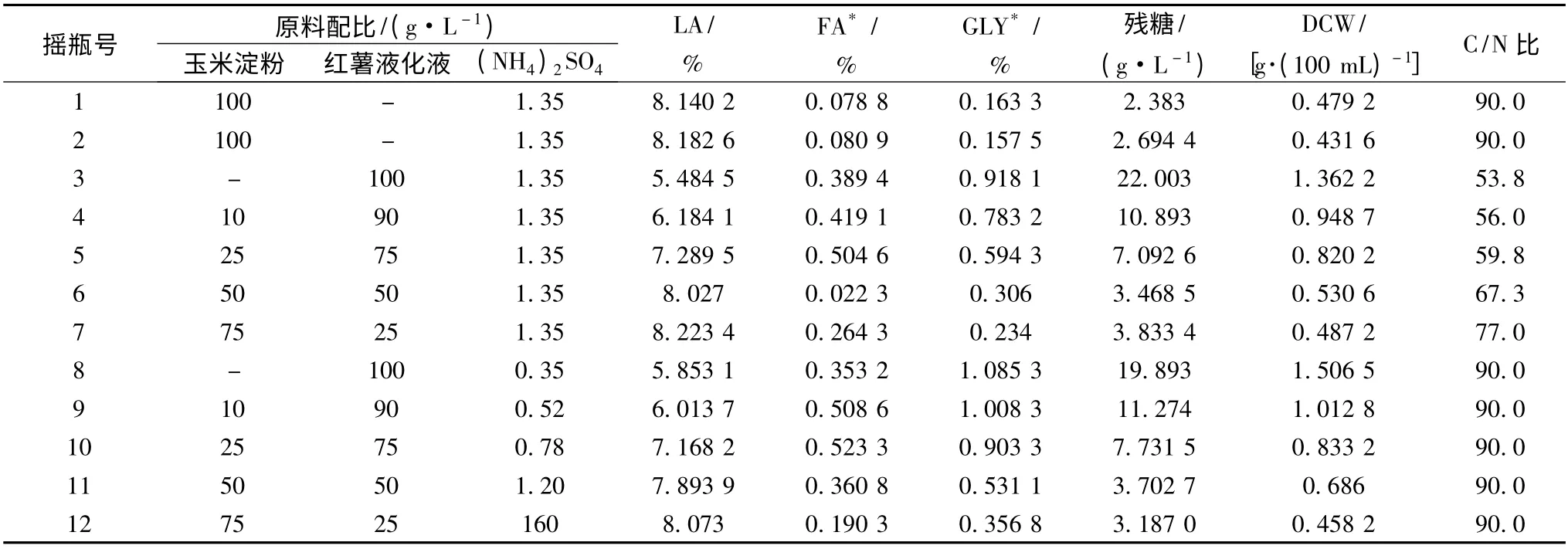
表5 C/N 比对L-乳酸发酵的影响Table 5 The effect of C/N on L-Lactic acid fermenting
1 ~2 号为对照组,3 ~7 号为添加常量的无机盐的试验Ⅰ组,8 ~12 号为固定C/N 比为90 的试验Ⅱ组。试验Ⅰ组中随着C 源配料中红薯液化液添加量的增加,C/N 比从77 逐渐下降至54,菌体量和副产物甘油明显增加,L-乳酸的产量逐渐减少,这进一步验证红薯液化糖中含有的有机氮会促使菌体生长过盛,导致菌丝结团,影响产酸速度和糖转化率;当控制C/N 比为90 时,与对照组和试验Ⅰ组相比,L-乳酸产量略偏低,且发酵液中副产物甘油和富马酸含量明显偏高,这表明无机N 对米根霉发酵生产L-乳酸具有促进作用。结果表明,适宜的C/N 比为在添加1.35 g/L 的(NH4)2SO4条件下,C/N 比≥65%有利于L-乳酸的发酵产酸。
2.3.4 50 L 罐发酵放大试验
2.3.4.1 未去除有机N 的红薯液化糖对发酵的影响
分别制备红星431 和梅营1 号红薯液化糖,当总糖浓度为120 g/L 时,红星431 液化液和梅营1 号液化液中有机N 浓度分别为1.11 和0.51 g/L。根据摇瓶试验结果,在50L 发酵罐中分别用玉米淀粉+红星431 红薯液化糖和梅营1 号红薯液化糖为原料,试验罐1 为玉米淀粉对照罐,罐2 为60 g/L 玉米淀粉+60 g/L 红星431 红薯液化糖,罐3 梅营1 号120 g/L红薯液化糖,(NH4)2SO4添加量均为1.35 g/L,三罐为平行试验,采用三级种发酵,比较发酵周期和糖转化率。发酵结果见表6,发酵液中乳酸和残糖变化见图1。
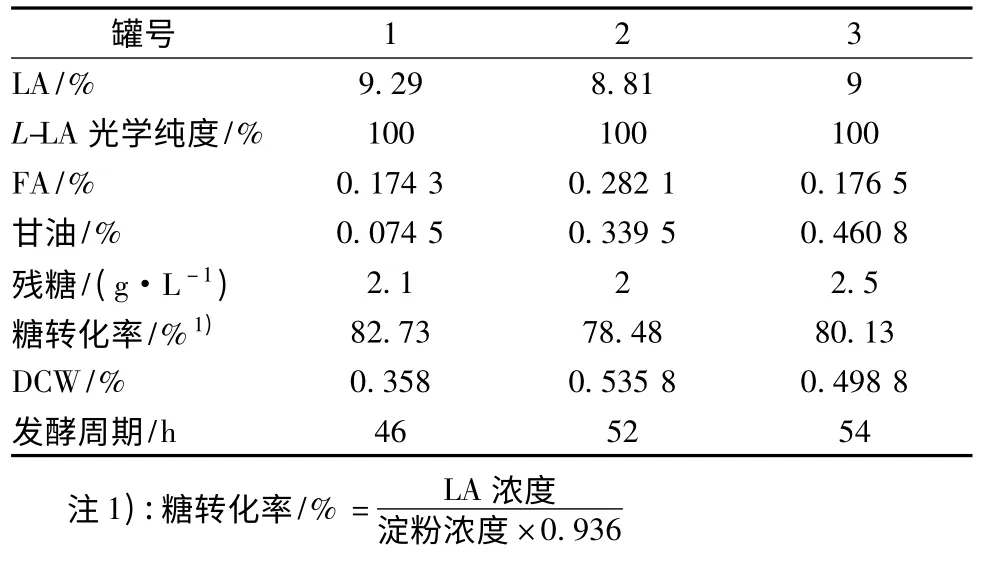
表6 50 L 罐发酵结果Table 6 The results of fermentation in 50 L fermentor
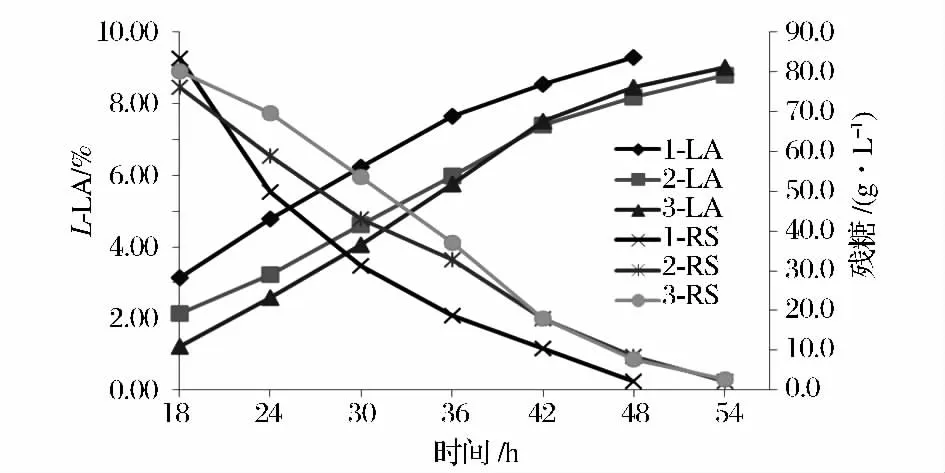
图1 发酵过程中L-乳酸和残糖变化Fig.1 Transformations of L-lactic acid and residual sugar in the process of fermentation
由于红薯浆液化糖中有机氮含量较高,在发酵前期,尤其是在发酵10 ~18 h,在搅拌和通气条件下,发酵液大量起泡,必须流加消泡剂进行消泡,同时要降低搅拌速度和空气流量,搅拌速度从200 r/min 降至120 r/min ,通气量亦根据发泡的情况适时调节,溶氧比对照罐1 低20% ~40%,由于溶氧下降,副产物富马酸和甘油浓度明显高于1 号罐。发酵趋势亦表明在发酵前期,以玉米淀粉为原料的罐1 产酸明显较红薯液化糖高,试验罐2 和罐3 发酵周期延长了6 ~8 h,终糖转化率亦比以玉米淀粉低。可能是由于前期为控制发酵液起泡,改变发酵控制条件而造成产酸延迟和发酵周期延长。菌体量比对照玉米淀粉为原料的罐1 高50%左右,这也是造成糖转化率偏低的主要原因。
2.3.4.2 去除部分有机N 的红薯液化糖对发酵的影响
由于红薯液化糖中含有机N 高,在发酵罐发酵过程中会产生大量的泡沫,同时菌体量明显增加,从而造成发酵过程控制难度,增大染菌机率,使产酸量下降,发酵周期延长,因此对红薯糖化糖的制作进行了改进,即红薯洗净称重后,加水粉碎,浆液静置过夜,弃上清液,再加水,搅匀后静置沉淀,弃上清,这样可去除红薯中绝大部分有机N,沉淀加淀粉酶液化,测定含糖量和总N 量。
试验罐1 为玉米淀粉对照罐,罐2 为120 g/L 改进制作的红星431 红薯液化糖,其有机N 浓度为0.068 g/L,罐3 为120 g/L 改进制作的梅营1 号红薯液化糖,其有机N 浓度为0.03 g/L,(NH4)2SO4添加量均为1.35 g/L,三罐为平行试验,采用三级种发酵,比较发酵周期和糖转化率。发酵结果见表7,发酵液中乳酸和残糖变化见图2。
经过去除有机N 的红薯液化糖,在发酵过程中未发生大量起泡的现象,其发酵周期和糖转化率均与以玉米淀粉为原料基本相同,乳酸产生和糖消耗速率无明显差异,发酵副产物富马酸和甘油浓度亦无明显增加,发酵周期48 h,糖转化率均≥80.0%,光学纯度均为100%。可以取代玉米淀粉作为发酵原料。
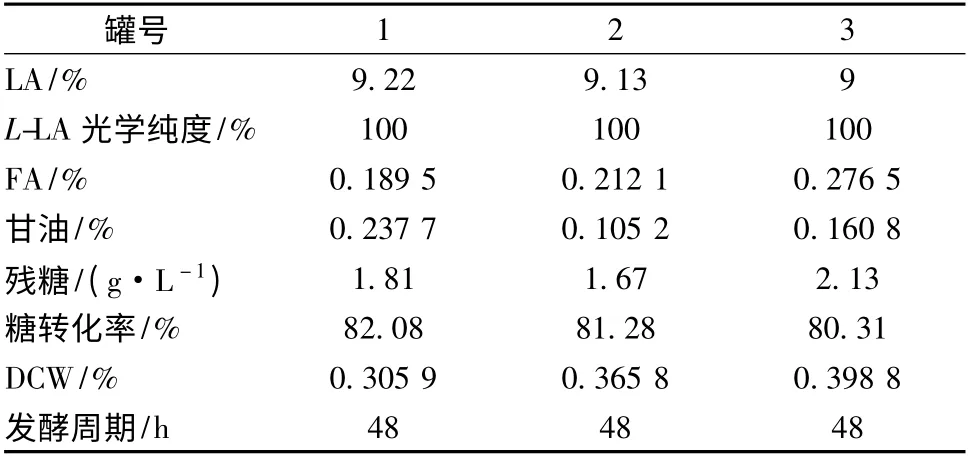
表7 50 L 罐发酵结果Table 7 The results of fermentation in 50 L fermentor
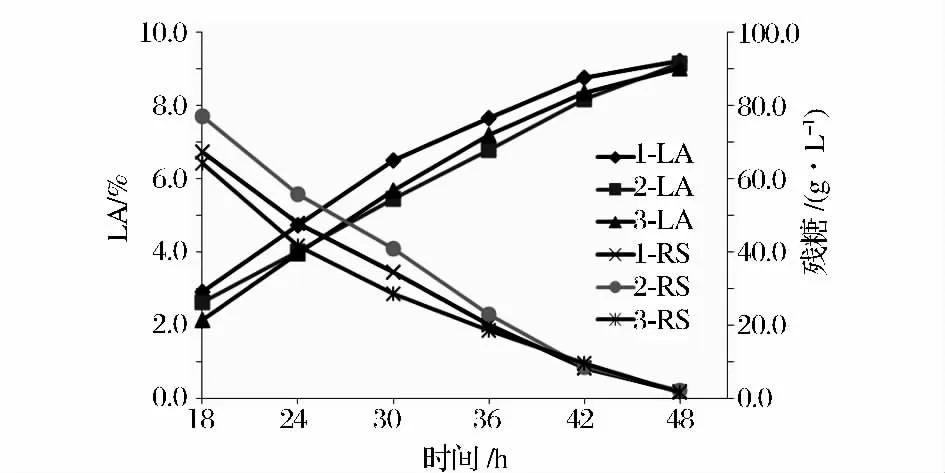
图2 发酵过程中L-乳酸和残糖变化Fig.2 Transformations of L-lactic acid and residual sugar in the process of fermentation
3 结论
采用2 个高淀粉红薯品种为原料,米根霉发酵生产L-乳酸,红薯液化糖中的有机N 浓度对发酵影响显著。在摇瓶发酵过程中表现为菌体量明显增加,菌体量随着有机N 浓度的增加而明显增加,菌体量为淀粉原料的菌量的2 ~6 倍,且副产物富马酸和甘油浓度亦呈增加趋势。在50 L 罐发酵过程中,发酵前期会大量发泡,需流加消泡剂和控制搅拌速度和空气流量进行消泡,这样导致发酵前期产酸较低,发酵周期延长,富马酸和甘油浓度亦有所增加,使乳酸产量和糖转化率比淀粉糖略低。采用去除大部分有机N的红薯液化糖进行50L 罐发酵,其糖转化率≥80%,发酵周期为48 h,与淀粉类糖相同,完全可替代玉米淀粉作为原料生产L-乳酸。
[1] 于波,曾艳,姜旭,等. 聚合级L-乳酸的非粮生物质发酵研究进展[J]. 2012,29(4):411 -421.
[2] Xue Z W,Wang L M,Ju J S,et al. Efficient production of polymer-grade L-lactic acid from corn stover hydrolyzate by thermophilic Bacillus sp. strain XZL4[J]. Spring Plus,2012(1):43.
[3] Saito K,Hasa Y,Abe H. Production of lactic acid from xylose and wheat straw by Rhizopus oryzae[J]. J Biosci Bioeng,2012,114(2):166 -169.
[4] 郝剑英,山颖,康海燕. 淀粉生产加工工艺及设备[J].农机化研究,2002(3):220.
[5] GB/T 5009.9—2003,食品中淀粉的测定[S].
[6] GB/T 5009.3—2003,食品中水分的测定[S].
[7] GB/T 5009.5—1985,食品中蛋白质的测定方法[S].
[6] 熊宗贵. 发酵工艺原理[M]. 北京:中国医药科技出版社,1995:268 -281.

