花期海蓬子对盐胁迫的生理响应
刘伟成,郑春芳,* ,陈 琛,彭益全,曾国权,冀德伟,陈少波,谢起浪,於俊琦
(1.浙江省海洋水产养殖研究所,浙江省近岸水域生物资源开发与保护重点实验室,温州 325005;2.浙江永兴水产种业有限公司,温州 325005;3.南京农业大学资源与环境科学学院,江苏省海洋生物学重点实验室,南京 210095)
海蓬子(Salicornia bigelovii Torr.)为1年生真盐生草本植物,茎直立,多分枝、有梗无叶,其种子产量高,含油量较大,达29%以上,并含有87%—88%的不饱和脂肪酸[1-2],可供人类安全食用,榨油后的海蓬子饼粕含有约40%的粗蛋白,可以作为动物蛋白精饲料,是营养丰富的油料作物和牲畜饲料。同时,海蓬子也是世界上最耐盐的种子植物之一,积累的Na+、Cl-可达到干物质30%—40%[3],具有对高盐环境的独特适应机制。其适应盐渍环境的特点有两方面:一是形态学上的适应,即茎肉质化,二是生理上的适应,即具有较强的渗透调节和离子区域化能力。然而,当盐度超过一定范围,海蓬子仍会受到伤害。比如,Ventura等[4]发现,随着盐浓度增加,海蓬子种子发芽率逐渐下降。高盐胁迫也能引起海蓬子幼苗净光合速率、气孔导度、蒸腾速率下降,导致生物量降低[5]。
开花是植物生活史中的一个重要发育过程,是作物籽粒产量形成的关键阶段,也是受外界环境影响的敏感时期。目前,国内外对海蓬子属植物耐盐性的研究大多都是集中在植株的萌发出苗期[6]、幼苗期[7-8]以及全生育期[9]上,甚至,还有人开展了有关延迟海蓬子生育期的研究[10]。然而,花期盐胁迫对海蓬子的生理效应研究国内外仍无报道。一般来说,种子灌浆期与作物开花期的光合作用有紧密的相关性,其光合能力越强作物的结实率越高[11]。因此,开展盐胁迫对花期海蓬子光合作用、离子稳态的影响研究将为后期籽粒产量形成期研究具有重要意义。基于以上分析,本研究以海蓬子为材料,在花前进行盐处理,研究其在盐胁迫下的生长特性和光合特性、离子吸收以及抗氧化系统等变化,探索花期海蓬子对盐胁迫响应的生理特性,为海蓬子属植物在盐土农业上利用和开发提供理论依据。
1 材料和方法
1.1 材料的培养和处理
试验于2011年5月11日至2011年8月6日在浙江省海洋水产养殖研究所永兴基地海涂上和玻璃温室内进行。该地区属中亚热带季风气候,年平均降雨量约1800 mm,年平均蒸发量为1310 mm。2011年5月11日播海蓬子(Salicornia bigelovii Torr.)种子于海涂上,播种前施过磷酸钙375 kg/hm2,有机肥600 kg/hm2,复合肥300 kg/hm2作为基肥。土壤为青紫塥粘土,母质为近代浅海与江涂沉积物,质地轻粘,土壤pH值7.1,有机质2.8 g/kg,碱解氮111.2 mg/kg,速效磷(P2O5)35.1 mg/kg,速效钾(K2O)670.0 mg/kg,氯化钠0.98 g/kg。播种量为25 kg/hm2,播后用海水(盐度约15‰)浇透,水渗后覆盖遮荫网保湿。6月15日,幼苗长到9 cm左右,选取大小基本一致的海蓬子幼苗移植到盛有40 kg海砂的塑料箱中培养。为了不影响海蓬子的生长,采用含10‰NaCl的Hoagland营养液培养,每3 d换1次营养液,每天用自来水补充蒸发的水量。培养到6月28日,开始进行盐处理。为避免盐冲击效应,采用下表1方式进行加NaCl调节盐浓度。盐处理至7月18日左右,海蓬子进入开花期。8月5日,测定光合,并取样测定其他指标。试验设计为随机区组设计,每个处理3次重复。
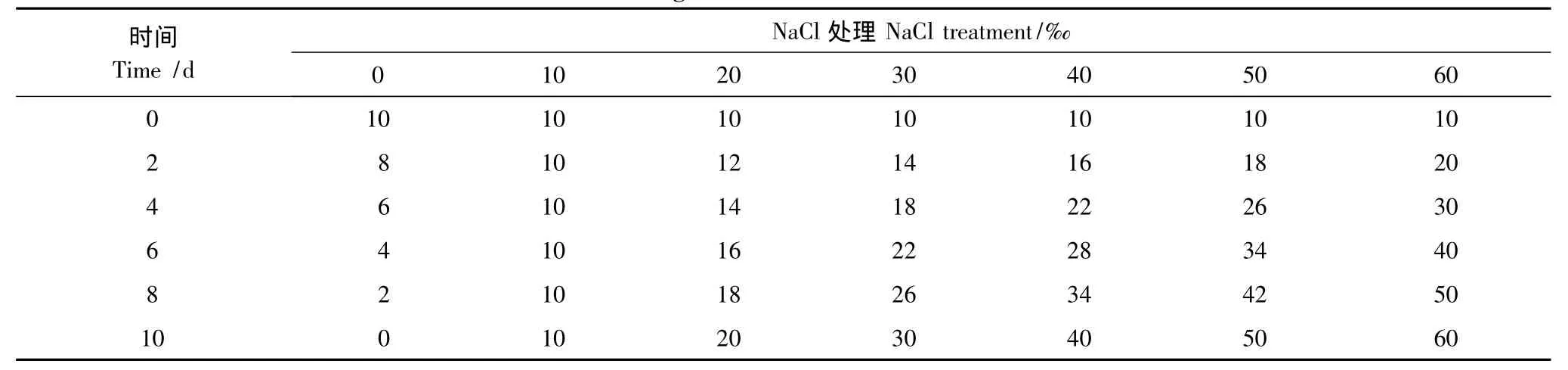
表1 不同处理的加盐方式Table1 Adding salt method of different treatments
1.2 测定项目与方法
1.2.1 植株形态指标的测定
在盐处理结束时,每重复选5株测量株高,然后蒸馏水冲洗数次,吸干表面水分,105℃烘箱中杀青10 min,75℃下烘至恒量,称得干质量,得到植株生物量。
1.2.2 光合色素含量的测定
称取0.1 g茎尖,剪成数段放入25 mL提取液(1∶1的无水乙醇和丙酮)中,在25℃黑暗条件下提取24 h,测定提取液在663、645和470 nm处的吸光值,参照文献[12]计算叶绿素a(Chl a)、叶绿素b(Chl b)、总叶绿素(Chl)以及类胡萝卜素(Car)含量。
1.2.3 光合指标的测定
采用LI-6400(Li-Cor Inc,美国)便携式光合测定系统于9:00—11:00测定海蓬子距茎尖约2cm成熟区净光合速率(Pn)、气孔导度(Gs)以及蒸腾速率(Tr)。采用开放式气路,CO2浓度约为385μmol/L左右,选择红蓝光源叶室,设定光合有效辐射(PAR)为1000μmol m-2s-1。每个处理每重复选择5株植株测定。根据邱念伟和孔甜甜文献[13]换算各光合系统参数。茎尖水分利用率(WUE,μmol CO2·mmol-1H2O)=Pn/Tr。
1.2.4 超氧化物歧化酶(SOD)、过氧化物酶(POD)活性和丙二醛(MDA)含量的测定
参照文献[14]方法,取0.5 g茎尖,加5 mL 50 mmol/L pH值7.0磷酸提取液冰浴研磨,4℃(10000×g)离心30 min,上清液为待测提取液。用氯化硝基四氮唑蓝(NBT)法,560 nm比色测定SOD活性;愈创木酚法测定POD活性;按照文献[15]的方法测定MDA含量。
1.2.5 离子含量测定
取0.1 g干样,加5 mL浓H2SO4消煮,30%H2O2作为催化剂,定容到100 mL,稀释数倍,采用原子吸收法测定K+和Na+含量。植株地上部分Cl-测定参照Akram等[16]方法。
1.3 数据处理
采用SPSS软件对试验数据进行方差分析和LSD显著性测验。数据结果为平均值+标准差(mean+SD)。采用SigmaPlot10.0软件作图。
2 结果与分析
2.1 花期盐胁迫对海蓬子生长的影响
由图1可以看出,海蓬子的株高和地上部生物量均随着NaCl浓度增加呈先增后降的趋势。当NaCl浓度为10‰时,其株高和地上部生物量均达到最大,分别为对照1.1倍和1.2倍,且均达到显著水平(P<0.05);当NaCl浓度达到30‰时,其株高和地上部生物量均显著降低(P<0.05)。随着盐度的进一步上升,其株高和地上部生物量下降愈显著,当NaCl浓度为60‰时,其株高和地上部生物量分别为对照的83%和58%。
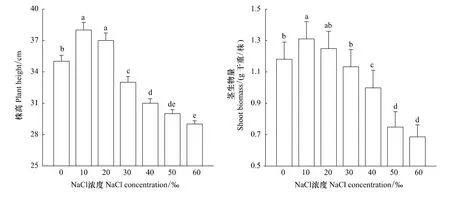
图1 花期盐胁迫对海蓬子株高和地上部干重的影响Fig.1 Effect of salt stress on plant height and shoot dry biomass of Salicornia bigelovii during flowering stage
2.2 花期盐胁迫对海蓬子茎光合色素含量和构成的影响
随盐浓度增加,海蓬子茎总叶绿素(Chl)含量呈先增后降的趋势,其中当NaCl浓度为10‰时,其Chl含量最高,30‰—60‰NaCl处理下,其Chl含量显著低于对照(图2)。与Chl含量变化不同,类胡萝卜素(Car)含量变化较平缓(图2)。与对照相比,NaCl浓度为10、20‰时,处理间Car含量无显著差异;当NaCl浓度为30‰、40‰、50‰和60‰时,Car含量均显著低于对照(P<0.05),其处理间差异不显著(图2)。其叶绿素a含量/叶绿素b含量(Chl a/Chl b)这一比值随盐浓度增加,呈先增后降。其中,当NaCl浓度为20‰时,其Chl a/Chl b达到最大;而类胡萝卜素含量/叶绿素含量(Car/Chl)这一比值随着盐度的增加,出现显著增加的趋势(P<0.05,图2)。
2.3 花期盐胁迫对海蓬子光合特性的影响
与海蓬子生长趋势相似,海蓬子茎的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)以及水分利用率(WUE)随盐浓度上升增加呈先增后降(图3)。当NaCl浓度为10‰时,海蓬子Pn、Gs以及Tr均达到最大,分别比对照增加10%、17%以及14%,均达到显著水平(P<0.05)。当NaCl浓度达到40‰时,其Pn比对照降低9%,达到显著水平(P<0.05);与对照相比,Gs和Tr均在NaCl浓度为50‰时才显著下降(P<0.05)。与光合其他指标不同,当NaCl浓度低于40‰时,其WUE间的差异并不显著,而当NaCl浓度高于50‰时其WUE显著低于对照(P<0.05,图3)。
NaCl浓度为10‰、20‰以及30‰时,海蓬子Ci和对照差异均不显著,随着盐度进一步上升,其Ci逐渐显著下降(P<0.05,图3),而海蓬子气孔限制值(Ls)变化却相反。与对照相比,NaCl浓度为10‰、20‰以及30‰时海蓬子Ls均显著下降(P<0.05)。随着盐度的进一步上升,海蓬子Ls快速上升,但NaCl浓度为60‰时才与对照间有显著差异(P<0.05)。
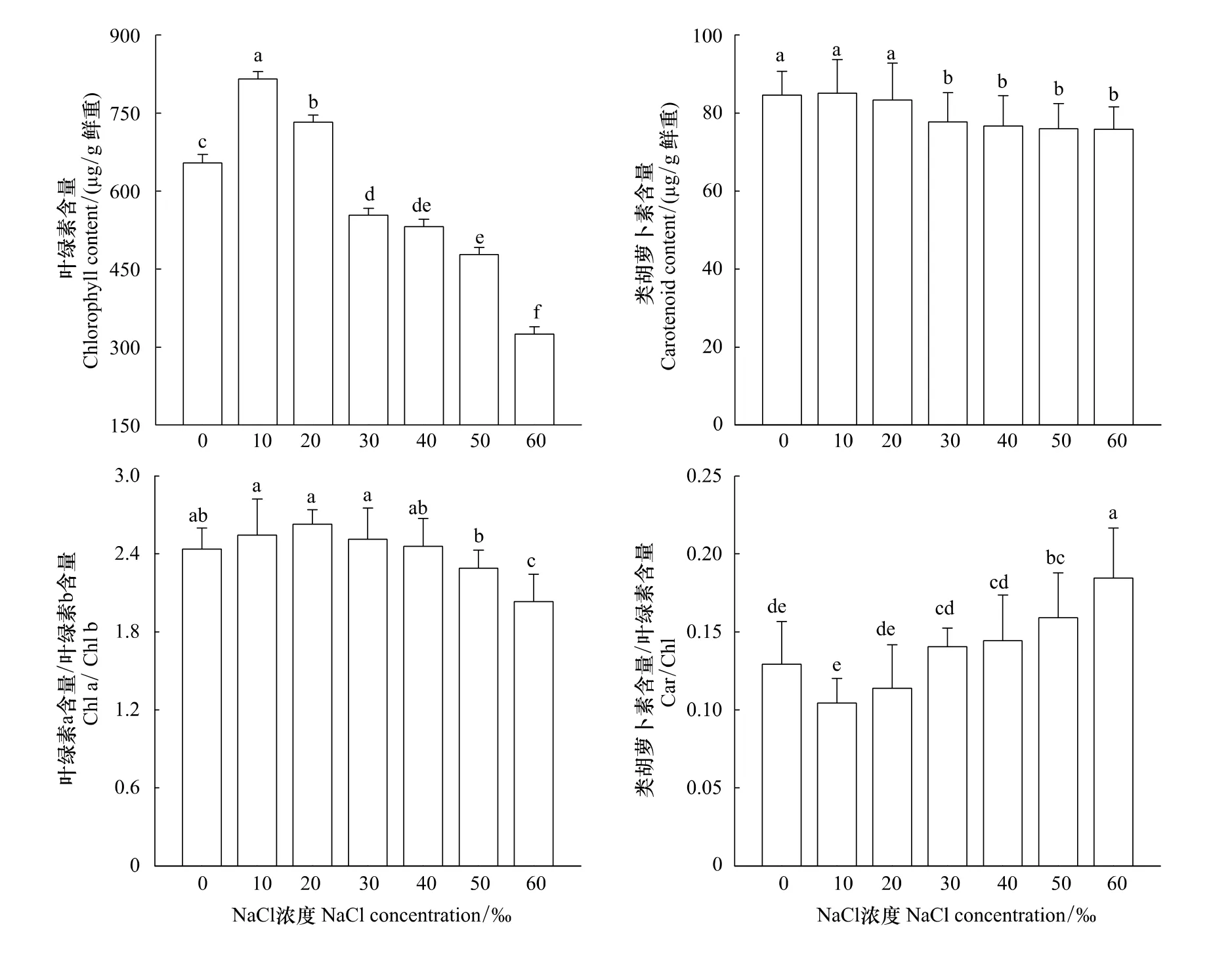
图2 花期盐胁迫对海蓬子叶绿素、类胡萝卜素含量以及叶绿素a/叶绿素b、类胡萝卜素/叶绿素值的影响Fig.2 Effect of salt stress on contents of chlorophyll and carotenoid and ratio of Chl a/Chl b and Car/Chl in Salicornia bigelovii during flowering stage
2.4 花期盐胁迫对海蓬子茎SOD、POD活性及其MDA含量的影响
随着盐浓度的增加,海蓬子茎SOD、POD活性均先升后降,当盐浓度为10‰时,其SOD、POD活性均达到最大,分别比对照增加9%和10%,且均达到显著水平(P<0.05)。当NaCl浓度上升,海蓬子茎POD活性降幅要大于SOD活性(图4)。10、20‰ NaCl处理下,其MDA含量和对照间差异不显著,随着盐度的增加,海蓬子茎MDA含量显著增加(P<0.05,图5)。
2.5 花期盐胁迫对海蓬子茎Na+、Cl-、K+含量和Na+/K+比的影响
随盐浓度上升,海蓬子Na+、Cl-含量和Na+/K+比均逐渐增加,而K+含量则逐渐减少(图6)。当NaCl浓度增加到30‰以上,其茎K+含量不再显著下降;而当NaCl水平增加到40‰以上,茎Na+含量也不再显著增加,Cl-含量和Na+/K+比在50‰和60‰ NaCl处理时差异不显著,但均显著高于40‰ NaCl处理(P<0.05)。
2.6 花期盐处理下海蓬子生长指标与其它生理生化指标的相关性分析
相关分析(表2)显示,茎生物量除了与茎的水分利用率(WUE)、类胡萝卜素(Car)含量、Na+含量没有相关性外,与 Chl a/Chl b 呈现显著正相关(P<0.05),与茎 Pn、Gs、Ci、Tr、Chl含量、K+含量、SOD 和 POD 活性呈现极显著正相关(P<0.01),与茎气孔限制值(Ls)、Car/Chl、MDA含量、Cl-含量和Na+/K+等均呈极显著负相关(P<0.01);株高与其WUE、Chl a/Chl b没有相关性,与茎Na+含量呈现显著负相关(P<0.05),与Ls、Car/Chl、MDA 含量、Cl-含量和 Na+/K+等均呈极显著负相关(P<0.01),与茎 Pn、Gs、Ci、Tr、Chl含量、Car含量、K+含量、SOD和POD活性呈现极显著正相关(P<0.01)。
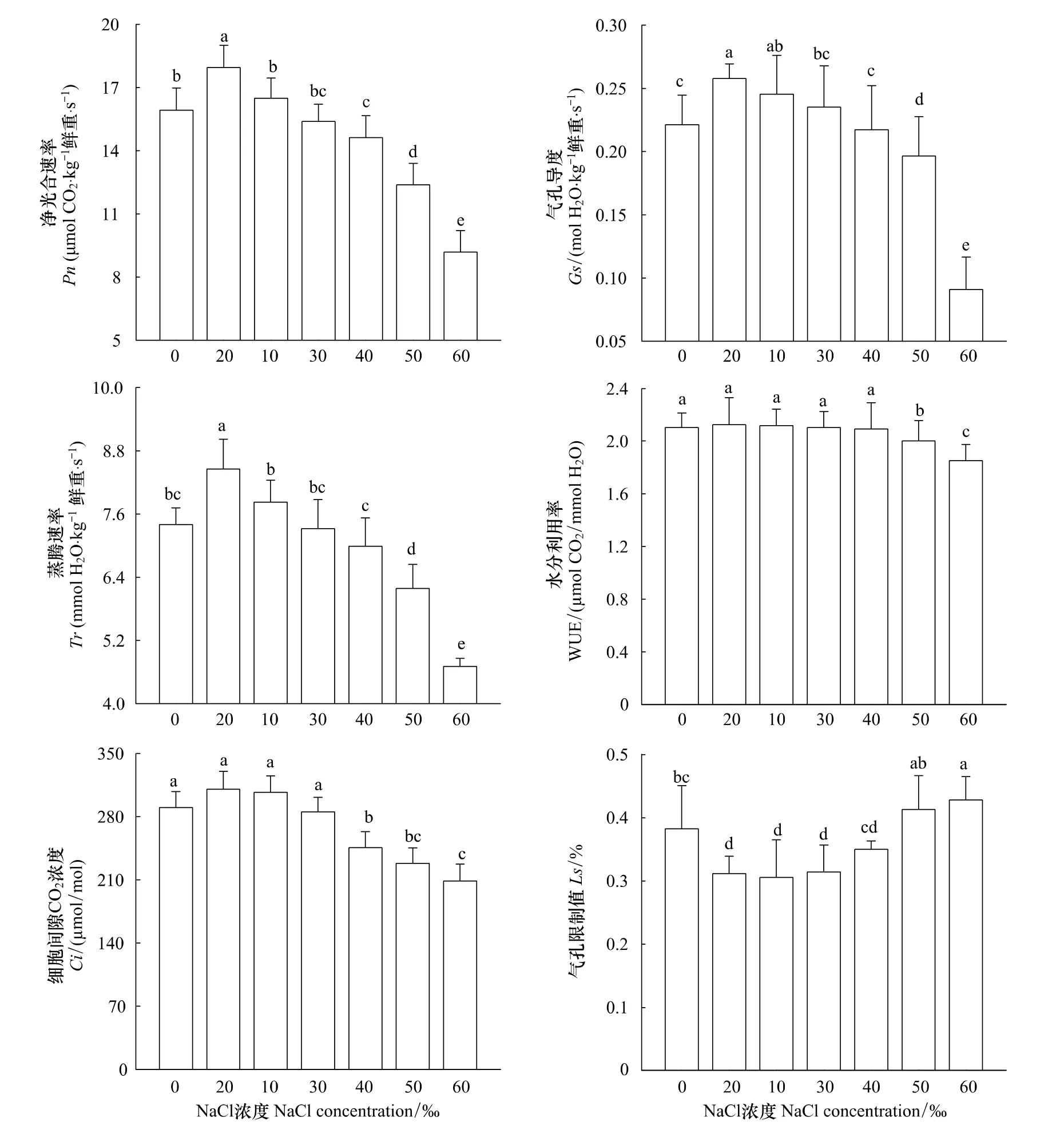
图3 花期盐胁迫对海蓬子净光合速率、气孔导度、蒸腾速率、水分利用率、细胞间隙CO2浓度以及气孔限制值的影响Fig.3 Effect of salt stress on net photosynthetic rate,stomatal conductance,transpitation rates,WUE,intercellular CO2 concentration and stomatal limitation of Salicornia bigelovii during flowering stage
3 讨论
海蓬子开花前后处于温度较高的夏季,生长相对比较旺盛。本研究发现,无盐条件下海蓬子仍能够正常生长;当NaCl浓度在10‰时,海蓬子的株高和生物量均表现最高,显著高于对照(无盐处理)。但当浓度超过40‰,生长即受到显著抑制,这与海蓬子幼苗期[17]的相关研究相似。从营养器官物质转运及其对籽粒增产的贡献来看,籽粒产量形成与花期作物生物量成正相关[18],不同NaCl浓度下花期海蓬子的生物量的积累可能也会影响后期籽粒形成和产量。已有研究表明,盐胁迫条件下不同生育期海蓬子的生长与其光合作用、离子积累和分配、营养吸收等生理生化代谢有密切关系[19-21]。
盐胁迫既可以直接影响甜土植物生长,也可以通过降低净光合速率、气孔导度、蒸腾速率而间接抑制植物生长[22]。与甜土植物不同,盐土植物往往不仅能够在高盐条件下存活,而且适宜浓度NaCl可以提高其光合能力,促进生长[23-24]。花期10‰NaCl浓度处理能够显著地提高海蓬子的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)等,从而显著地促进植株生长,但当NaCl浓度超过40‰时其光合能力就显著下降,这种生长和光合的正相关性与NaCl胁迫对海蓬子幼苗期光合作用研究基本一致的[25],但幼苗期盐胁迫条件下海蓬子光合速率下降的主要原因仍存未定论[25]。一般来说,逆境胁迫条件下引起植物叶片光合速率降低的植物自身因素主要有气孔部分关闭导致的气孔限制和叶肉细胞光合活性下降导致的非气孔限制两类。当Ci和Pn两者均减少,且Ls增大时,光合速率下降主要是由于气孔导度的降低;否则,如果Pn下降,Ci升高,Ls减少,则是因为叶肉细胞光合活性的降低[26]。与10‰NaCl浓度时相比,0、30‰、40‰、50‰、60‰NaCl浓度处理的植株Pn、Ci均降低,而Ls均增加。表明此时气孔的部分关闭是引起海蓬子光合速率下降的主要原因。其相关性分析也充分证实了这一点,即在本研究诸多指标中,Ls与植株的耐盐性的相关性要高于其它所有指标。另外,当NaCl浓度为60‰时其气孔导度低于0.10 H2O kg-1鲜重s-1时也伴随着非气孔限制因素[27],表明高盐胁迫下花期海蓬子光合作用的降低是被气孔导度和非气孔限制两种限制因素影响,这又不同于幼苗期光合速率下降原因的可能猜测[25]。此外,气孔也控制着植株与外界环境的水气交换,当NaCl浓度超过30‰时,Gs降低,一方面减少了植株对外界CO2的吸收,导致Ci下降;另一方面使水分通过气孔扩散受阻,抑制了植株的Tr,减少水分的过度散失。此外,当NaCl浓度超过50‰时,海蓬子的光合作用受到严重抑制,导致植株WUE显著下降。

图4 花期盐胁迫对海蓬子茎SOD和POD酶活性的影响Fig.4 Effect of salt stress on the activities of SOD and POD in shoot of Salicornia bigelovii during flowering stage
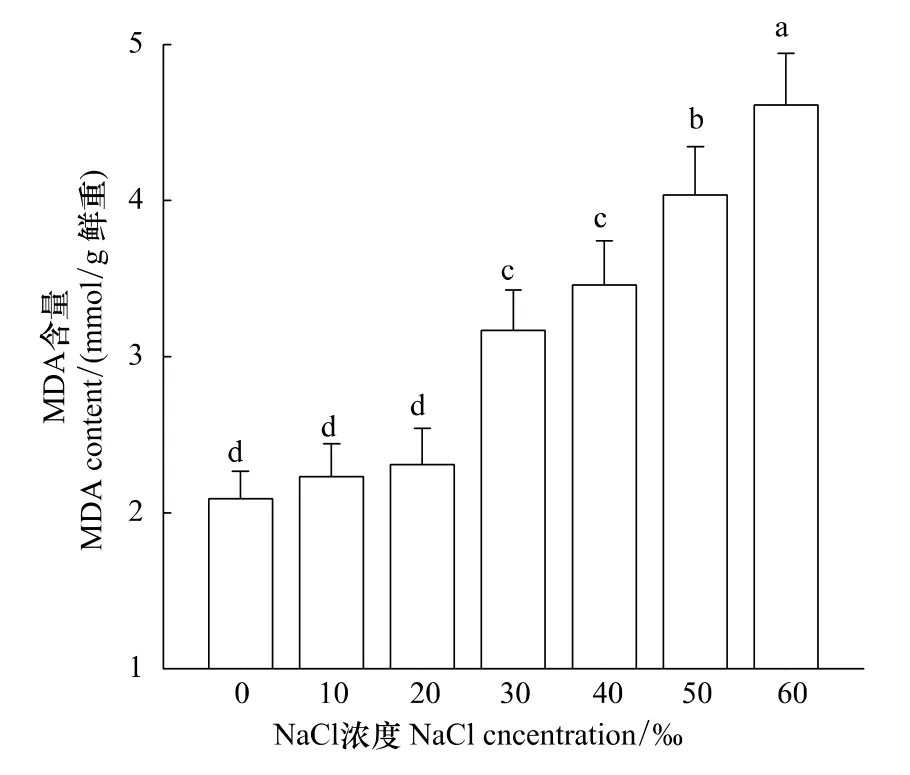
图5 花期盐胁迫对海蓬子茎MDA含量的影响Fig.5 Effect of salt stress on MDA content in shoot of Salicornia bigelovii during flowering stage
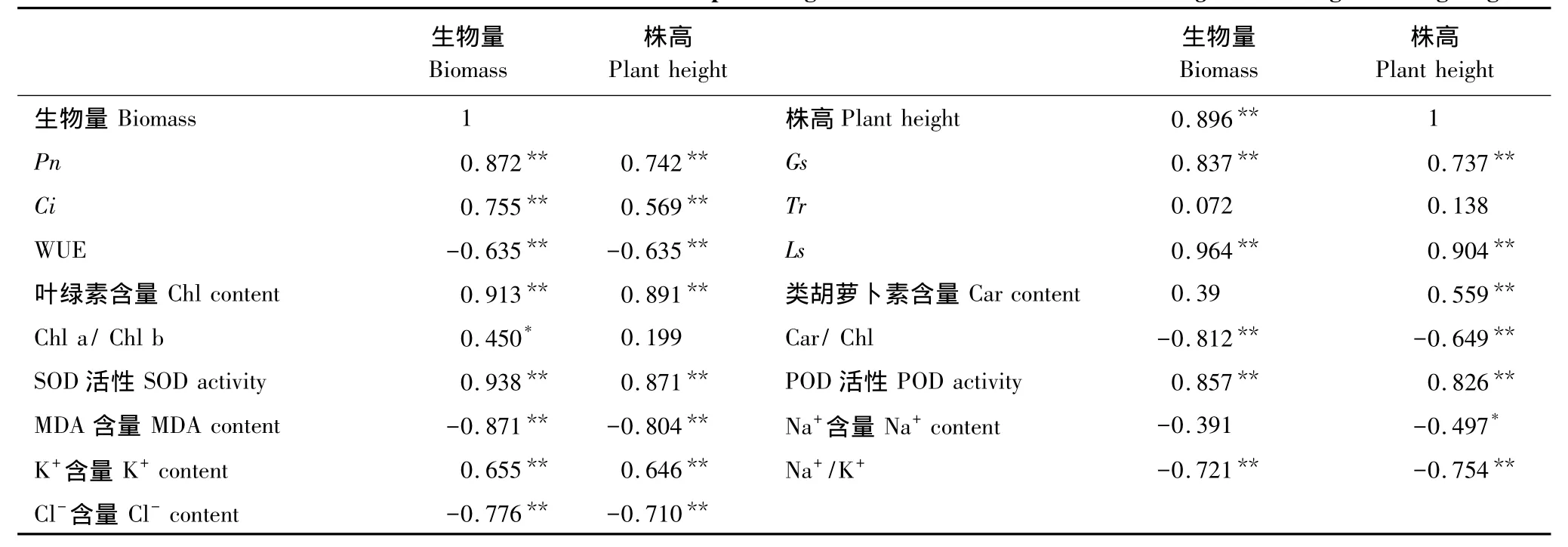
表2 海蓬子茎生物量、株高与其他指标间的相关性分析Table2 Correlative coefficients between shoot biomass and plant height the other indexes of Salicornia bigelovii during flowering stage
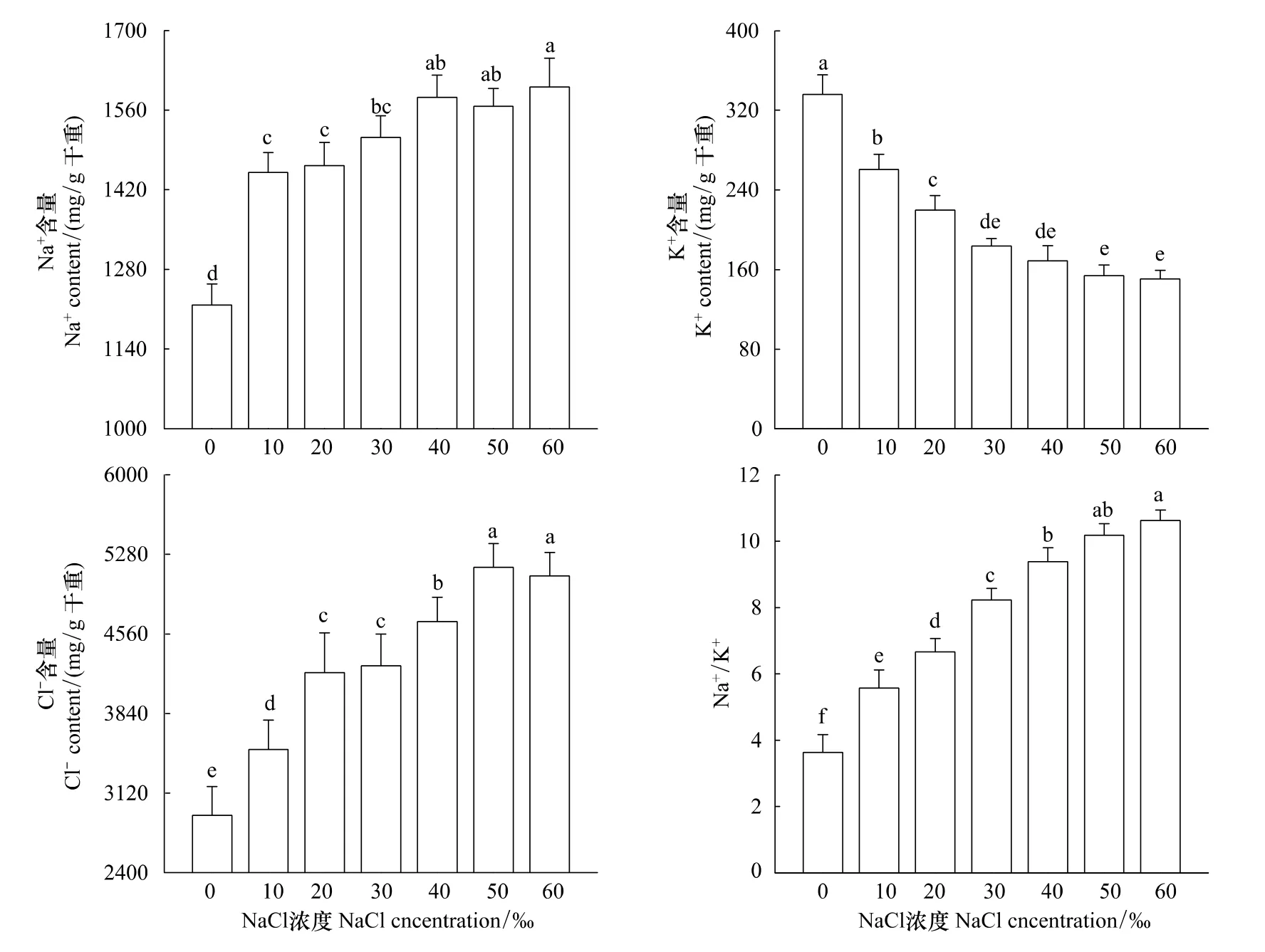
图6 花期盐胁迫对海蓬子Na+、K+、Cl-含量以及Na+/K+的影响Fig.6 Effects of salt stress on contents of Na+,K+,Cl- and Na+/K+ratio of Salicornia bigelovii during flowering stage
正如本研究中相关分析所示,叶绿素(Chl)含量的高低与光合作用密切相关,盐胁迫能导致植物Chl含量降低[28],其原因有两方面,一方面NaCl能提高叶绿素酶活性,促进Chl分解[29];另一方面在于类胡萝卜素(Car)含量降低,减少了对活性氧的淬灭,导致了细胞内积累较多的氧自由基,加速了Chl分解[30]。本研究发现,10‰NaCl处理下,花期海蓬子Chl显著增加,而Car含量无明显变化,但当浓度增加至40‰时均开始下降。Chl含量降幅明显大于Car,这表明Chl对盐度的变化远比Car敏感,而Car的稳定性很可能对维持海蓬子较高的耐盐性具有显著的生理意义。本研究进一步发现,海蓬子Car/Chl值与其清除活性氧的SOD、POD活性呈极显著负相关(R2=-0.781**和R2=-0.810**),而与 MDA含量呈极显著正相关(R2=0.772**),这也说明了Car/Chl与海蓬子清除活性氧和忍受盐胁迫的能力紧密相关。周泉澄等[31]通过海水浇灌海蓬子幼苗发现,POD并不是盐环境下主要抗氧化酶,仅SOD、CAT才是耐盐植物筛选的重要指标,而本研究却发现,花期盐胁迫条件下SOD、POD活性均与叶绿素含量变化一致,与植株生物量均存在极显著正相关(R2=0.917**和R2=0.934**),表明花期盐胁迫中SOD、POD对改善海蓬子抗氧化能力具有明显作用。从NaCl浓度效应分析,与无盐处理相比,花期10‰NaCl能提高Chl含量、Car/Chl以及SOD、POD活性,促进植株正常生长,而当NaCl浓度超过40‰时海蓬子的抗氧化酶活性均显著降低,而MDA含量迅速积累,最终对机体细胞产生毒害作用,促使Chl分解,降低其光合作用。这与Aghaleh等[32]在海蓬子幼苗上的相关研究近乎一致。另外,王标等[33]指出,Chl a/Chl b的比值越大,被光能激发的Chl a分子就越多,直接参与光化学反应的分子就越多,利于光合效率的提高。本研究也发现NaCl浓度在10‰—20‰时,叶绿素a/b的比值较高,而当NaCl浓度超过40‰时,其值显著下降。其比值与植株耐盐性也有显著的相关性。
海蓬子是耐盐植物,是典型的稀盐盐生植物,细胞内Na+、K+吸收是明显分开的环节,其中K+的吸收并不因Na+介入而改变[34]。已有研究发现,低盐胁迫下,海蓬子幼苗主要将Na+、Cl-积累在地上部分,海蓬子将Na+从细胞质中转运到液泡中,区域化储存在液泡中,从而引起植株中Na+/K+比值均明显上升,但结合生长特性分析,K+并不是影响海蓬子幼苗生长的关键因素[25,35]。这与本研究结果一致,但本研究还发现,当NaCl浓度超过30‰时花期海蓬子体内Na+、K+含量变化均趋于平缓,生物量却显著下降。表明在高盐胁迫下花期海蓬子不可能在液泡中积累过高的浓度,当超过最高浓度时可能引起细胞质中Na+的积累,因为体外研究发现盐生植物和甜土植物细胞质中的酶都不能忍受较高的Na+浓度[36],所以花期高盐胁迫仍会使海蓬子受到离子毒害,这又有别于幼苗期[25]。
总之,海蓬子具有较强的耐盐能力。花期盐胁迫环境下,10‰ NaCl浓度较为显著地促进其生长;40‰NaCl浓度则显著地抑制其生长。按照相关性分析和相关系数显示,适宜评价花期海蓬子耐盐性的指标为:Ls、SOD 活性、Chl含量、株高、Pn、MDA 含量、POD 活性、Gs、Car/Chl、Cl-含量、Ci、Na+/K+、K+含量和 WUE。其中以Ls的相关性最为明显,这表明,气孔因素在海蓬子光合作用抑制中起主要作用。海蓬子耐盐性有待深入探讨。
[1] Desai P D,Dave A M,Devi S.Alcoholysis of salicornia oil using free and covalently bound lipase onto chitosan beads.Food Chemistry,2006,95(2):193-199.
[2] Tang W Z,Liu Z P,Zhu J H,Pen H X,Li H L.A study on the component content of two North American glasswort new species.Journal of Guangxi Agriculture,2003,(5):33-35.
[3] Pandya JB,Gohil R H,Patolia J S,Shah M T,Parmar D R.A study on Salicornia(S.brachiata Roxb.)in salinity ingressed soils of India.International Journal of Agricultural Research,2006,1(1):91-99.
[4] Ventura Y,Wuddineh W A M,Myrzabayeva M,Alikulov Z,Khozin-Goldberg I,Shpigel M,Samocha T M,Sagi M.Effect of seawater concentration on the productivity and nutritional value of annual Salicornia and perennial Sarcocornia halophytes as leafy vegetable crops.Scientia Horticulturae,2011,128(3):189-196.
[5] LüS,Jiang P,Chen X,Fan P,Wang X,Li W.Multiple compartmentalization of sodium conferred salt tolerance in Salicornia europaea.Plant Physiology and Biochemistry,2012,51:47-52.
[6] Khan M A,Gul B,Weber D J.Germination responses of Salicornia rubra to temperature and salinity.Journal of Arid Environments,2000,45(3):207-214.
[7] Katsching D,Broekman R,Rozema J.Salt tolerance in the halophyte Salicornia dolichostachya Moss:growth,morphology and physiology.Environmental and Experimental Botany,2012,http://dx.doi.org/10.1016/j.envexpbot.2012.04.002.
[8] Ventura Y,Wuddineh W A,Ephrath Y,Shpigel M,Sagi M.Molybdenum as an essential element for improving total yield in seawater-grown Salicornia europaea L.Scientia Horticulturae,2010,126(3):395-401.
[9] Ventura Y,Wuddineh W A,Myrzabayeva M,Alikulov Z,Khozin-Goldberg I,Shpigel M,Samocha T M,Sagi M.Effect of seawater concentration on the productivity and nutritional value of annual Salicornia and perennial Sarcocornia halophytes as leafy vegetable crops.Scientia Horticulturae,2011,128(3):189-196.
[10] Ventura Y,Wuddineh W A,Shpigel M,Samocha T,Klim B C,Cohen S,Shemer Z,Santos R,Sagi M.Effects of day length on flowering and yield production of Salicornia and Sarcocornia species.Scientia Horticulturae,2011,130(3):510-516.
[11] Egli D B,Bruening W P.Increasing sink size does not increase photosynthesis during seed filling in soybean.European Journal of Agronomy,2003,19(2):289-298.
[12] Li H S.Experimental Principle and Technique for Plant Physiology and Biochemistry.Beijing:Higher Education Press,2000.
[13] Qin N W,Kong T T.Determination of net photosynthetic rate based on unit fresh weight of anomalistic plant material.Plant Physiology Journal,2011,47(4):406-408.
[14] Tan W,Liu J,Dai T,Jing Q,Cao W,Jiang D.Alterations in photosynthesis and antioxidant enzyme activity in winter wheat subjected to postanthesis waterlogging.Photosynthetica,2008,46(1):21-27.
[15] Du Z,Bramlage WJ.Modified thiobarbituric acid assay for measuring lipid oxidation in sugar-rich plant tissue extracts.Journal of Agricultural and Food Chemistry,1992,40(9):1566-1570.
[16] Akram M S,Ashraf M,Akram N A.Effectiveness of potassium sulfate in mitigating salt-induced adverseeffects on different physio-biochemical attributes in sunflower(Helianthus annuus L.).Flora,2009,204(6):471-483.
[17] Ayala F,O'Jeary J W.Growth and physiology of Salicornia bigelovii Torr.at suboptimal salinity.International Journal of Plant Sciences,1995,156(2):197-205.
[18] Yang H,Zhang Y,Xu S,Li G,Guo J,Wang Z.Characteristics of dry matter and nutrients accumulation and transformation of super-high yield spring maize.Plant Nutrition and Fertilizer Science,2012,18(2):315-323.
[19] Boyer K E,Fong P,Vance R R,Ambrose R F.Salicornia Virginica in a southern California salt marsh:Seasonal patterns and a nutrientenrichment experiment.Wetlands,2001,21(3):315-326.
[20] Riehl T E,Ungar I A.Growth and ion accumulation in Salicornia europaea under saline field conditions.Oecologia,1982,54(2):193-199.
[21] Ushakova SA,Kovaleva N P,Tikhomirova NA,Gribovskaya IV,Kolmakova A A.Effect of photosynthetically active radiation,salinization,and type of nitrogen nutrition on growth of Salicornia europaea plants.Russian Journal of Plant Physiology,2006,53(6):886-894.
[22] Zheng C,Jiang D,Liu F,Dai T,Jing Q,Cao W.Effects of salt and waterlogging stresses and their combination on leaf photosynthesis,chloroplast ATP synthesis,and antioxidant capacity in wheat.Plant Science,2009,176(4):575-582.
[23] Flowers T J,Troke P F,Yeo A R.The mechanism of salt tolerance in halophytes.Annual Review of Plant Physiology,1977,28(1):89-121.
[24] Maggio A,Reddy MP,Joly R.Leaf gas exchange and solute accumulation in the halophyte Salvadora persica grown at moderate salinity.Environmental and Experimental Botany,2000,44(1):31-38.
[25] Wang L Y,Zhao K F.Effect of NaCl stress on ion compartmentation,photosynthesis and growth of S alicornia bigelovii Torr..Journal of Plant Physiology and Molecular Biology,2004,30(1):94-98.
[26] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis.Annual Review of Plant Physiology,1982,33(1):317-345.
[27] Flexas J,Bota F,Loreto F,Cornic G,Sharkey T D.Diffusive and metabolic limitations to photosynthesis under drought and salinity in C3 plants.Plant Biology,2004,6(3):269-279.
[28] Tang W,Luo Z,Wen S M,Dong H Z,Li W J,Xin C S.Comparison of inhibitory effects on leaf photosynthesis in cotton seedlings between drought and salinity stress.Cotton Science,2007,19(1):28-32.
[29] Dao W Q,Zhang WH Liu Y L.Changes in composition and function of thylakoid membrane isolated from barley seedling leaves under salt stress.Acta Photophsiologica Sinica,1997,23(2):105-110.
[30] Sakaki T,Kondo N,Sugahara K.Breakdown of photosynthetic pigments and lipids in spinach leaves with ozone fumigation Role of active oxygens.Physiologia Plantarum,1983,59(1):28-34.
[31] Zhou Q,Hua C,Zhou F,Chen Q,Wang R.Study on adaptability of antioxidize and osmoregulation substance in seedling of Salicornia bigelovii Torr.and Salicornia europaea L.watered with artificial seawater.Chinese Journal of Grassland,2010,32(5):101-105.
[32] Aghleh M,Niknam V,Ebrahimzadeh H,Razavi K.Salt stress effects on growth,pigments,proteins and lipid peroxidation in Salicornia persica and S.europaea.Biologia Plantarum,2009,53(2):243-248.
[33] Wang B,Yu M K,Sun H J,Cheng X R,Dan QH,Fang Y M.Photosynthetic characters of Quercusacutissima from different provenances under effects of salt stress.Chinese Journal of Applied Ecology,2009,20(8):1817-1824.
[34] Glenn E P,Brown J J.Salt tolerance and crop potential of halophytes.Critical Reviews in Plant Sciences,1999,18(2):227-255.
[35] Aghaleh M,Niknam V,Ebrahimzadeh H,Razavi K.Effect of salt stress on physiological and antioxidative responses in two species of Salicornia(S.persica and S.europaea).Acta Physiologiae Plantarum,2011,33(4):1261-1270.
[36] Flowers TJ.The effect of sodium chloride on enzyme activities from four halophytes specie of chenopodiaceae.Phytochemistry,1972,11(6):1881-1886.
参考文献:
[2] 唐文忠,刘泽平,朱建华,彭宏祥,李华林.两个北美海蓬子新品种组分含量研究.广西农学报,2003,(5):33-35.
[12] 邱念伟,孔甜甜.不规则植物材料单位鲜重光合速率的测定.植物生理学报,2011,47(4):406-408.
[13] 李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000.
[18] 杨恒山,张玉芹,徐寿军,李国红,高聚林,王志刚.超高产春玉米干物质及养分积累与转运特征.植物营养与肥料学报,2012,18(2):315-323.
[25] 王丽燕,赵可夫.NaCl胁迫对海蓬子 (S alicornia bigelovii Torr.)离子区室化、光合作用和生长的影响.植物生理与分子生物学学报,2004,30(1):94-98.
[28] 唐薇,罗振,温四民,董合忠,李维江,辛承松.干旱和盐胁迫对棉苗光合抑制效应的比较.棉花学报,2007,19(1):28-32.
[29] 刁丰秋,章文华,刘友良.盐胁迫对大麦叶片类囊体膜组成和功能的影响.植物生理学报,1997,23(2):105-110.
[31] 周泉澄,华春,周锋,陈全战,王仁雷.毕氏海蓬子和盐角草幼苗抗氧化酶与渗透物质对海水浇灌的适应性研究.中国草地学报,2010,32(5):101-105.
[33] 王标,虞木奎,孙海菁,成向荣,单奇华,方炎明.盐胁迫对不同种源麻栎叶片光合特征的影响.应用生态学报,2009,20(8):1817-1824.

