猴头菌多糖不同脱色方法的研究
蒋 俊,杨 焱 ,罗 玺,吴 迪,唐庆九,张劲松,冯志勇
1农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,上海市农业科学院食用菌研究所,上海 201403;2南京农业大学生命科学学院,江苏南京 210095;3丽水市农业科学院食药用菌研究所,浙江丽水 323000
多糖是猴头菌中的主要活性物质,猴头菌粗多糖含有较多的色素和大量的蛋白,多糖色素的去除可以改善粗多糖的色泽,同时脱色可以提高多糖的纯度,有助于猴头菌多糖类产品的开发。目前常用的多糖脱色方法有:活性炭吸附法,化学脱色法,大孔树脂脱色等。活性炭为具发达的微孔构造的黑色粉末或颗粒,无嗅无味,具有巨大的比表面积,常温时化学性质稳定,不溶于水和普通溶剂[1]。化学脱色又可分为氧化脱色和还原脱色,由于有机物呈现颜色的主要原因是π-π跃迁,化学脱色的实质是脱色试剂在酸性或碱性介质中通过亲电作用和亲核作用破坏发色基团[2]。大孔树脂是一类人工合成的具有多孔立体结构的聚合物,通常所说的大孔树脂包括大孔型离子交换树脂和大孔吸附树脂,两者在化学结构上相似,不同之处在于大孔吸附树脂不存在酸性或碱性基团,它的吸附作用是通过树脂表面的孔径吸附,表面电性或形成氢键等达到的[3]。
不同的脱色方法不仅会对多糖脱色效果产生影响,而且脱色后多糖的组成会发生变化,从而影响脱色后多糖的生物活性[4]。因此筛选一种既能保证猴头菌多糖的脱色效果又能保持或提高其生物活性的脱色方法是非常重要的。本研究应用几种常用的脱色方法对猴头菌多糖进行了脱色研究,以期找到一种合适的脱色方法。
1 材料与方法
1.1 材料
1.1.1 实验材料
喷雾干燥的猴头菌粗多糖(浙江庆元博瑞药业有限公司),透析袋;RAW264.7骨髓巨噬细胞株购自美国国家菌种保藏中心(American Type Culture Collection,ATCC);Balb/c小鼠 SPF级,8~10周龄(体重28±1 g),购自中科院上海实验动物研究中心;树脂 D303、335、HZ202、HZ801、HZ806、HZ816、JK206、D315购自上海华震科技有限公司,MG-1、脱色1号购自沧州宝恩吸附材料科技有限公司;活性炭为国药产品。
1.1.2 实验试剂
DMEM培养基、无色 RPMI1640培养基、有色RPMI1640培养基、0.25%胰蛋白酶、胎牛血清(FBS)均购自GIBCO公司;青霉素、链霉素均购自Amersco公司;细菌脂多糖(LPS)、植物凝集素(PHA)、磺胺、萘乙烯二胺盐酸盐均购自Sigma公司;Alamar Blue为Biosource公司产品;Tris、二甲亚砜(DMSO)、磷酸、氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾、盐酸等试剂均为国产分析纯。
Griess试剂:准确量取6.25 mL的磷酸,加蒸馏水至250 mL,接着加入2.50 g磺胺和0.25 g萘乙烯二胺盐酸盐,用磁力搅拌器搅拌至完全溶解,最后装入棕色试剂瓶于4℃冰箱中保存。
1.1.3 实验仪器
旋转蒸发仪(BüCH公司);冷冻干燥机(Thermo Savant公司);水浴锅(上海一恒科技有限公司);Synergy HT多功能酶标仪(基因公司);分析天平(Sartorius公司);超低温冰箱(Thermo Forma公司);离心机(Eppendorf公司);摇床(上海杜科自动化设备有限公司);大容量离心机(Beckman公司);二氧化碳培养箱(Thermo Forma公司);倒置显微镜(OLYMPAS公司);细胞计数仪(BECKMAN-COULTER公司)。
1.2 实验方法
1.2.1 分析方法
1.2.1.1 脱色率的测定
将猴头菌粗多糖溶液在可见光波长(380~780 nm)范围内进行全波长扫描,发现该粗多糖溶液在可见光区内无吸收峰,从380 nm到500 nm吸收相对稳定,500 nm到780 nm吸收下降趋势明显,表明猴头菌粗多糖溶液中色素主要吸收380 nm到500 nm的可见光,因此实验选择位于380 nm到500 nm中间的450 nm为检测波长,测定溶液的吸光度值[5]。
脱色前后的多糖溶液,13400×g离心15 min,取上清于96孔板中,用酶标仪测样品450 nm下的吸光度值。

1.2.1.2 多糖保留率的测定
由于粗多糖在制备时通过醇沉去除了小分子,粗多糖中还原糖含量极低,可忽略不计,用苯酚硫酸法[6]测得的总糖含量为多糖含量。
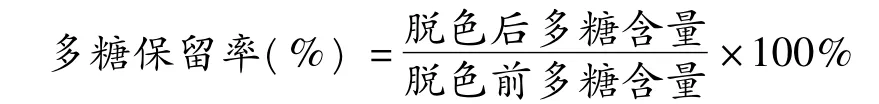
1.2.2 树脂预处理
凝胶型离子交换树脂HZ202,大孔离子交换树脂 D303、335、JK206、D315、脱色1 号预处理:先用蒸馏水清洗至无泡沫、无浑浊,再用1 mol/L的氢氧化钠溶液浸泡4 h,倒出碱液,用蒸馏水漂洗至中性。接着将树脂用1 mol/L的盐酸溶液浸泡4 h,倒出酸液,用蒸馏水漂洗至中性;再用1 mol/L的氢氧化钠溶液浸泡4 h,倒出碱液,用蒸馏水漂洗至近中性。
大孔吸附树脂 HZ801、HZ806、HZ816、MG-1 预处理:用95%乙醇搅拌浸泡4 h,使其充分溶胀,然后用乙醇重复洗至上清液在试管中加3倍水不显浑浊为止,再用蒸馏水洗至无醇味,备用。
1.2.3 猴头菌多糖脱色方法的比较
1.2.3.1 活性炭脱色多糖的制备
配制10 mg/mL的猴头菌多糖溶液,6471×g离心30 min,取上清,活性炭用量为1%,温度为50℃,脱色60 min;测定脱色率和多糖保留率。
1.2.3.2 双氧水脱色多糖的制备
配制10mg/mL的猴头菌多糖溶液,6471×g离心30 min,取上清,用氨水调pH至8.0,加入3%的30%的双氧水,60℃水浴180 min,调pH至7.0,离心取上清;测定脱色率和多糖保留率。
1.2.3.3 树脂脱色多糖的制备
配制10 mg/mL的猴头菌多糖溶液,6471×g离心30 min,取上清,100 mL上清加入20 mL的大孔树脂,摇床中120 rpm、25℃脱色6 h,离心取上清;测定脱色率和多糖保留率。
1.2.3.4 体外免疫实验样品的制备
将脱色率和多糖保留率较高的样品离心取上清过分子截流量为3500的透析袋,除去小分子,袋内的猴头粗多糖水溶液冷冻干燥进行体外免疫活性研究。
1.2.4 大孔树脂的筛选
取1.2.2中的十种大孔树脂各10 mL,每种大孔树脂三个平行,与50 mL 10 mg/mL的猴头多糖(6471×g离心30 min)溶液混合,迅速摇匀后取样,为初样,将三角瓶放到摇床中,温度设为25℃,120 rpm,脱色9 h;分别计算各树脂脱色后的脱色率和多糖保留率,选取脱色率和多糖保留率高的样品进行体外免疫活性研究。
1.2.5 样品刺激巨噬细胞产生NO的试验
准确称取5 mg左右的样品于灭过菌的Eppendorf离心管中,用 PBS(含 0.14 mol/L NaCl,0.0027 mol/L KCl,0.004 mol/L Na2HPO4,0.002 mol/L KH2PO4,pH 为7.4)配成5 mg/mL 的溶液,13400 ×g离心30 min,无菌操作台中将上清转入灭菌管中,用 PBS 将样品稀释至 2 mg/mL、1 mg/mL、500 μg/mL、250 μg/mL、100 μg/mL。细胞悬液的制备参照文献[7],细胞浓度稀释至 5 ×105个/mol,将细胞悬液加入96孔板,每孔180 μL,然后加入20 μL待测样品,每个样品设置3个复孔,以LPS(10 μg/mL)为阳性对照,PBS为阴性对照,37℃,5%CO2条件下培养24 h,取上述96孔板中上清100 μL于酶标条中,加入50 μL的 Griess试剂,静置10 min,测定543 nm下的吸光度值。
1.2.6 样品刺激脾淋巴细胞增殖的试验
样品用 PBS稀释至 2 mg/mL、1 mg/mL、500 μg/mL。小鼠脾淋巴细胞液的制备参照文献[8],细胞浓度稀释至2×106个/mL。将细胞悬液加入96孔板中,每孔180 μL,再加入20 μL样品,分别以20 μL PBS和 20 μL 60 μg/mL 的 PHA 溶液作阴性和阳性对照。于37℃、含5%CO2的细胞培养箱中培养3天,每孔加入20 μL Alamar Blue试剂,用酶标仪测定其在570 nm和600 nm处的吸光度值,培养箱中培养6 h,测定其在570 nm和600 nm处的吸光度值,应用Alamar Blue试剂的计算公式算出各样品对脾淋巴细胞增殖的影响,增值率为样品与阴性对照的比值。
计算公式:

2 结果与讨论
2.1 三种脱色方法的比较
2.1.1 三种脱色方法对多糖脱色率和保留率的影响
由表1可以看出大孔树脂的脱色率明显高于其它两种脱色方法。活性炭适合于吸附非极性化合物色素,而粗猴头多糖在制备过程中经过醇沉去除了大部分非极性小分子色素,故活性炭不适合于粗猴头多糖的脱色;双氧水在该脱色条件下脱色率较低,可能由于双氧水用量过低导致,在将双氧水的用量提高到5%时,脱色率可达到67%,在此条件下,进一步研究了双氧水对多糖活性的影响。

表1 三种不同脱色方法得到的脱色率和多糖保留率Table 1 Comparison of three different decolorizing methods
2.1.2 双氧水脱色与未脱色多糖刺激巨噬细胞的活性比较
猴头菌多糖经双氧水脱色后体外刺激巨噬细胞的活性较未脱色猴头多糖显著下降(图1),在P<0.05水平,每个浓度两组数据都存在显著性差异,双氧水脱色的过程可能会通过氧化破坏多糖的活性基团,从而使多糖活性下降。
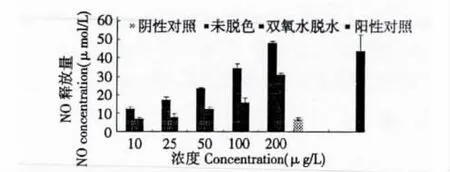
图1 双氧水脱色与未脱色多糖体外刺激巨噬细胞能力的比较Fig.1 Comparison of effects of activating macrophages of polysaccharide before and after H2O2decolorization
2.1.3 大孔树脂脱色前后刺激巨噬细胞的活性比较
大孔树脂D315脱色后活性较未脱色样品显著增强(图2),大孔树脂D315在低浓度组和高浓度组与未脱色样品均存在显著性差异(P<0.05),而D303在每个浓度组与未脱色样品无显著性差异,表明D303脱色后多糖活性无显著性变化。大孔树脂脱色主要是通过吸附和离子交换作用,而作为免疫调节剂的多糖大多属于大分子弱极性,不容易被树脂吸附,所以脱色后的多糖活性不会降低。
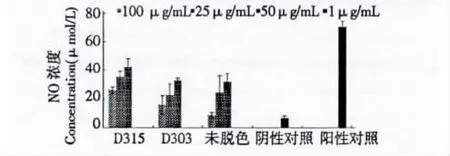
图2 树脂脱色与未脱色多糖体外刺激巨噬细胞能力的比较Fig.2 Comparison of effects of activating macrophages of polysaccharide before and after resin decolorization
脱色前后猴头菌多糖脱色率、多糖保留率及体外免疫活性的分析结果表明,大孔树脂法的脱色率远高于活性炭法,高浓度的双氧水可以达到与大孔树脂相当的水平,但其脱色多糖的免疫活性显著降低,而大孔树脂脱色后多糖的体外免疫活性无降低,故大孔树脂更适用于猴头菌多糖的脱色。
2.2 十种大孔树脂的筛选
2.2.1 十种大孔树脂对脱色率和多糖保留率的影响
由表2可以看出 HZ202、JK206、D303、脱色一号四种树脂的脱色率较高,多糖保留率较低,而335、D315具有较高的多糖保留率,综合考虑脱色率和多糖保留率,挑选 HZ202、JK206、335、D315、D303、脱色一号等六种树脂进一步筛选。
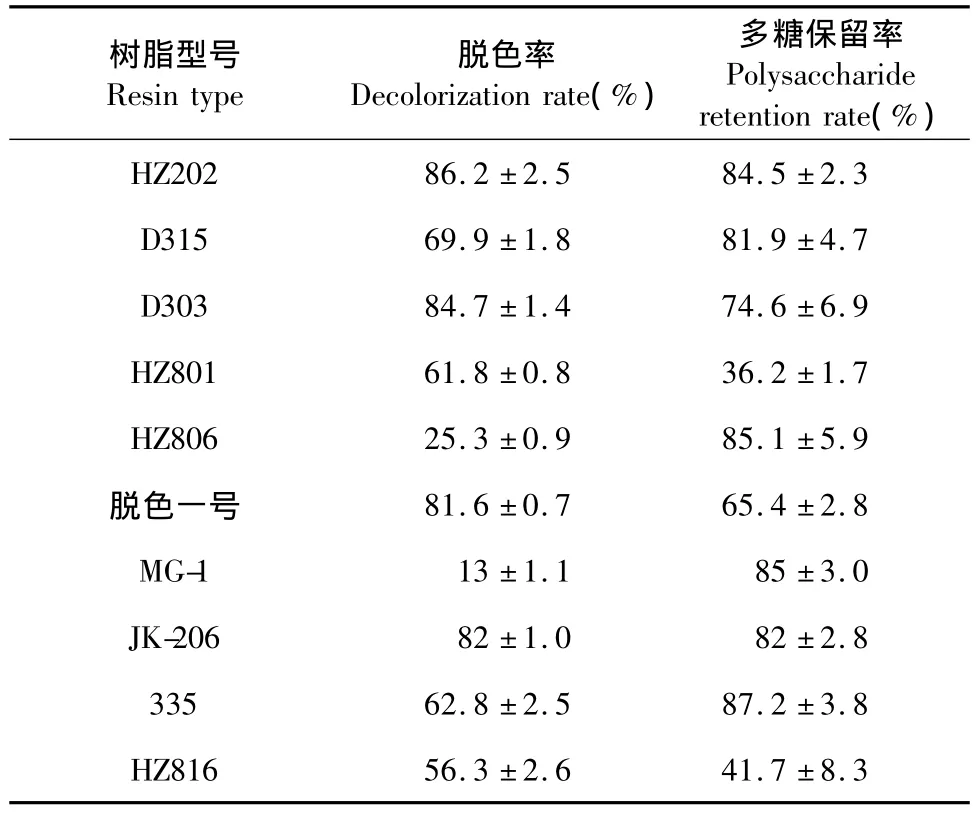
表2 十种树脂脱色效果的比较Table 2 Comparison of decolorization results of polysaccharide using ten types of resins
2.2.2 样品刺激巨噬细胞产生NO的作用
由图3可知D315脱色后的多糖活性最好,其次是335、D303、脱色一号,再次是HZ202;JK206脱色后的多糖活性远低于前面的五种树脂脱色后的多糖,且与D315、335、D303、脱色一号、HZ202,脱色后的多糖间存在显著性差异(P<0.05)。
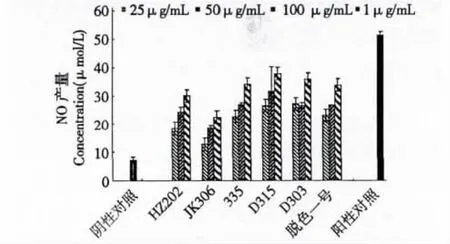
图3 不同树脂脱色的多糖对体外刺激巨噬细胞能力的影响Fig.3 Comparison of effects of activating macrophages of polysaccharide before and after decolorization with six types of resin
2.2.3 样品刺激小鼠脾淋巴细胞增殖的作用
由图4可知,经大孔树脂335、D315、D303、脱色一号脱色后的多糖活性较好。335在中浓度时,活性最好,高浓度活性下降;D315活性随浓度升高而升高;D303三个浓度的活性相当,而脱色一号中浓度活性好,低浓度和高浓度时都较中浓度低。样品中可能存在两类物质,一类是促进小鼠脾淋巴细胞增殖的,另一类是抑制小鼠脾淋巴细胞增殖的,经过脱色过程可能会去除一些抑制性成份,试验结果中表现出的活性可能是两者平衡的结果。
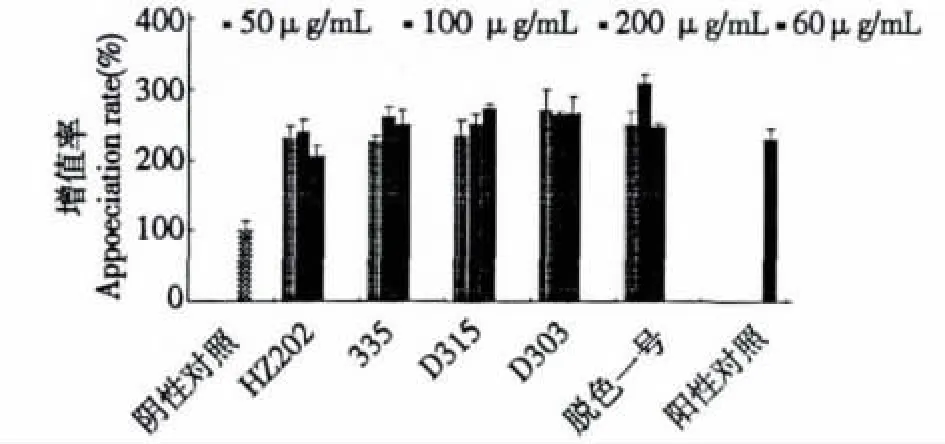
图4 不同树脂脱色后的多糖刺激小鼠淋巴细胞增殖能力的比较Fig.4 Comparison of the effects of proliferation of mouse spleen lymphocyte by polysaccharide after decolorization with five types of resin
从巨噬细胞产生NO的作用和小鼠脾淋巴细胞刺激实验的结果来看,经大孔树脂335、D315、D303、脱色一号脱色后的多糖都具有较好的活性,且D315表现出良好的浓度依赖性,其它三种树脂脱色后多糖在刺激小鼠脾淋巴细胞增殖的实验中都有高浓度抑制出现(高浓度活性低于低浓度),可能经树脂脱色后,有一些抑制活性的成份残留,查阅有关文献[9]发现D315在柠檬酸的生产中已应用多年,安全性上要好于其它树脂。
3 结论
对脱色剂的选择应综合考虑脱色效果与多糖损失,选择脱色剂的种类不仅要从脱色效果的角度考虑,也要从多糖分离后的用途考虑。如果后续工作是单独的生化研究,则重在考虑脱色效果,而如果分离后的用途主要为多糖的生物活性的应用,则重在考虑减少多糖的损失,作适当脱色即可[10]。据此原则,树脂脱色法脱色率较高,脱色多糖生物活性较好,故选择树脂脱色法进行猴头菌多糖的脱色;树脂型号众多,不同树脂吸附色素、蛋白及多糖的能力存在差异,所以脱色后粗多糖的成份各不相同,最终导致脱色率、多糖保留率及生物活性的差异,对十种树脂进行筛选,发现D315树脂的多糖保留率较高,加之生物活性及安全性较好,因此大孔弱碱性阴离子树脂D315较适合用于猴头菌粗多糖的脱色。
1 Zhang H(张亨).Progress in research of adsorbent decolorization.Mod Chem Ind(现代化工),1998,7:13-15.
2 Zhang H(张亨).Progress in research of chemical decolorization.Mod Chem Ind(现代化工),1999,19(9):15-18.
3 He BL(何炳林),Shi ZQ(史作清).The structure and properties of macroporous ion exchange resins and new type of adsorbents.Polymer Bull(高分子通报),2005,4:13-18.
4 Shang P(商澎),Mei QB(梅其炳),Cao ZX(曹之宪),et al.Analysis of Angelica polysaccharides constituents by highperformance liquid chromatography.Chin Pharm J(中国药学杂志),2000,35:332-335.
5 Yuan HB(袁红波),Zhang JS(张劲松),Jia W(贾薇),et al.Study on decoloration of the low molecular weight Gonoderma Lucidum polysaccharides by resin.Sci Tech Food Ind(食品工业科技),2009,3:204-206.
6 Zhu MJ(朱美静).Studies on the extraction and physicochemical characters of Hericium erinaceus polysaccharides.Wuxi:Jiangnan University,MSc.2006.
7 Qiao YR(乔艳茹),Luo YH(罗永煌),Zhou S(周帅),et al.Isolation and purification of GFP75-2-2B,a polysaccharide from Grifola frondosa fruit bodies,and its effect on nitric oxide release from macrophages.Acta Edulis Fungi(食用菌学报),2010,17(4):48-51.
8 Li ZY(李赞阳),Liu H(刘红),Li BQ(李炳奇),et al.Effect of compound Chinese herb polysaccharides with different component and purity on the proliferation of splenic lymphocytes in mice.J Tradit Chin Veterin Med(中兽医医药杂志),2011,2:5-7.
9 Liu ZZ(刘坐镇),Jiang BH(江邦和),Xu JG(徐建刚),et al.Study on the application of D315 weak-base ion-exchange resin in citric acid purification.Shanghai Chem Ind(上海化工),24(21):15-17.
10 Zhu YX(朱越雄),Sun HY(孙海一),Cao GL(曹广力).The comparative study on decoloration efficiency of polysaccharide from wildness Pleurotus Ostrcatus.Chin J Spectro Lab(光谱实验室),2005,2:1070-1073.

