依达拉奉注射液细菌内毒素检查的质量标准研究
许雷鸣 顾 倩 武 谷
1.安徽省食品药品检验所,安徽合肥 230051;2.皖南医学院,安徽芜湖 241000
依达拉奉是一种脑保护剂(自由基清除剂),可清除自由基,抑制脂质过氧化,从而抑制脑细胞、血管内皮细胞、神经细胞的氧化损伤。临床上用于改善急性脑梗死所致的神经症状、日常生活活动能力和功能障碍。目前,关于依达拉奉注射液的细菌内毒素检查限值不统一。国家食品药品监督管理局标准YBH28302005 中细菌内毒素检查限值为:每毫克依达拉奉中含内毒素的量应小于2.0 EU;国家食品药品监督管理局标准YBH01602008 中细菌内毒素检查限值为:每毫升中含内毒素量应小于0.5 EU;国家食品药品监督管理局标准YBH10412008 中细菌内毒素检查限值为:每毫克依达拉奉中含内毒素的量应小于3.33 EU;国家食品药品监督管理局标准YBH00372011 中细菌内毒素检查限值为:每毫克依达拉奉中含细菌内毒素的量应小于2.5 EU。查阅国外药典,未见收载该品种。本实验参照依达拉奉注射液现行标准,《中国药典》2010年版二部“细菌内毒素检查法”[1]以及相关细菌内毒素检查的文献[2-10],考察了5个厂家的产品,研究本品对细菌内毒素检查试验的干扰情况,探讨提高本品细菌内毒素限值的可行性,在实验基础上统一细菌内毒素检查质量标准。
1 仪器与试药
1.1 仪器
洁净工作台,苏净集团苏州安泰空气技术有限公司,VS-1300L-U;S648 恒温水浴锅(上海医疗器械七厂),XW-80A 混旋仪(上海沪西分析仪器厂有限公司),微量取液器(50~250 μL,上海荣泰生化工程有限公司),细菌内毒素检查用具(湛江博康海洋生物有限公司)。
1.2 试药
依达拉奉注射液,吉林省博大制药有限责任公司,批号:01-110904、01-110906,规格:20 mL∶30 mg。批号:02-110816、02-111108,规格:10 mL∶15 mg。吉林省辉南长龙生化药业股份有限公司,批号:2012041101,规格:20 mL∶30 mg。扬州制药有限公司,批号:20120601,规格:20 mL∶30 mg。国药集团国瑞药业有限公司,批号:1204068、1204069、1204071,规格:20 mL∶30 mg。安徽威尔曼制药有限公司,批号:120423、120424、120515,规格:20 mL∶30 mg。
鲎试剂 (福州新北生化工业有限公司,批号:12070312,灵敏度:0.06 EU/mL;规格:0.1 mL/支。 湛江安度斯生物有限公司,批号:1211081,灵敏度:0.06 EU/mL;规格:0.1 mL/支);细菌内毒素工作标准品(冻干品)(中国食品药品检定研究院,效价:120 EU/支,批号:150601-201072)。细菌内毒素检查用水(福州新北生化工业有限公司,批号:11102021,规格:100 mL/瓶)。
2 方法与结果
2.1 鲎试剂灵敏度复核试验
将细菌内毒素工作标准品用细菌内毒素检查用水溶解, 配制成 2λ、1λ、0.5λ、0.25λ 四个浓度的内毒素标准溶液,按照细菌内毒素检查法进行加样操作[1-2]。每种内毒素浓度分别平行做4 管,同时用细菌内毒素检查用水作阴性对照做 2 管。按公式 λc=antilg(ΣX/4)计算 λc值,结果见表1。由结果可知,2λ管均为阳性,0.25λ均为阴性,阴性对照管为阴性,试验有效。两个不同厂家的2 批鲎试剂灵敏度测定值均在0.5λ~2.0λ范围内,符合要求,可用于细菌内毒素检查,并以标示灵敏度λ为该批鲎试剂的灵敏度。

表1 鲎试剂灵敏度复核结果
2.2 内毒素限值(L)的确定[2-3]
参照上述4个国家标准,采用国内现行标准最严的限度:每毫升中含内毒素量应小于0.5 EU。由于本品20 mL相当于30 mg,并且其临床剂量以每公斤体重(mg)计,故将依达拉奉注射液细菌内毒素检查限值定为:每毫克依达拉奉中含内毒素的量应小于0.33 EU。
2.3 干扰试验预试验
目前市售鲎试剂λ通常在0.50~0.03 EU/mL,根据公式MVD=C×L/λ,则依达拉奉注射液对应的最大有效稀释倍数分别为 1、2、4、8、16 倍。取规格为 20 mL∶30 mg 的样品,每个厂家各取一批,将5个厂家的依达拉奉注射液用细菌内毒素检查用水分别配制成为原液、2、4、8、16倍稀释液,将此系列溶液记为NPC。同法制备上述系列溶液,向其中加入内毒素标准溶液,使每一浓度的溶液中均含有2λ浓度的细菌内毒素,此系列溶液记为PPC。取福州新北生化工业有限公司和湛江安度斯生物有限公司生产的鲎试剂,分别与上述NPC 和PPC 进行反应,每一浓度重复做2管,同时设阳性对照(PC)和阴性对照(NC),干扰预试验结果见表2。预试结果显示,样品在8倍以下稀释倍数时可能对反应有抑制性干扰作用;样品的8倍以上稀释倍数可能对反应无干扰作用。
2.4 干扰试验
取上述干扰预试验的依达拉奉注射液用细菌内毒素检查用水分别进行稀释,使其正式干扰试验稀释倍数为8倍,按《中国药典》2010年版二部附录Ⅺ E“细菌内毒素检查法”凝胶法干扰试验项进行试验[1],结果见表3。正式干扰试验结果表明,采用福州新北生化工业有限公司和湛江安度斯生物有限公司生产的灵敏度均为0.06 EU/mL的鲎试剂进行试验,Es均在0.5λ~2.0λ内且Et/Es均在0.5~2.0 之间,确认5个厂家的上述样品稀释8倍后对细菌内毒素检查均无干扰,即依达拉奉注射液最大不干扰浓度为0.187 5 mg/mL。
2.5 样品细菌内毒素检查
根据干扰试验结果,取5个厂家12 批样品用细菌内毒素检查用水稀释8倍,分别用两个不同厂家灵敏度为0.06 EU/mL的鲎试剂,以每毫克小于0.33 EU 为细菌内毒素检查限值,按照《中国药典》2010年版二部附录Ⅺ E“细菌内毒素检查法”凝胶限度试验对样品进行细菌内毒素检查[1],结果见表4。结果显示,本实验成立,供试品管呈阴性,12 批样品均符合规定。
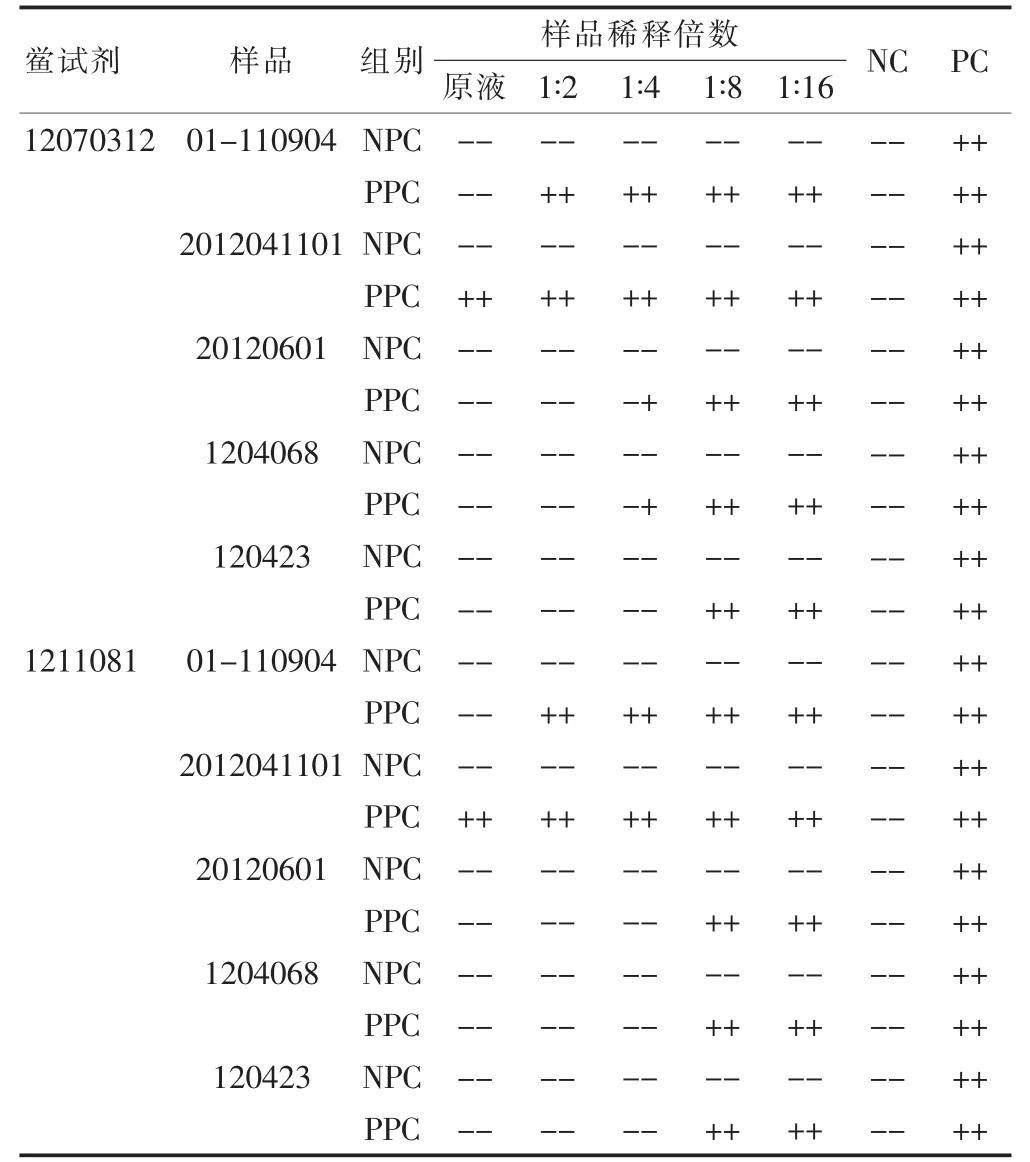
表2 依达拉奉注射液干扰试验预试结果

表3 依达拉奉注射液干扰试验结果
3 讨论
为了统一依达拉奉注射液细菌内毒素检查限值,提高检验标准,笔者参照依达拉奉注射液现行国家标准,拟定细菌内毒素检查限值为0.33 EU/mg,采用2个不同厂家的鲎试剂对5个不同厂家的依达拉奉注射液进行了细菌内毒素检查干扰试验研究,并按该限值检查了5个厂家生产的12 批依达拉奉注射液的细菌内毒素量。干扰实验表明,依达拉奉注射液部分产品在较高浓度时对细菌内毒素检查有一定的干扰,在0.187 5 mg/mL 以下浓度时对细菌内毒素检查均无干扰。检查结果表明,5个厂家生产的12 批样品细菌内毒素量均小于0.33 EU/mg,符合拟定的质量标准。说明各个厂家按照目前的生产工艺和水平可以满足拟定的限值要求,统一后的标准可行。统一后的依达拉奉注射液的细菌内毒素检查方法如下:取本品,可用0.06 EU/mL以上的高灵敏度鲎试剂,依法检查(《中国药典》2010年版二部附录ⅪE),每毫克依达拉奉中含内毒素的量应小于0.33 EU。本试验将限值统一为0.33 EU/mg,提高了检验标准,有利于更好地控制药品质量,更好地保障用药安全。
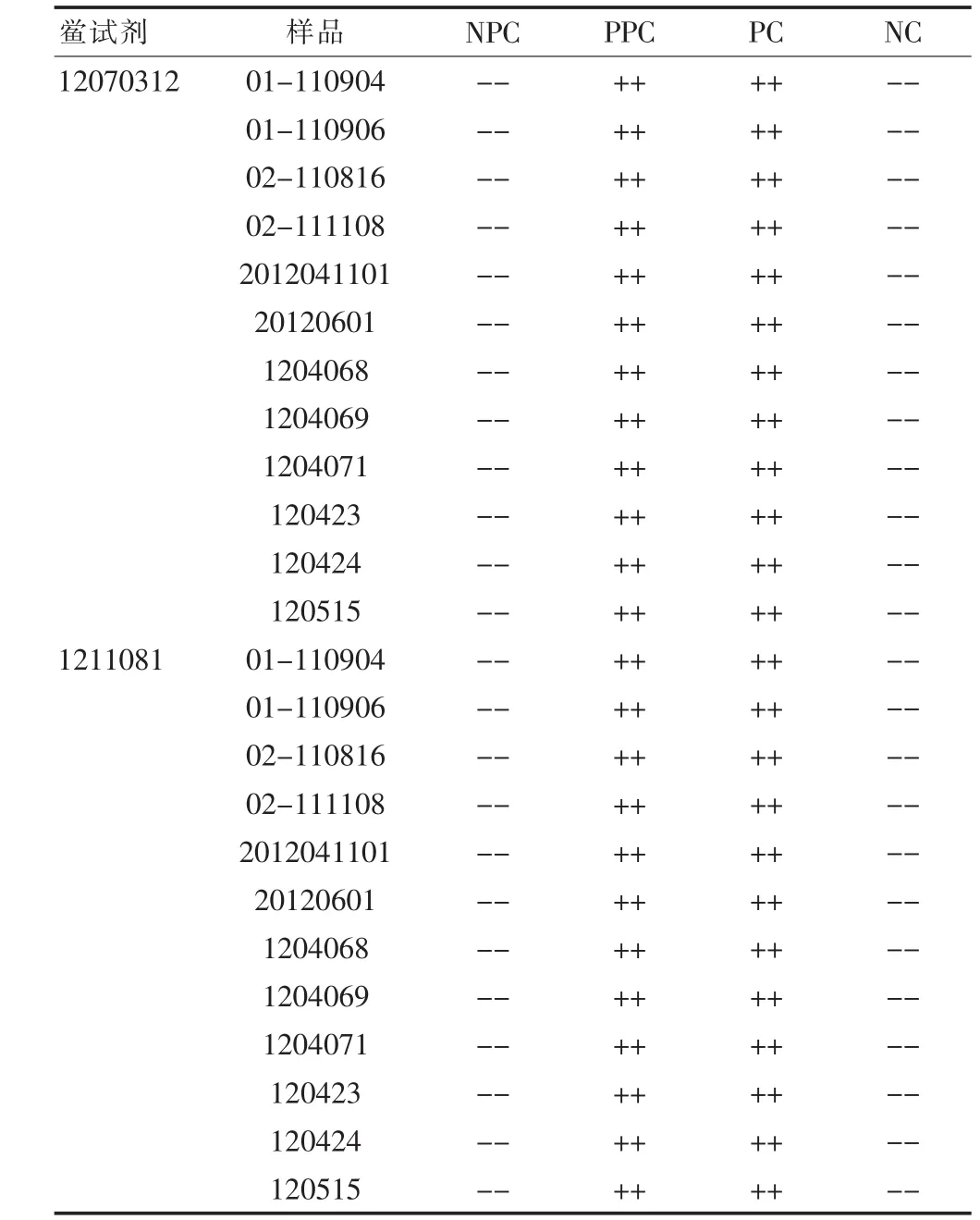
表4 依达拉奉注射液细菌内毒素检查结果
[1]国家药典委员会.中国药典[S].二部.北京:中国医药科技出版社,2010:附录 99-101.
[2]中国药品生物制品检定所.中国药品检验标准操作规范[M].北京:中国医药科技出版社,2010:310-325.
[3]肖贵南,孙清萍,盛英美.如何建立新药的细菌内毒素检查方法[J].中国医药导报,2011,8(32):159-162.
[4]刘雪莉,张敏,陈汝红,等.苄星青霉素细菌内毒素检查法的标准修订[J].中国医药导报,2012,9(10):141-142.
[5]祝清芬,国明,魏霞,等.米力农注射液细菌内毒素检查法标准修订[J].中国药事,2012,26(5):456-458.
[6]陈琪.注射用双嘧达莫细菌内毒素检查法研究[J].中国医药导报,2012,9(12):31-32.
[7]陈琪.注射用法莫替丁细菌内毒素检查法研究[J].中国医药导报,2011,8(35):31-33.
[8]刘骅.注射用维生素B6 细菌内毒素检查法的研究[J].中国现代应用药学,2012,29(3):267-270.
[9]张德波.布洛芬细菌内毒素检查法研究[J].中国现代应用药学,2012,29(3):261-264.
[10]程春雷,高天勤,曹珍艳.注射用盐酸丙帕他莫的细菌内毒素检查[J].中国医药工业杂志,2011,42(3):219-221.

