胆碱能抗炎通路:缺血性脑卒中炎症反应的可能调节机制
刘晓洁 梅志刚 王明智 曾永保
(三峡大学医学院国家中医药管理局中药药理科研三级实验室,湖北 宜昌 443002)
我国每年有150万~200万新发脑卒中的病例,校正年龄后的脑卒中年发病率为(116~219)/10万人口,年死亡率为(58~142)/10万人口,现存脑血管病患者700余万人,其中约有70%为缺血性脑卒中〔1〕。越来越多的研究资料显示〔2,3〕,炎症反应作为缺血性脑卒中病理过程的重要组成部分,贯穿了病理发展的始终,是导致神经损伤的主要原因之一;抗炎治疗能使脑梗死的治疗时间窗延长,为进一步康复治疗赢得宝贵时机。胆碱能抗炎通路(CAP)是新近发现的一种神经免疫调节机制〔4〕,该通路由迷走神经介导,能快速、持续地抑制炎症因子的释放,减轻或调节炎症反应,CAP的发现为脑缺血再灌注损伤的抗炎治疗带来了新的理论指导。本文从缺血性脑卒中与炎症的关系、CAP对炎症反应的调节及其在缺血性脑卒中的应用前景做一综述。
1 缺血性脑卒中与炎症反应
缺血性脑卒中是由于脑动脉管腔狭窄或阻塞,局部脑血流量减少或突然中断,造成该动脉供应区的脑组织供血、供氧功能减少或消失,继而引起继发性的血管内皮损伤和自主神经功能障碍的一种病理状态。脑缺血后的炎症反应主要表现为外周血白细胞在脑实质内浸润和内源性小胶质细胞激活。研究表明,在脑梗死的超早期或早期,神经元死亡的同时,缺血和再灌注可导致氧自由基的增加和神经元的坏死等,触发一系列炎症级联反应,促进局部炎性细胞因子和趋化因子过度分泌,如白细胞介素(IL)和肿瘤坏死因子α(TNF-α)等释放,脑血管壁上黏附分子如细胞间黏附分子(ICAM)表达上调,使白细胞被吸引至血管内皮而浸润脑实质内部并聚集于缺血区,从而激活下游的次级炎症反应,形成恶性循环〔5~7〕。同时,在脑缺血早期2~4 h后,小胶质细胞被上述炎性细胞因子等激活,多数研究认为激活的小胶质细胞进一步加重了脑损伤〔8〕。
炎症因子是一组由淋巴细胞、单核巨噬细胞和血管内皮细胞产生的免疫活性分子。当缺血损伤时,促炎因子如IL-1、IL-6、TNF-α和抗炎因子如IL-10等被大量释放,共同参与机体的应激反应和炎症调控。IL-1主要分为IL-1α和IL-1β两种,其中IL-1β在脑卒中过程中的作用尤为重要,它能加重脑损伤,诱发神经细胞凋亡,具有促使炎症反应并级联放大的作用〔9〕。动物实验表明,IL-1β在大鼠大脑中动脉缺血2 h后再灌注0~24 h内逐渐增加,且24 h后达到高峰〔10〕。IL-6是免疫神经系统中参与炎症反应的重要因子,目前许多实验都证实IL-6参与了脑卒中的炎症反应,高浓度的IL-6能使白细胞和内皮细胞的黏附性增强,在脑血肿的形成和血脑屏障的破坏等方面有着重要作用〔11〕。Huang等〔12〕发现脑缺血后 IL-1和 IL-6的升高可以促使血管内皮细胞表达ICAM-1等,介导中性粒细胞聚集于缺血区,从而导致脑组织损伤。ICAM-1是黏附分子中重要的因子之一,核因子κB(NF-κB)与ICAM-1关系密切,ICAM-1的基因上有NF-κB结合位点,激活后的NF-κB可高效诱导ICAM-1的表达,同时 ICAM-1也是 NF-κB活化的重要刺激物之一〔13〕。TNF-α 在炎症反应中可刺激 IL-1β、IL-6 等表达,引起炎症反应级联放大;高表达的TNF-α还具有神经毒性,可加速神经细胞的死亡〔14〕。神经系统中血管内皮细胞、小胶质细胞以及神经元均可产生TNF-α。有研究发现,脑缺血后TNF-α的表达水平增高与神经元的凋亡有关,大鼠大脑中动脉阻断2 h后,TNF-α mRNA的表达升高,并在4~8 h后表达至高峰且均至少持续24 h,在梗死中心和半暗带TNF-α表达与凋亡神经元的分布具有一致性〔15〕。
2 CAP
CAP是指中枢神经系统通过胆碱能神经及其递质调节或抑制炎症产生的通路。炎症刺激信号可由传入迷走神经投射到大脑孤束核(NTS),通过中枢毒蕈碱乙酰胆碱受体(mAChR)的信号传导机制,经迷走神经运动背核(DMN)兴奋传出迷走神经,刺激神经末梢释放乙酰胆碱(Ach)并作用于免疫细胞上的α7烟碱型乙酰胆碱受体(α7nAChR),通过NF-κB和蛋白酪氨酸激酶2/信号转导子与转录激活子3(JAK2/STAT3)信号通路达到抑制细胞因子和趋化因子的产生与释放等作用。
2.1 α7nAchR的结构和分布 α7nAchR是烟碱型胆碱能受体的一员,为5个α7亚基构成的同源聚合体,属于配体门控离子通道。研究发现,α7nAchR在CAP中处于核心地位〔16〕。最初α7nAchR是在神经元细胞上被发现的,随着迷走神经抗炎通路的提出,巨噬细胞和全身其他很多非神经元细胞(如淋巴细胞、树突细胞、中性粒细胞、小胶质细胞、上皮细胞、内皮细胞等)表面也发现了α7nAchR〔17〕,而且这些细胞表面的 α7nAchR均可直接参与抗炎作用。
2.2 胆碱能抗炎的信号转导通路 胆碱能刺激调控炎性细胞因子生成的胞内信号转导机制目前还不十分清楚,多数认为抑制NF-κB信号通路和激活JAK2/STAT3信号通路是其两种主要机制〔18〕,见图 1。
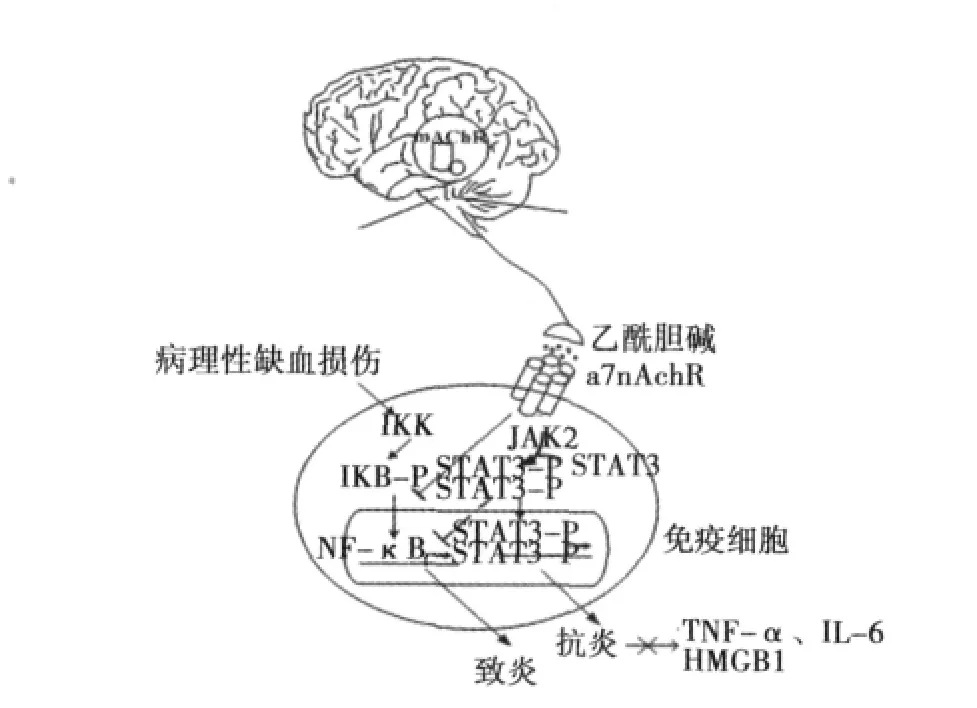
图1 CAP信号转导机制示意图
NF-κB是促炎因子的转录因子,是由p65和p50构成的同源或异源二聚体。通常情况下,在细胞质中的NF-κB处于失活状态,与抑制蛋白IkB(inhibitory protein of NF-κB)结合成三聚体复合物。未磷酸化的IκB是NF-κB的抑制因子,可抑制NF-κB p65/p50的核转位。炎症反应过程中,炎症因子可激活核因子κB抑制蛋白激酶(IKK),使IκB分子磷酸化,NF-κB发生核转位继而与靶基因上的启动子或增强子的κB结合位点结合,启动一系列炎症反应相关基因的转录程序,诱导更多的炎症因子如:ICAM-1、TNF-α、IL-1等高度表达。刺激迷走神经或以胆碱能激动剂激活α7nAchR,可抑制IKK的活性,阻止IκB被磷酸化,从而抑制NF-κB p65/p50的核转位,抑制炎症因子的产生〔17,19〕。
JAK2/STAT3通路是抑制促炎因子产生的另一主要机制,它主要由三个成分组成,即酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT。酪氨酸激酶相关受体本身不具有激酶活性,但胞内具有酪氨酸激酶 JAK的结合位点。激活α7nAChR可触发细胞内结构域的催化活性,募集具有酪氨酸激酶活性的JAK2并使其磷酸化,继而激活下游的转录因子STAT3。活化的STAT蛋白以二聚体的形式进入细胞核内与靶基因结合,调控基因的转录,抑制炎症反应;同时其可以与NF-κB竞争性结合到DNA上,减少TNF-α和IL-6以及高迁移率族蛋白1(HMGB1)等促炎因子的产生〔20〕。
3 缺血性脑卒中抗炎治疗及其可能机制
3.1 电刺激迷走神经 目前迷走神经刺激术已被广泛运用于基础研究或临床治疗中〔4〕,Ay等〔21〕发现,分别电刺激左侧与右侧颈部迷走神经均可使急性脑缺血梗死面积明显减少高达50%左右,并且显著恢复神经功能评分。进一步深入研究后他们排除了电刺激迷走神经是通过改变脑血流量发挥脑保护作用的可能〔22〕。Zheng等〔23〕得出了同样的研究结果,他们实验还发现电刺激迷走神经可减少持久性(permanent)脑缺血梗死面积达38.4%并发挥神经保护作用。据此,上述研究者们认为电刺激迷走神经对脑缺血的脑保护作用可能与抑制了炎症因子过度释放有关,而通过何种途径实现尚不得而知。此外,Bernik等〔24〕观察到电刺激迷走神经能减轻主动脉阻断后再灌注损伤所导致的全血TNF-α升高,抑制心脏和肝脏TNF-α生成,缓解缺血再灌注引起的休克。而在其他多种炎症大鼠模型中(缺血再灌注、出血性休克、脓毒症等),通过刺激迷走神经激活CAP均发现可减少因组织损伤而引起的全身或局部的炎症反应〔18〕。
3.2 穴位针刺 传统的针刺疗法在防治脑缺血炎症反应方面临床疗效显著。研究显示,针刺可显著降低脑缺血区的IL-1、TNF-α、ICAM-1 mRNA和蛋白表达,发挥抑制炎症反应和脑保护作用〔25,26〕。在大鼠脑缺血再灌注模型中,孔立红等〔27〕采用电针“大椎”、双侧“内关”穴,发现其能降低脑缺血再灌注后TNF-α含量,下调NF-κB表达,减轻有害信号转导对神经细胞的损害。霍则军等〔28〕发现针刺“后顶”和双侧的“足三里”、“曲池”穴,能降低白细胞数量和血清中TNF-α、IL-6水平,抑制缺血再灌注后的炎症反应。赵瑛等〔29〕也发现频率2/15 Hz,强度1 mA的疏密波电针刺激“曲池”、“足三里”穴后能显著降低诱导型一氧化氮合成酶活性和基质金属蛋白酶-9含量,减轻脑缺血大鼠的炎症反应和血管损伤。此外,研究还发现电针刺足三里对内毒素血症大鼠模型亦具有很好的抗炎效应,但在双侧迷走神经切断或α银环蛇毒素阻断α7nAChR的情况下,电针则失去了抗炎作用〔26〕。Oke等〔30〕认为针刺这种抑制炎症的作用可能与兴奋迷走神经的有关。
3.3 α7nAChR激动剂 尼古丁是一种常见的α7nAChR受体激动剂,烟草中的尼古丁曾被认为是脑卒中的诱发因素之一。可有趣的是,临床试验基本证实了尼古丁及其代谢产物作用于α7nAChR,可明显降低内毒素对人体的损伤,使血清中的IL-10含量升高,并抑制TNF释放减轻炎症反应〔31,32〕。但尼古丁不仅作用于α7nAChR,还广泛作用于其他烟碱受体,因此其副作用很大,这使得临床上使用尼古丁治疗炎症反应几乎没有优势。而〔3H〕A-585539〔33〕为选择性 α7nAChR 激动剂,具有很强的血脑屏障通透能力,进入大脑后可选择性地与α7nAChR结合治疗神经变性等疾病。另一种α7nAChR激动剂CNI-1493是一个四价鸟苷腙新药,临床前实验显示CNI-1493对实验过敏性脑炎、脑卒中、内毒素休克等多种疾病动物模型的炎症反应具有抑制作用,其作用可能与激活中枢CAP有关〔34〕。
3.4 其他拟胆碱药 Kutsuna等〔35〕发现胆碱酯酶抑制剂毒扁豆碱可激活CAP,显著降低超氧阴离子基团、ICAM-1等含量,抑制大鼠脑缺血再灌注后的早期炎症反应和血管内皮损伤。Wang等〔36〕发现强效碱酯酶抑制剂石杉碱甲可有效地抑制脑血流灌注不足时TNF-α mRNA的表达并改善慢性炎症,作者认为其作用可能与CAP密切相关。另外,Lee等〔37〕发现脑室毒蕈碱注射液可降低脑组织水肿含量,降低脑和脾脏平均炎症介质水平,抑制脑卒中发病过程中的炎症反应。
4 小结与展望
综上所述,CAP作为自身控制炎症反应的神经-免疫性通路,它的发现证明了中枢神经系统可直接参与机体对炎症刺激的反应调节,是基础和临床神经与免疫领域中令人振奋的新发现。正如最早提出CAP理论学说的Tracy教授在《Nature》杂志撰文中提到的,合理性刺激迷走神经可能将是治疗炎性疾病的一个很好的治疗策略〔38〕,CAP理论的提出还可能会为传统替代疗法作用机制的研究带来全新理论视角〔30〕。
众所周知,炎症反应在脑缺血损伤中扮演了相当重要的角色,及早预防并控制脑缺血及再灌注后的炎症及其级联反应在脑卒中预防与康复治疗中显得尤为重要。较多临床资料证明,包括针刺在内的传统中医药在预防脑缺血,提高脑卒中的治愈率、降低病残率方面都有较好的疗效,且具有较好潜在优势和广阔的运用前景。然而实践中对中医中药的运用鱼目混珠,参差不齐,缺乏可行的统一标准,加之长期以来人们对中医中药抗炎护脑的潜在机制知之甚少,影响了疗效的提高和进一步推广应用,因此探寻其潜在机制,寻找理论突破口势在必行。
本课题组此前一项研究发现,在预先使用尼古丁和葛根素处理的情况下,脑缺血再灌注模型大鼠出现了神经功能损害明显减轻,海马脑组织炎症细胞浸润显著改善,促炎因子IL-1β、IL-6和TNF-α含量显著降低、抗炎因子IL-10含量明显升高等结果,但在注射α银环蛇毒素的脑缺血再灌注模型中,葛根素的这些抗炎作用消失,据此,我们推测葛根素防治脑缺血炎症反应的作用可能是与激活CAP有关〔39,40〕。此外,我们通过电针刺激耳甲区迷走神经分布区穴位“胰胆(CO11)”,在动物模型上观察到相类似的抗炎作用〔41〕。然而,中医药是如何激活CAP,其合理剂量参数和应用时机如何确定,以及抗炎信号转导机制如何等还有待深入研究。
1 中华医学会神经病学分会脑血管病学组缺血性脑卒中二级预防指南撰写组.中国缺血性脑卒中和短暂性脑缺血发作二级预防指南2010〔J〕. 中华神经科杂志,2010;43(2):154-60.
2 Tuttolomondo A,Di Sciacca R,Di Raimondo D,et al.Inflammation as a therapeutic target in acute ischemic stroke treatment〔J〕.Curr Top Med Chem,2009;9(14):1240-60.
3 Emsley HC,Smith CJ,Tyrrell PJ,et al.Inflammation in acute ischemic stroke and its relevance to stroke critical care〔J〕.Neurocrit Care,2008;9(1):125-38.
4 Tracey KJ.Physiology and immunology of the cholinergic anti-inflammatory pathway〔J〕.J Clin Invest,2007;117(2):289-96.
5 Danton GH,Dietrich WD.Inflammatory mechanisms after ischemia and stork〔J〕.J Neuropathol Exp Neurol,2003;62(2):127-37.
6 Wong CH,Crack PJ.Modulation of neuro-inflammation and vascular response by oxidative stress following cerebral ischemia-reperfusion injury〔J〕.Curr Med Chem,2008;15(1):1-14.
7 姜 红,刘广志.缺血性脑卒中与炎症〔J〕.中国神经免疫学和神经病学杂志,2009;16(3):225-8.
8 徐 虹,陈素辉,孙 华.实验性脑缺血后主要炎症相关信号的传递和作用关系〔J〕.中国康复理论与实践,2010;16(2):106-8.
9 Masada T,Hua Y,Xi G,et al.Overexpression of interleukin-1 receptor antagonist reduces brain edema induce by intracerebral hemorrhage and thrombin〔J〕.Acta Neurochir Suppl,2003;86:463-7.
10 薛 晶,冯加纯,杨艺敏,等.脑缺血再灌注后炎症和自由基作用的实验研究〔J〕.中国老年学杂志,2009;29(6):644-6.
11 吴 粤,伍联华,陈秋琴,等.急性脑出血合并全身炎症反应综合征患者血清TNF-α、IL-6动态变化的临床意义〔J〕.实用预防医学,2010;17(1):111-3.
12 Huang J,Upadhyay UM,Tamargo RJ.Inflammation in stroke and focal cerebral ischemia〔J〕.Surg Neurol,2006;66(3):232-45.
13 Goebeler M,Gillitzer R,Kilian K,et al.Multiple signaling pathways regulate NF-kappaB-dependent transcription of the monocyte chemoattractant protein-1 gene in primary endothelial cell〔J〕.Blood,2001;97(1):46-55.
14 李丹萍,易 莉,陈 强,等.针刺对脑缺血损伤级联反应和再灌注影响的研究进展〔J〕.中国康复医学杂志,2005;20(11):865-7.
15 Mao M,Hua Y,Jiang X,et al.Expression of tumor necrosis factor alpha and neuronal apoptosis in the developing rat brain after neonatal stroke〔J〕.Neurosci Lett,2006;403(3):227-32.
16 Wang H,Yu M,Ochani M,et al.Nicotinic acetylcholine receptor alpha7 subunit is an essential regulator of inflammation〔J〕.Nature,2003;421(6921):384-8.
17 de Jonge WJ,Ulloa L.The alpha7 nicotinic acetylcholine receptor as a pharmacological target for inflammation〔J〕.Br J Pharmacol,2007;151(7):915-29.
18 Rosas-Ballina M,Tracey KJ.Cholinergic control of inflammation〔J〕.J Intern Med,2009;265(6):663-79.
19 Yoshikawa H,Kurokawa M,Ozaki N,et al.Nicotine inhibits the production of proinflammatory mediators in human monocytes by suppression〔J〕.Clin Exp Immunol,2006;146(1):116-23.
20 Grivennikov SI,Karin M.Dangerous liaisons:STAT3 and NF-kappaB collaboration and crosstalk in cancer〔J〕.Cytokine Growth Factor Rev,2010;21(1):11-9.
21 Ay I,Lu J,Ay H,et al.Vagus nerve stimulation reduces infarct size in rat focal cerebral ischemia〔J〕.Neurosci Lett,2009;459(3):147-51.
22 Ay I,Sorensen AG,Ay H.Vagus nerve stimulation reduces infarct size in rat focal cerebral ischemia:an unlikely role for cerebral blood flow〔J〕.Brain Res,2011;1392:110-5.
23 Zheng HS,Baker W,Hiraki T,et al.The effect of right vagus nerve stimulation on focal cerebral ischemia:an experimental study in the rat〔J〕.Brain Stimul,2012;5(1):1-10.
24 Bernik TR,Friedman SG,Ochani M,et al.Cholinergic antiinflammatory pathway inhibition of tumor necrosis factor during ischemia reperfusion〔J〕.J Vasc Surg,2002;36(6):1231-6.
25 刘 喆,方剑乔,曾 超,等.针刺干预脑缺血损伤炎性反应的作用机制及其研究新思路〔J〕.针刺研究,2009;34(1):61-6.
26 胡 森.兴奋胆碱能抗炎通路干预炎症与缺血引起的器官损伤〔J〕. 感染、炎症、修复,2008;9(4):195-8.
27 孔立红,刘胜洪,毛娟娟,等.电针对脑缺血大鼠NF-κB及TNF-α表达的影响〔J〕.中国康复医学杂志,2009;24(8):711-4.
28 霍则军,张 莉,钱瑞琴.针刺对全脑缺血/再灌注大鼠外周血WBC和细胞因子的影响〔J〕.上海针灸杂志,2002;21(2):41-3.
29 赵 瑛,陈斯佳,于文娟,等.电针刺激对脑缺血大鼠内源性EPCs及相关血清细胞因子的影响〔J〕.生物医药工程学杂志,2010;27(6):1322-6.
30 Oke SL,Tracey KJ.The inflammatory reflex and the role of complementary and alternative medical therapies〔J〕.Ann N Y Acad Sci,2009;1172:172-80.
31 Wittebole X,Hahm S,Coyle SM,et al.Nicotine exposure alters in vivo human responses to endotoxin〔J〕.Clin Exp Immunol,2007;147(1):28-34.
32 van Assche G,Vermeire S,Rutgeerts P.Medical treatment of inflammatory bowel diseases〔J〕.Curr Opin Gastroenterol,2005;21(4):443-7.
33 Anderson DJ,Bunnelle W,Surber B,et al.〔3H〕A-585539〔(1S,4S)-2, 2-dimethyl-5-(6-phenylpyridazin-3-yl)-5-aza-2-azoniabicyclo(2.2.1)heptane〕,a novel high-affinity alpha7 neuronal nicotinic receptor agonist:radioligand binding characterization to rat and human brain〔J〕.J Pharmacol Exp Ther,2008;324(1):179-87.
34 Bernik TR,Friedman SG,Ochani M,et al.Pharmacological stimulation of the cholinergic antiinflammatory pathway〔J〕.J Exp Med,2002;195(6):781-8.
35 Kutsuna S,Tsuruta R,Fujita M,et al.Cholinergic agonist physostigmine suppresses excessive superoxide anion radical generation in blood,oxidative stress,early inflammation,and endothelial injury in rats with forebrain ischemia/reperfusion〔J〕.Brain Res,2010;1313:242-9.
36 Wang J,Zhang HY,Tang XC.Huperzine a improves chronic inflammation and cognitive decline in rats with cerebral hypoperfusion〔J〕.J Neurosci Res,2010;88(4):807-15.
37 Lee ST,Chu k,Jung KH,et al.Cholinergic anti-inflammatory pathway in intracerebral hemorrhage〔J〕.Brian Res,2010;1309:164-71.
38 Tracey KJ.The inflammatory reflex〔J〕.Nature,2002;420(6917):853-9.
39 王明智,梅志刚,曾永保,等.葛根素通过激活胆碱能抗炎通路抑制大鼠脑缺血再灌注损伤〔J〕.中国老年学杂志,2012;32(12):2563-6.
40 梅志刚,王明智,刘晓洁,等.葛根素对大鼠脑缺血再灌注损伤α7nAChR、NF-κBp65及STAT3 mRNA 表达的影响〔J〕.中华中医药杂志,2013;28(1):113-7.
41 Mei Zhi-gang,Zeng Yong-bao,Liu Xiao-jie,et al.Efficacy of auricular acupuncture on inflammatory markers and insulin resistance in type 2 diabetes model of rats:in light of cholinergic anti-inflammatory pathway〔A〕.Proceedings 2011 International Conference on Human Health and Biomedical Engineering〔C〕.Jinlin,China,2011;7:1236-41.

