蟾酥注射液的急性和亚慢性毒性研究
钟舒红,胡庭俊,郝利华,赵 晖,邓彦宏,何家康
(1.广西大学动物科学技术学院,广西 南宁530005;2.中国兽医药品监察所,北京 海淀100081;3.吉林大学畜牧兽医学院,吉林 长春130062)
蟾酥为蟾蜍科动物中华大蟾蜍(Bufobufogargarizans Cantor)或黑眶蟾蜍(Bufomelanostictus Schneider)的干燥分泌物[1],具有强心、抗肿瘤、抗疲劳、增强免疫力、镇咳等药理作用[2]。在人类医学,蟾酥主要用于防治恶性肿瘤、止痛麻醉治疗、抗感染治疗、防治白细胞减少症和治疗周围性面神经麻痹等[3]。在兽医临床,蟾酥常用于治疗猪白痢、猪破伤风、猪肺疫、猪喘气病和猪流行性感冒等[4]。蟾酥为《中华人民共和国药典》二零零零年版一部标注毒性的15味常用有毒中药之一,其中毒机理主要是蟾毒配基引起迷走神经过度兴奋,致房室传导阻滞和心率失常[5]。毒性强弱与特殊基因相关。蟾酥制剂的毒性因提取方法不同而有较大的差异[6-7]。蟾酥注射液为蟾酥经水提醇沉制备而得,主要有效成分为水溶性生物碱。本研究旨在考察蟾酥注射液的临床毒性作用,为蟾酥注射液的安全用药提供试验依据。
1 材料与方法
1.1 药品 蟾酥注射液,广西北斗星动物保健品有限公司提供,规格:10mL:蟾酥0.02g。
1.2 试验动物 Wistar大鼠,7、8周龄,雌雄各半,体重80~100g,购自吉林大学医学部实验动物中心,动物合格证号:081013006。试验期间饲喂大鼠全价颗粒料,室温控制在18℃~25℃,相对湿度为55%~65%,室内无对流风。
1.3 仪器 全自动血细胞分析仪(CELL-DYN400,美国雅培公司);Technicon全自动生化分析仪(RA-1000,美国泰尔康公司);轮转式切片机(YD-1508型,浙江金华益迪医疗设备厂);电子分析天平(BS-210S型,北京赛多利斯天平有限公司)。
1.4 急性毒性试验 选取大鼠50只,随机分为5组,每组10只,雌雄各半,用药前6h禁食不禁水。在预试基础上确定各组大鼠用药量,相邻两组间剂量的公比级数K值为1.2。1~5组大鼠用药剂量分别为70、84、101、121、145mg/kg。生理盐水将药液稀释至合适的浓度并按10mL/kg体重的剂量腹腔注射。
1.5 亚慢性毒性试验 大鼠买回后适应性饲养1周,选用体重为80~100g的大鼠120只,称重随机分为4组,每组30只,雌雄各半。第1~3组为试验组,即 高 剂 量 组 (1/10LD50)、中 剂 量 组 (1/20 LD50)、低剂量组(1/40LD50),第4组为空白对照组。每天同一时间腹腔注射蟾酥注射液(10mL/kg体重),对照组给予相同体积的生理盐水,连续给药4周,再饲养2周作为恢复期,各组均采用相同的饲养管理方式。检测指标:(1)血常规及血清生化指标。试验的28d,各组以断头处死20只大鼠,全血作血常规检验,血清作生化指标检验。(2)脏器系数:肉眼观察各组组织脏器的病变后,称取主要脏器心脏、肝脏、肾脏、肺脏、脾脏、睾丸的湿重,根据脏器系数=脏器湿重×100/体重,计算各脏器的脏器系数。(3)病理组织学观察:取高、中、低剂量组动物的各内脏器官,以甲醛固定,作组织切片,观察病理组织学变化。
1.6 数据统计分析 大鼠增重、血常规指标、血清生化指标、脏器系数均用单因子方差分析检验各组的差异性,并借助统计分析软件SPSS 16.0来完成。
2 结果
2.1 急性毒性试验 高剂量组动物出现的中毒症状主要表现为精神抑郁、很快进入麻醉状态,无前期兴奋,呼吸加深随后逐渐减慢,伏卧不起,直至死亡。剖检死亡大鼠各脏器,肝脏出现少量淤血、坏死点,肠系膜充血,其他被检脏器如心、脾、肺和肾未见异常。病理组织学检查发现,肝脏中央静脉有轻微充血,而肝索和静脉窦正常,肝细胞无异常变化。心脏、肾脏和肺脏等均未见明显病理变化。见表1和表2。
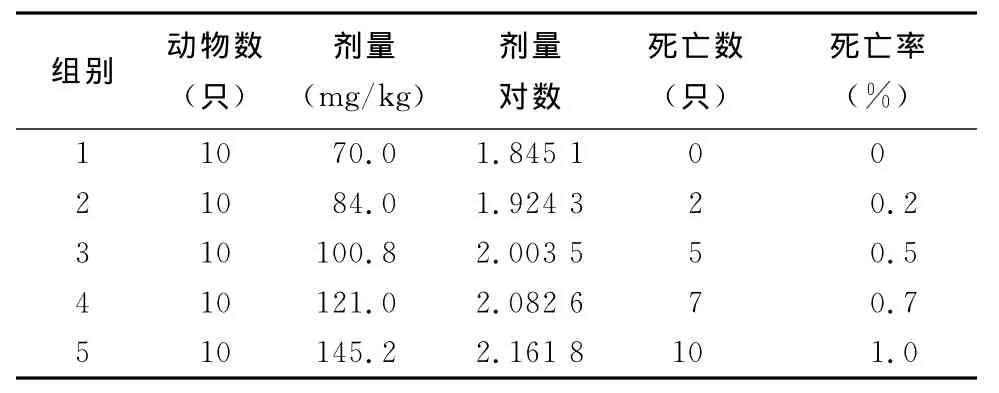
表1 蟾酥注射液经大鼠腹腔给药LD50剂量对数
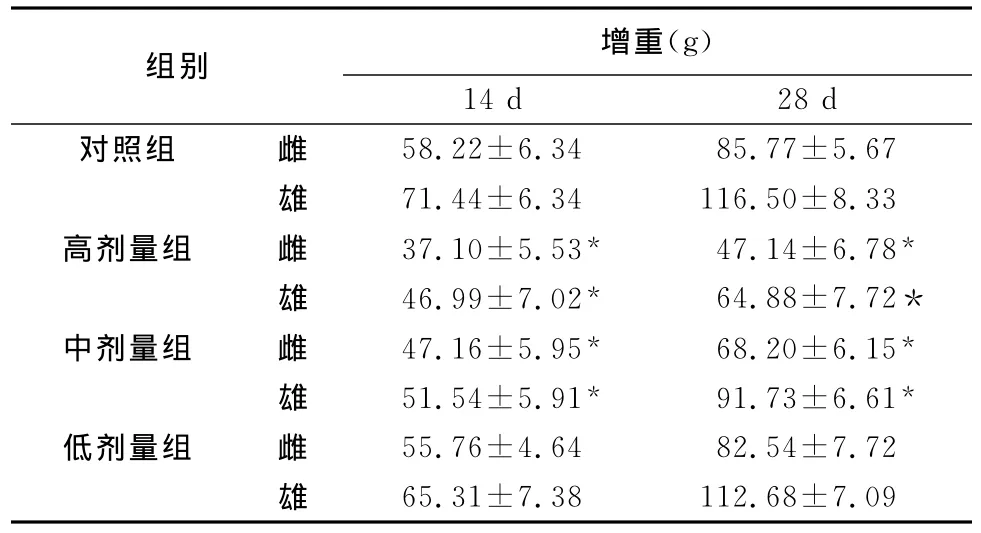
表2 蟾酥注射液对大鼠增重的影响(Mean±SD,n=30)
从表1可以看出,蟾酥注射液经腹腔给药,其LD50为102.65mg/kg,LD50的95% 的可信限为93.92mg/kg~112.21mg/kg。
2.2 亚慢性毒性试验
2.2.1 日常观察与增重情况 低剂量组大鼠在4周的给药期间,活动正常、毛发光润、摄食,饮水、粪便均正常,未发现中毒症状,动物无一死亡。高、中剂量组在长期连续给药4周后,部分大鼠出现中毒典型症状表现,如食欲不振、毛色晦暗、无光泽、精神委顿、粪便不成形等,在整个试验期间也未出现大鼠死亡。染毒后第14天和第21天,高、中剂量组增重与对照组比较差异有显著意义(P<0.05),低剂量组与对照组比较差异不显著(P>0.05),结果见表2。
2.2.2 血常规检查 高、中剂量组 WBC显著高于对照组(P<0.05);高剂量组大鼠PLT与对照组比较差异显著(P<0.05),其他各组 WBC、红细胞(RBC)和PLT值等指标与对照组比较均无显著性差距(P>0.05),见表3。
2.2.3 血清生化指标检查大鼠高、中、低剂量组ALB与对照组比较有显著性差异(P<0.05);高、中剂量组总胆红素(T-BIL)、尿素氮(BUN)、肌 酐(CREA)、胆固醇(CHOL)、甘油三酯(TG)与对照组比较差异显著(P<0.05)。有关恢复期,除了高剂量组的BUN、CREA与对照组差异有显著外,高剂量组的其他指标以及中、低剂量组的各项指标与对照组比较差异不显著(P>0.05),结果见表4和表5。
2.2.4 脏器指数 停药时,高、中剂量组雌、雄大鼠的肝脏系数比对照组大,并有显著性差异(P<0.05);高剂量组雌、雄大鼠的脾脏系数、高剂量组雌性大鼠的子宫系数以及高、中剂量组雌、雄大鼠的肾脏系数均比对照组小,并有显著性差异(P<0.05);其他均无显著性差异(P>0.05),结果见表6。恢复2周后,高剂量组的肝脏系数比对照组大、肾脏系数比对照组小,并有显著性差异(P<0.05),结果见表7。说明蟾酥注射液高、中剂量下可使肝脏肿大、肾脏萎缩,高剂量下可使脾脏和雌性动物的子宫萎缩。恢复期后中剂量组动物各脏器系数与对照组比较无显著性差异,说明上述副作用停药后可恢复,而高剂量组停药后肝、肾功能的恢复不佳。
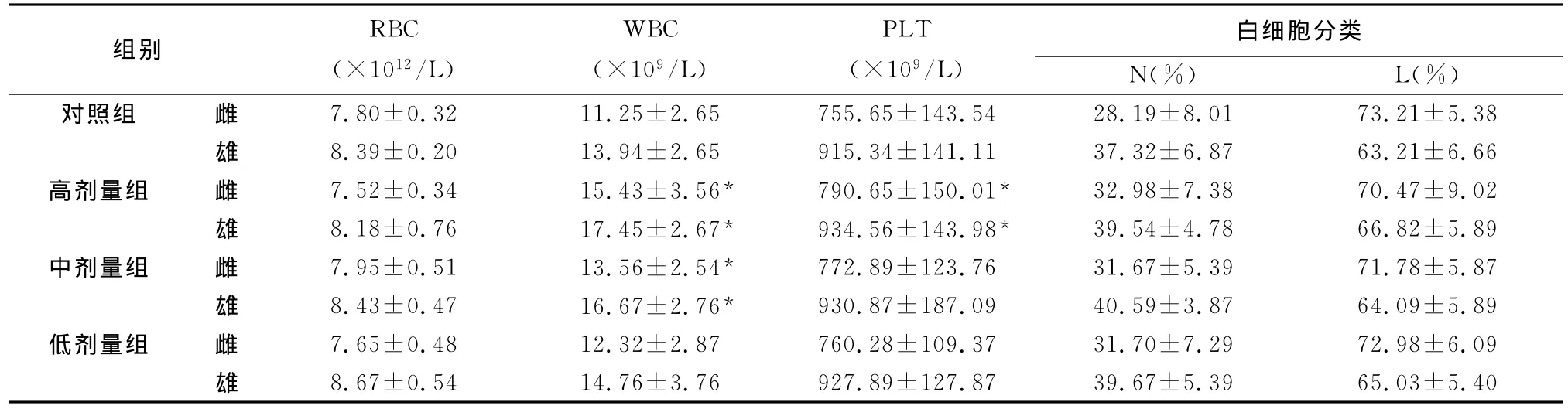
表3 蟾酥注射液对大鼠血常规指标的影响(Mean±SD,n=30)
2.2.5 病理学检查 当亚慢性毒性试验结束时(28 d),各组随机取大鼠10只进行病理剖检,发现高、中剂量组大鼠肝、脾、肾、雌性大鼠的子宫呈暗红色,无光泽感,部分器官有瘀血现象。
给药4周后,高剂量组有11只动物、中剂量组有4只动物肝组织出现轻度淤血和中度的炎性细胞浸润。恢复期后中剂量组动物肝被膜完整,肝实质正常,肝小叶界限可辨,肝血窦中有血细胞,细胞质中有较丰富的糖原,汇管区无炎性细胞,属正常肝;而高剂量组动物肝组织仍有轻度的炎性细胞浸润。给药4周后后,高剂量组有10只动物、中剂量组有3只动物肾脏组织出现萎缩和退行性变化。组织学检查发现有明显的肾小管坏死,部分小管结构紊乱较严重,空泡变性明显,有的出现间质灶性纤维化。恢复期后高、中剂量组动物肾小管结构较为清晰,形态正常,无异常病理表现。高剂量组病理学检查还发现部分大鼠脾脏、部分雌性大鼠子宫萎缩、增长受抑制等现象,但停药恢复期后能恢复正常。其他各组动物各脏器质地未见异常,组织学检查未见明显病变。
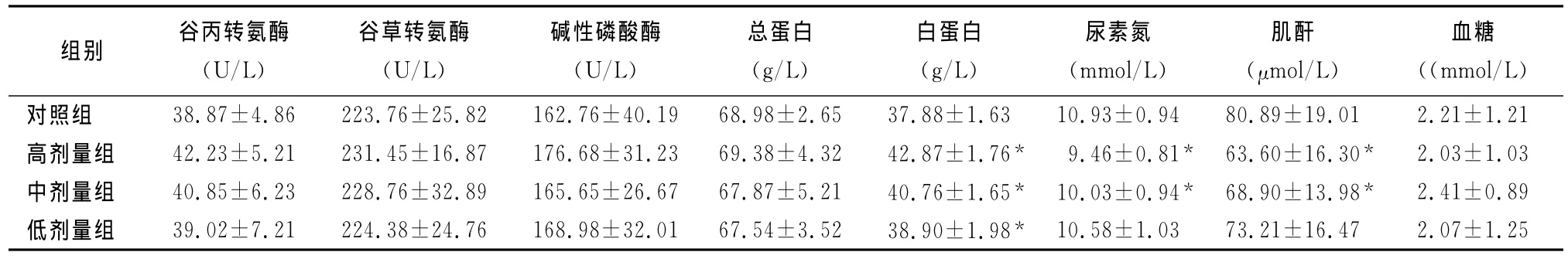
表4 蟾酥注射液对大鼠血清生化指标的影响 (Mean±SD,n=30)
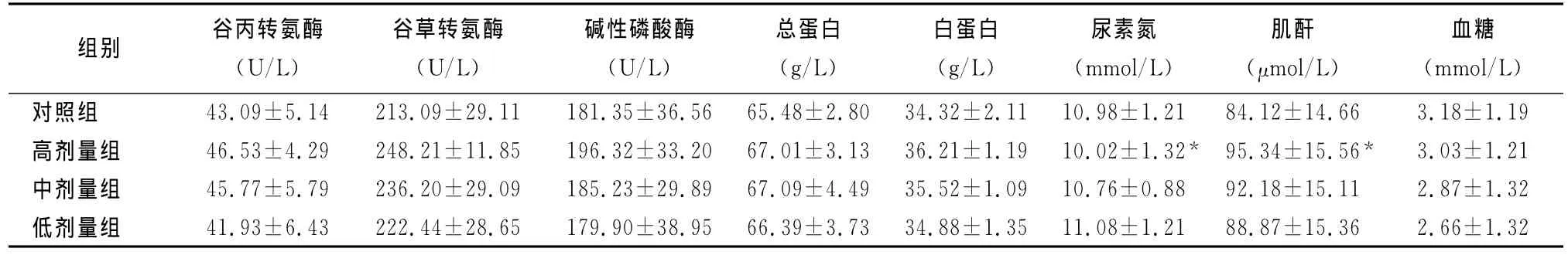
表5 蟾酥注射液停药恢复2周后大鼠血清生化指标的影响 (Mean±SD,n=10)
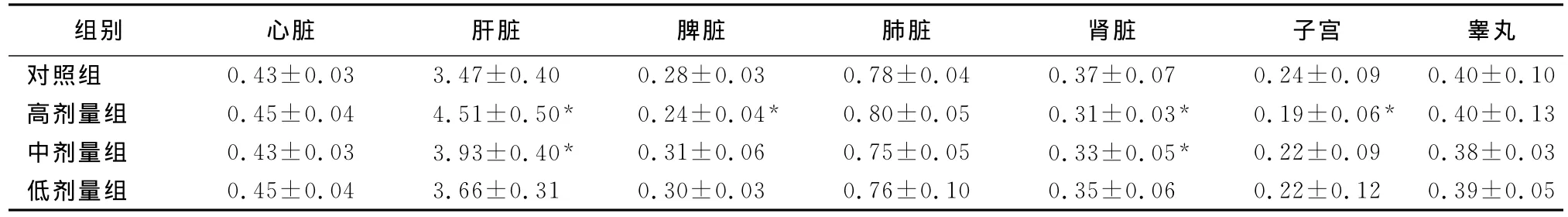
表6 蟾酥注射液停药时大鼠主要脏器系数的影响 (Mean±SD,n=20)
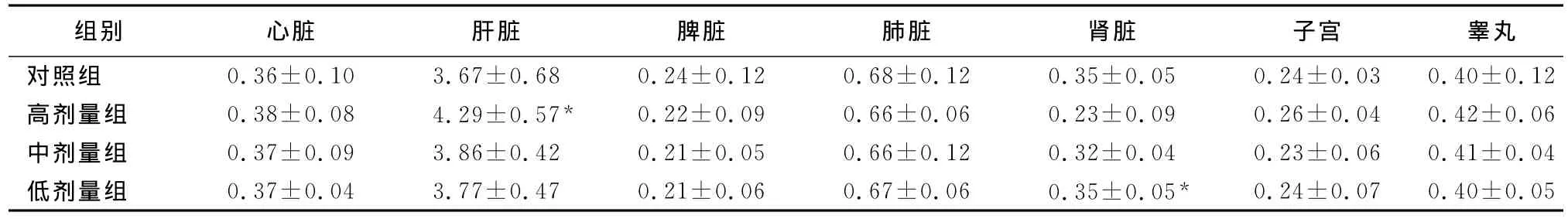
表7 蟾酥注射液停药恢复期后大鼠主要脏器系数的影响 (Mean±SD,n=10)
3 讨论
蟾酥为《中华人民共和国药典》二零零零年版一部标注毒性的15味常用有毒中药之一[8]。蟾酥的毒性与其提取方法、活性成分的组成与含量有着密切的关系。贺石林等[6]研究蟾酥的不同制剂对小鼠的LD50:蟾酥粗制品为40mg/kg,醇提取物为208 mg/kg,水提取物为900mg/kg。金其泉等[7]测定蟾皮制剂的急性毒性,蟾皮制剂Ⅰ号(水溶性成分)临床用量的1 500倍小鼠尾静脉给药未见中毒;蟾皮制剂Ⅱ号(水脂混合成分)毒性较大,LD50静脉注射为3.81±0.22mg/kg,腹腔注射为26.27±0.3 mg/kg,说明蟾酥制剂工艺、不同的提取方法、不同的活性成分,LD50相差较大。本制剂蟾酥注射液为蟾酥经水提醇沉精制而成的注射液,主要成分为水溶性生物碱。试验结果表明,其LD50为102.65 mg/kg(以蟾酥计),该剂量为猪临床推荐用量(0.2 mg/kg体重)的513倍。表明蟾酥注射液按临床推荐剂量使用安全性较高。
亚慢性毒性试验结果表明,蟾酥注射液高、中剂量组在用药10d后采食量明显下降、体重增长缓慢。至试验结束时,与对照组比较增重差异明显。表明蟾酥注射液在较高剂量下[≥5.0mg/kg(以蟾酥计)]长期使用可影响动物的生长发育。
谷丙转氨酶和谷草转氨酶参与体内转氨基作用,它们反映蛋白质合成和分解代谢的状况,其在血液中的变化显示肝的健康状态。当细胞、线粒体受损时,ALT和AST逸出细胞进入血液,使其血液浓度升高,血液中ALT与AST活性升高[9]。因此,血清酶活性的升高表示机体组织器官受损[4]。试验结果表明,各给药组血清中ALT水平显著性(P<0.05)高于对照组,结合病理剖检和组织切片检查,说明蟾酥注射液长期大剂量使用对肝脏有损害作用。
高、中剂量组BUN、CREA水平与对照组比较差异显著(P<0.05),表明蟾酥注射液对肾脏功能也有一定的影响。病理剖检和脏器系数检查证实,肾脏组织出现萎缩和退行性变化。组织学检查发现有明显的肾小管坏死,部分小管结构紊乱较严重,空泡变性明显,有的出现间质灶性纤维化。
综上所述,蟾酥注射液其毒性作用的靶器官主要是肝脏和肾脏,出现肝脏肿大和肾脏萎缩等现象,以肝细胞肿胀、变性、增生、肾小管坏死为特征性病变。在恢复期末,对余下动物进行相同项目观察和检测,发现中、低剂量组未见明显毒性反应和病理变化,肝脏和肾脏功能恢复较好,表明该剂量(≤5.0 mg/kg)条件下药物对试验动物造成的损伤性病变是可逆的,不会产生延迟性毒性反应。而较高剂量(≥10.0mg/kg)的恢复效果不佳。
综上可以看出,蟾酥注射液大剂量长期应用时会对肝脏、肾脏造成轻微的炎症,提示在临床上应用时一定要注意剂量和疗程,以免起到负面的作用。
[1] 余椿生.蟾酥[J].食品与药品,2008,10(1):73-75.
[2] 苏永华,牛欣.蟾酥制剂的药效作用研究评述[J].北京中医药大学学报,2001,24(2):51-54.
[3] 王玲华,宋克中.蟾酥临床应用近况[J].中国现代应用药学杂志,2006,23(7):618-620.
[4] 左胜和.蟾酥在兽医临床上的应用概况[J].中兽医学杂志,1994,76(3):36-37.
[5] 王浴生.中药药理与应用[M].北京:人民卫生出版社,1983:1258.
[6] 贺石林,季安国,彭芝配,等.山莨菪碱对抗蟾酥毒性的实验研究[J].中药药理与临床,1985,(1):203.
[7] 金其泉,顾丽英,谢秋心,等.蟾皮制剂的毒性、安全试验和对中枢神经系统作用的研究[J].蚌埠医学学报,1982,7(3):167-171.
[8] 张 智,闪增郁,向丽华,等.15味有毒中药小鼠半数致死量的实验研究[J].中国中医基础医学杂志,2005,11(6):435-436.
[9] 李应超,张发明,何诚,等.酸枣仁口服液的急性和亚慢性毒性试验研究[J].中国兽医科学,2010,40(9):978-983.

