siat7e基因和st3gal I基因双表达载体的构建及其初步应用
陈小云,张 敏,张启龙,王 磊,王 栋,蒋桃珍
(中国兽医药品监察所,北京 100081)
大多数连续细胞系在大规模病毒生产过程中的一个重要缺陷是由于这些细胞属于贴壁依赖性细胞,因而需要表面贴附以进行增殖。在工业化生物反应器生产中,采用微载体可以提供细胞生长表面。尽管这一方案能获得较高的病毒产率,但是,与全悬浮细胞增殖方案相比,这一方案还是显得过于繁琐。因此,构建和应用能在全悬浮条件下增殖的MDCK细胞系,将极大方便禽流感病毒的放大培养工艺。
由于 MDCK细胞自身的贴壁特性较强,与BHK-21细胞相比,采用常规的悬浮细胞驯化技术,很难直接将MDCK细胞驯化为适应全悬浮培养条件的细胞。并且,由于现行《中国药典》和《中国兽药典》对用于疫苗生产的传代细胞的代次范围都有较严格的规定,以防传代细胞在超过一次的代次范围后,产生致肿瘤性等安全性问题。这也限制了采用长期悬浮培养的方法,将贴壁依赖性MDCK细胞驯化为适应全悬浮培养细胞的策略。因此,有必要尝试采取其他更为快捷而有效的驯化方法。已有的研究表明,将控制细胞帖壁生长特性的人类siat7e基因,转染MDCK细胞,能够使该细胞失去贴壁依赖特性,从而适应悬浮培养环境[1]。
此外,流感病毒通过其表面的血凝素(HA)与细胞表面唾液酸寡糖受体结合侵染宿主细胞。禽流感病毒倾向识别 α-2,3连接型受体(NeuAc α -2,3-Gal),而人流感病毒倾向识别 α -2,6连接型受体(NeuAcα-2,6-Gal)。目前 H5N1和H9N2亚型流行株仍保持典型的 NeuAcα-2,3-Gal受体结合倾向性,因此,提高 MDCK工程细胞系表面受体丰度,有可能改进禽流感病毒分离株的生长滴度及蚀斑形成能力。
为此,本研究克隆了编码人的唾液酸转移酶ST6GalNacⅤ的siat7e基因,以及鸡 β-半乳糖苷α-2,3-唾液酸转移酶Ⅰ(st3galⅠ)基因,并将它们构建在同一个真核表达载体,进行双基因表达,以期构建能够适应悬浮培养,并且对禽流感病毒更加易感的MDCK细胞系,为应用MDCK细胞规模化生产禽流感疫苗奠定基础,并为其他贴壁细胞的悬浮驯化提供新思路。
1 材料与方法
1.1 菌株与载体 受体菌DH5α购自北京纽朴生物技术开发中心;pMD18-T载体购自宝生物工程有限公司。真核表达载体pReceiver,本室保存。
1.2 试剂 基因组提取试剂盒 QIAamp® DNA Mini Kit,QIAGEN公司产品;Taq DNA聚合酶、DL-2000 DNA分子量标准、限制性内切酶Bam H I、PstⅠ、Sac I和 Xho I、IPTG、X - Gal、dNTP,宝生物有限公司;氨苄青霉素、琼脂糖凝胶,Sigma公司;DNA片段玻璃奶快速纯化回收试剂盒,博大泰克生物基因技术有限公司;质粒小量快速提取试剂盒,北京天根生物技术公司。
1.3 人和鸡基因组DNA的提取 参照基因组提取试剂盒QIAamp® DNA Mini Kit的说明书中介绍的血液中基因组提取方法进行,并稍作修进。具体步骤如下:取1.5 mL 血液,10000 ×g离心2 min,弃上清;用180μL酶裂解缓冲液重悬沉淀,37℃作用45 min;加25μL蛋白酶K和200μL缓冲液AL,涡旋混匀,70℃作用30 min;加200μL无水乙醇,涡旋混匀后,加入DNeasy微型离心柱上,8000×g离心1 min;将DNeasy微型离心柱放入一个新的2mL收集管中,加入500μL缓冲液AW2,14000×g离心5 min;将DNeasy微型离心柱放入一个新的1.5 mL eppendorf管中,加入200 μL 缓冲液 AE,室温放置1 min,8000×g离心1 min,滤出液即为纯化后基因组DNA溶液。
1.4 引物设计 参考GenBank中已登录的siat7e基因st3gal I基因序列,利用Oligo6.0软件,自行设计并合成了2对引物,其中引物对 V1581U/V1581L,用于扩增siat7e基因。这对引物的扩增产物包含了完整的siat7e基因序列,并在ORF两端引入了便于进一步克隆的两个酶切位点BamH I和PstⅠ(下划线表示)。预期的扩增产物大小为1027 bp。引物对C0384U/C0384L,用于扩增st3gal I基因。这对引物的扩增产物包含了完整的st3gal I基因序列,并在 ORF两端引入了便于进一步克隆的两个酶切位点 Sac I和Xho I(下划线表示)。预期的扩增产物大小为1047 bp。具体引物序列如下:
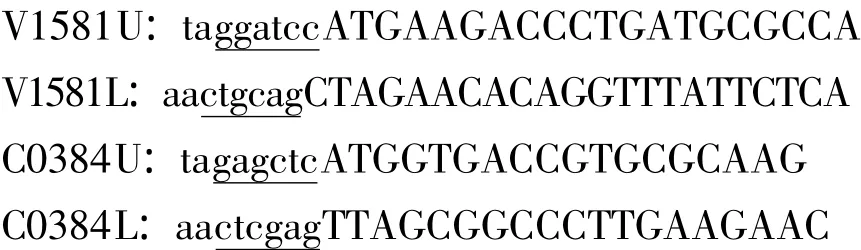
1.5 PCR扩增 以纯化后的人和鸡基因组DNA为模板,进行PCR扩增。采用50μL反应体系:10 ×Buffer 5 μL,25 mmol/L MgCl2 3 μL,10 mmol/L dNTP 2μL,25 mmol/L的上下游引物各1μL,模板DNA 5 μL,5 U/μL Taq DNA 聚合酶 0.5 μL,补加灭菌超纯水至总体积50μL。反应条件:95℃预变性5 min,加入 Taq DNA聚合酶;94℃ 40 S,52℃40 S,72℃ 80 S,共进行31个循环;最后72℃延伸10 min。取8μL PCR产物,用1.5%琼脂糖凝胶电泳检查PCR扩增结果。
1.6 PCR产物的纯化、酶切、连接与转化 用1.5%琼脂糖凝胶电泳分离PCR产物,切下目的条带,用DNA片段玻璃奶快速纯化回收试剂盒回收。连接时,首先将V1581U/V1581L引物对的扩增产物,以及C0384U/C0384L引物对的扩增产物,分别与pMD18-T载体连接,在0.5 mL eppendorf管中加入1μL pMD18-T载体和4μL纯化后的PCR产物,再加入5μL Ligation SolutionⅠ,16℃反应30 min;取出5μL,加入与DH5α感受态细胞配套的溶液A(10μL)和溶液B(35μL);加入50μL感受态细胞,冰上放置20 min,再室温放置10 min;再加入 200μL LB培养基,37℃ 150 rpm振荡40 min;取200μL菌液涂布于LB/Amp+/XGal/IPTG平板上,37℃培养过夜(12-16 h),观察菌落生长情况,根据蓝白斑筛选重组转化菌。得到的重组质粒分别命名为pMD18-V1581和pMD18-C0384。
1.7 重组PCR产物质粒的酶切及真核表达载体的构建及鉴定 将pMD18-V1581质粒及重组表达载体pReceiver,分别用内切酶Bam H I和PstⅠ进行双酶切,连接,得到重组载体pRE-SIAT。再将pMD18-C0384质粒及构建的重组载体 pRESIAT用内切酶Sac I和Xho I进行双酶切,连接,获得pRE-SIAT-ST3重组真核表达载体。转化DH5α细胞,挑取白色菌落,经培养后采用质粒小量快速提取试剂盒提取质粒。从载体pRE-SIAT-ST3中选择位于插入片段两侧的两个酶切位点Bam H I/PstⅠ,以及内切酶Sac I/Xho I进行双酶切鉴定。将酶切鉴定的重组质粒用无菌超纯水稀释100倍,取1μL为模板,采用前述反应体系和反应条件进行PCR扩增。同时,采用PCR上游引物作为测序引物,对酶切和PCR鉴定呈阳性的重组质粒进行序列测定。由北京三博远志公司完成。
1.8 重组载体pRE-SIAT-ST3电转化MDCK细胞 采用德国QIAGEN公司质粒纯化试剂盒,提取pRE-SIAT-ST3质粒,并将质粒浓度调整为1μg/mL。将MDCK细胞扩大培养后,胰酶消化,离心后,作细胞计数,并用BioRAD公司的电击缓冲液,将细胞浓度调整为1.1×106活细胞/mL。取10μL质粒,加入90μL细胞悬液,采用BioRAD电转化仪,在0.2 cm电击杯中进行电击。电击条件为:150 V,5 ms。电击后,立即将细胞轻柔加入到含有5mL完全生长培养液的6孔细胞板内,37℃,5%CO2培养箱中培养。同时,设立未转化的正常MDCK细胞对照。
1.9 转化细胞的荧光观察 将电转化的MDCK细胞,在6孔板中培养24小时后,采用Olympus IX71倒置荧光显微镜,进行荧光显微镜观察。由于表达载体pRE-SIAT-ST3中带有eGFP序列,因此,转化后的MDCK细胞,应可观察到绿色荧光。
2 结果与分析
2.1 siat7e基因和st3gal I基因的扩增 在进行了31个循环的扩增后,经1.5%琼脂糖凝胶电泳,并与DL-2000标准分子量比较,结果表明,得到了大小分别为1027 bp和1047 bp的siat7e基因和st3gal I基因片段(图1)。
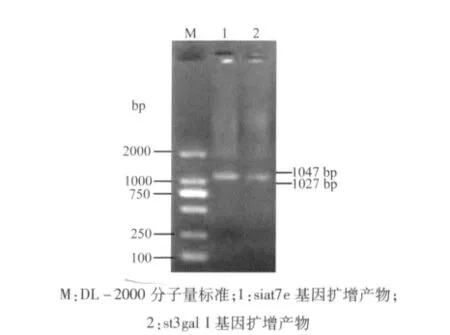
图1 siat7e基因和st3gal I基因的PCR扩增
重组表达载体的鉴定将构建的重组真核表达载体pRE-SIAT-ST3,分别采用两组内切酶,即内切酶Bam H I/PstⅠ以及内切酶Sac I/Xho I,分别进行双酶切鉴定,均能得到预期大小的片段。采用引物对V1581U/V1581L和C0384U/C0384L进行PCR鉴定,得到的PCR产物大小,也与预期一致(图2)。同时,采用PCR的上游引物,对重组载体进行序列测定,结果表明,序列是正确的。
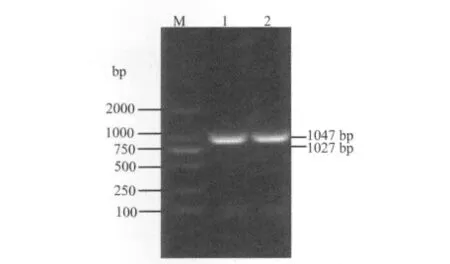
图2 siat7e基因和st3gal I基因的PCR扩增
2.3 电转化细胞的荧光显微镜观察 采用Olympus IX71倒置荧光显微镜,通过观察载体自带的eGFP荧光蛋白的表达情况,验证外源基因的表达情况。由于eGFP位于外源基因的C端,因此,从理论上讲,只有充分表达外源基因后,eGFP才会得到表达。观察结果表明,与对照细胞相比,电转化MDCK细胞可见明显的绿色荧光,证明eGFP基因得到了有效的表达(结果见图3)。
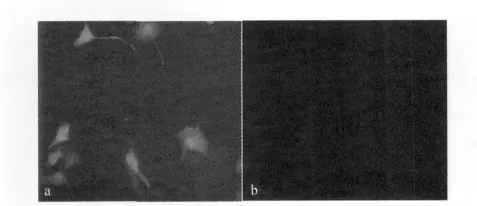
图3 转染双基因真核表达载体的MDCK细胞的荧光观察
3 讨论
目前,工业化生产流感疫苗,已有若干细胞系可供选择。但是,一方面新近发展起来细胞系,如人PER.C6、鸭 EB66或鸭 AGE1.CR 细胞等,这些细胞系是为了疫苗生产而特别研制的,通常在无血清条件下悬浮培养。然而,除了PER.C6细胞外,对于大规模生产中的细胞生长和病毒复制仅仅进行了极少的研究,背景研究资料的匮乏反过来限制了这些新细胞系的进一步应用。更为重要的是,这些细胞系都受到了严格的专利保护;另一方面,可以通过商业途径获得的贴壁细胞系,如绿猴肾细胞(Vero)或MDCK细胞,是当前流感疫苗生产最有希望的哺乳动物细胞系,并且多年来已对这两个细胞系进行了较为系统和详尽的研究。其中MDCK细胞是培养和分离流感病毒的最佳哺乳动物细胞系,此细胞系具有感染后迅速产生流感病毒、在短时间内取得高滴度和产生的流感病毒血凝素(HA)含量高等特点,并且可用于增殖大多数流感病毒。更为重要的是,采用MDCK细胞培养生产的疫苗,其诱导的免疫反应,与鸡胚源疫苗一样良好[2]。美国富道公司实验室已经将MDCK细胞系应用到马流感疫苗的生产中,这种流感疫苗生产工艺的转变使生产成本下降到鸡胚培养工艺的40%,而抗原的效力却提高了3倍,同时消除了外源因子污染的危险。有研究者比较了在不同类型微载体上培养的MDCK细胞,与鸡胚之间在增殖A型流感病毒能力上的差异,发现在搅拌瓶培养的以Cytodex I为微载体的细胞,其毒价上可达5.0×104HAU/mL,而鸡胚则为2.0×105HAU/mL。根据这一数据,他们估算在固相微载体上培养的1000 L MDCK细胞,约等于30000枚鸡胚,或者说是1 L等于30枚鸡胚[2]。
研究者通过采用DNA微矩阵的方法,比较了贴壁依赖性和贴壁非依赖性Hela细胞的转录谱,发现siat7e(ST6GalNacⅤ)是控制细胞贴壁程度的重要基因[3]。通过显微评估和监测细胞在剪切流体腔中的脱壁情况,发现更高水平的siat7e基因转录对应于更低程度的细胞贴壁,而用siRNA抑制siat7e基因转录,能显著增强细胞的贴壁功能。siat7e基因编码人的唾液酸转移酶ST6GalNacⅤ,该酶属于唾液酸转移酶ST6GalNac家族的成员,是一种Ⅱ型高尔基膜蛋白,能将唾液酸从供体CMPNeu5Ac转移至神经节苷脂GalNac残基GM1b上,形成GD1α[4]。国外已有研究者将siat7e基因转染MDCK细胞,成功获得了适应悬浮培养环境的MDCK细胞系[1]。
本研究构建的siat7e基因和st3galⅠ基因双基因真核表达载体,在转化MDCK细胞后,若能使MDCK细胞适应悬浮培养,并且对禽流感病毒更加易感,为极大地方便应用MDCK细胞规模化生产禽流感疫苗。目前,我们已通过本研究获得了该载体,并在将该真核表达载体电转化MDCK细胞后,成功观察到了外源基因eGFP的表达,初步证实我们构建的真核表达载体pRE-SIAT-ST3已成功转化至MDCK细胞,并得到了有效表达。下一步,我们将进一步研究载体中的两个外源基因siat7e基因和st3gal I基因的表达情况,以及转化后MDCK细胞的表型特征,特别是其适应悬浮培养的特性,以及对禽流感病毒的敏感性。

