肿瘤干细胞的研究进展及临床意义
岳冬丽,韩交玲,关方霞,张 毅#
1)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 2)郑州大学第一附属医院肿瘤科 郑州 450052 3)郑州大学生物工程系 郑州 450001
恶性肿瘤导致的死亡人数在发展中国家高居第二位,而在发达国家更是高居榜首,是发达国家的首要死亡原因[1],严重威胁着人类的健康及生存。目前,恶性肿瘤的诊断与治疗水平已有了极大提高,化疗、放疗、手术治疗、生物治疗等综合治疗手段的应用已经极大改善了恶性肿瘤的治疗效果,使肿瘤患者的生存率明显提高。尤其是儿童白血病、霍奇金病和睾丸癌的治疗取得了较大突破,已达治愈水平。由于早期诊断技术的进步以及肿瘤预防的开展,乳癌及前列腺癌患者的死亡率也急剧下降。但是大量肿瘤患者在确诊时已是晚期,已发生远处转移,导致治疗效果不佳,这成为肿瘤诊断中的一个严峻问题。因而提高恶性肿瘤的早期诊断水平并控制肿瘤的复发和转移将是提高癌症患者生存率与治愈率的关键。
近年来,肿瘤干细胞(cancer stem cell,CSC)学说备受关注。该学说认为肿瘤干细胞促进了肿瘤生长,是恶性肿瘤的起源;并且能够耐受化疗和放疗等常用的肿瘤治疗手段,是肿瘤转移和复发的重要原因。肿瘤干细胞学说并不是近几十年才提出的新概念,早在150年前已经有人提出肿瘤干细胞的概念[2]。Reya等[3]明确提出肿瘤组织中存在少数具有干细胞性质的细胞亚群,具有自我更新和多向分化潜能,可以形成新肿瘤,并将这些细胞定义为肿瘤干细胞。近年来,大量研究证据证实了肿瘤干细胞的存在。作者主要从肿瘤干细胞学说的提出、肿瘤干细胞的生物学特性、表面标志物以及肿瘤干细胞学说对于恶性肿瘤诊断、治疗及预后的意义等方面进行了综述。
1 肿瘤干细胞的生物学特性
1867年Julius Cohnheim提出了肿瘤干细胞学说,但由于受到当时技术条件等的限制,未能分离出肿瘤干细胞,因而此学说在当时未获得重视。随着科学技术的进步,研究人员发现小部分肿瘤细胞具有不同程度的自我更新能力,即具备干细胞特性,证实了肿瘤干细胞的存在。近年来,随着肿瘤干细胞研究的进展,肿瘤干细胞学说又被学术界所重视。
肿瘤干细胞的早期研究局限于细胞的体外扩增能力,并不能体现自我更新能力。1977年,Hamburger等[4]对来源于肺癌、卵巢癌和神经母细胞瘤的肿瘤细胞进行体外培养,发现只有极少数的肿瘤细胞能够形成克隆。他认为这些具有自我更新和多向分化潜能的极少数细胞可以形成新肿瘤,而这部分肿瘤细胞可能起源于遗传突变的正常干细胞,进而明确提出“肿瘤干细胞学说”。1997年Bonnet等[5]分离出表型为CD34+C38-的白血病干细胞,首次在细胞水平上直观证实了肿瘤干细胞的存在。近几十年,随着科学技术及相关研究的发展,肿瘤干细胞的研究进展迅速,人们已证实在多种实体肿瘤中存在肿瘤干细胞,如乳癌[6-7]、卵巢癌[8-9]、前列腺癌[10]、结直肠癌[11]和脑肿瘤[12]等。
肿瘤干细胞与正常组织干细胞具有相同特性,即均具备自我更新和多向分化潜能[13]。此外,肿瘤干细胞致瘤能力强,少量肿瘤干细胞(少至500个或 1 000 个[14])就能在裸鼠体内形成肿瘤;对多种化疗药物(如阿霉素、氟尿嘧啶、环磷酰胺、依托泊苷及顺铂等)有耐药性[15-16];抗放疗[17-18];有特异性表面标记分子(如CD44+CD24-[6],CD34+C38-[5]等);Wnt/β-catein[19-20]、 Notch[21]、 Hedgehog[22]和TGF-β[23-24]等信号通路常异常活化(图1)。
根据肿瘤干细胞的特性,可通过不同方法富集肿瘤干细胞,例如诱导EMT(epithelial-to-mesenchymal transition)过程[25-26]、低黏附培养系统[27-28]、低氧培养[29]、化疗药物刺激[30]、侧群分选[31]等方法,这为肿瘤干细胞的干细胞特性及分化能力的具体机制以及针对肿瘤干细胞的靶向治疗等研究奠定了基础。
2 肿瘤干细胞表面标志物
目前,有许多关于肿瘤干细胞表面标志物的研究,不同文献报道的结果不尽相同,关于肿瘤干细胞表面标志物的研究尚无定论。但是,这些研究都将为肿瘤干细胞靶向治疗提供理论依据。多种恶性肿瘤干细胞表面标志物见表1。

表1 肿瘤干细胞表面标志物
续表1

肿瘤类型肿瘤干细胞表面标志物肾癌CD105+[55]霍奇金淋巴瘤CD27+ALDH+[56]急性髓性白血病CD34+CD38-[5]ALDH+[57]CD44+[58]淋巴母细胞白血病CD90+CD110+[59]视网膜母细胞瘤Epcam+[60]非小细胞肺癌CD133+[61]恶性黑色素瘤CD44+CD133+CD24+[62]CD133+[63]CD271+[64]骨肉瘤CD133+[65]ALDH+[66]尤文肉瘤CD133[67]垂体腺瘤CD133[68]头颈部肿瘤CD44[69]ALDH+[70]
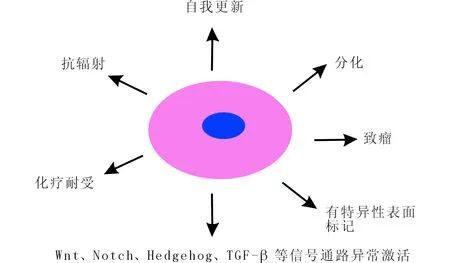
图1 肿瘤干细胞的生物学特性
3 肿瘤干细胞的临床意义
3.1肿瘤干细胞在肿瘤诊断及预后中的意义肿瘤干细胞学说认为肿瘤干细胞是肿瘤的起源,因而检测肿瘤干细胞表面标志物将会提高癌症的早期诊断效率。急性髓性白血病的干细胞标志物CD34最早被发现,随后很多实体肿瘤干细胞表面标志物陆续被鉴定出来,这在很大程度上提高了肿瘤诊断的特异性。Stenffensen等[71]对117例卵巢癌患者的CD44+细胞与无进展生存时间进行了分析,多数(57.1%)Ⅰ期患者的CD44+细胞数量较多(>20%),而Ⅱ、Ⅲ和Ⅳ期患者的CD44+细胞数量较少;同时在Ⅰ期患者中,CD44+细胞数量多的患者(>20%)无进展生存时间缩短。另外,有研究[72]表明CD133+ALDH+卵巢癌患者的预后明显较CD133-ALDH-患者差。大量研究表明肿瘤干细胞与多种肿瘤患者临床预后相关,如乳癌[73]、卵巢癌[74]和结直肠癌[75]等。肿瘤细胞中肿瘤干细胞的比例有预后意义,比例越高,患者预后越差。这些结果提示肿瘤干细胞是影响肿瘤诊断及预后评价的重要指标。
3.2肿瘤干细胞在肿瘤治疗中的意义目前抗癌药物主要杀伤增殖期的肿瘤细胞,而对肿瘤干细胞的杀伤效果不佳。由于肿瘤干细胞主要处于静止期,能够通过改变细胞周期调控点、减弱凋亡途径、增强DNA损伤修复能力以及高表达ABC转运子把药物转运至胞外,降低细胞内药物积累[76],导致治疗失败。如果肿瘤干细胞是肿瘤生长的根源,那么综合应用肿瘤干细胞特异性或非特异性杀伤药物将是肿瘤治疗的重大突破。随着分子生物学技术的发展,人们对肿瘤的细胞和分子水平上的发病机制有了进一步认识,肿瘤靶向治疗的研究已经进入一个全新时代。针对肿瘤干细胞靶向治疗的研究也已取得重大进步,主要集中于以下几个方面:调节肿瘤干细胞微环境,逆转肿瘤干细胞抗放化疗特性,靶向作用于肿瘤干细胞的特异性分子标志及信号通路,促进分化疗法,肿瘤干细胞特异性免疫治疗等。下面仅对逆转肿瘤干细胞的抗放化疗特性,靶向作用于肿瘤干细胞的特异性分子标志、信号通路及肿瘤干细胞特异性免疫治疗方面做介绍。
3.2.1 逆转肿瘤干细胞的抗放化疗特性 肿瘤干细胞能够耐受化疗和放疗[15-18],从而导致恶性肿瘤复发和转移,导致治疗失败。如果能够扭转肿瘤干细胞的这种特性,使其恢复对放化疗的敏感性,将是肿瘤治疗的重大突破。逆转肿瘤干细胞抗放化疗特性的示意图见图2。
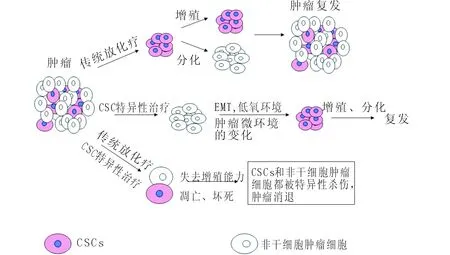
图2 逆转肿瘤干细胞的抗放化疗特性示意图
Frank等[77]证实抑制多药耐药ABC转运子(如ABCB5)活性能够改善恶性黑色素瘤干细胞对化疗的敏感性。Jang等[78]敲除乳癌细胞(MCF7,MDA-MB-231)ANT2(adenine nucleotide translocator-2)后,发现ABCG2表达下调而细胞对阿霉素的敏感性增强。Cheng等[79]证实通过抑制ABCB1和ABCG2介导的耐药机制,能够增强化疗药物杀伤肿瘤干细胞的能力。这些结果表明抑制ABC转运子(如ABCB1、ABCB5、ABCG2)活性可逆转肿瘤干细胞的耐药性,因此ABC转运子抑制剂可作为一类有效的肿瘤干细胞治疗药物。
放疗是恶性肿瘤治疗中不可或缺的手段,尤其是在恶性胶质瘤、鼻咽癌等肿瘤的治疗中。放疗对全部肿瘤细胞的损伤是一致的,但是肿瘤干细胞的损伤修复能力强、调控点基础活性高,可以迅速对损伤做出反应,最终逃避细胞死亡。Eyler等[80]对体内肿瘤生长及体外克隆形成等观察后发现,抑制ChK1/2激酶活性能够逆转恶性胶质瘤干细胞的抗放疗效应。
然而,肿瘤干细胞抗放化疗的机制远非上述几种。有文献报道[8,28,34]转录因子(如SOX2、NANOG、OCT4、C-MYC、LIN28、ALDH1A1等)也可能与肿瘤干细胞的生物学特性有关,某些信号通路活性的改变也是引起肿瘤干细胞上述特性的原因。目前,科研人员仍在对肿瘤干细胞抗放化疗的机制进行深入研究。
3.2.2 靶向作用于肿瘤干细胞特异性分子标志及信号通路 糖蛋白CD44在上皮细胞、间质细胞或某些肿瘤细胞表面广泛表达。CD44在恶性黑色素瘤、结直肠癌、前列腺癌、乳癌及白血病细胞中高表达,是一个潜在的治疗靶点。Jin等[58]指出在慢性粒细胞性白血病及急性髓性白血病细胞中,应用CD44单克隆抗体阻断CD44与肿瘤干细胞的干细胞穴的黏附,可诱导肿瘤干细胞迅速分化,达到清除白血病干细胞的目的。但是CD44在一些正常细胞表面上也存在,而且在某些正常细胞表面上的表达还很强,因而在临床中是否能够将CD44作为肿瘤干细胞的治疗靶点还有待进一步的研究。ABC转运蛋白ABCG2是脑肿瘤干细胞、黑色素瘤干细胞及肾癌干细胞等的表面标志物之一,因而可能成为肿瘤细胞治疗的新靶点[81]。在多种恶性肿瘤中,如卵巢癌、乳癌、前列腺癌、结直肠癌、头颈部肿瘤及胰腺癌细胞等,ALDH+细胞具有干细胞特性,是一个潜在的治疗靶点。
2010年,Singh等[82]发现CXCL12-CXCR4信号通路在胰腺癌抗药性中发挥重要作用,可能成为胰腺癌治疗的新靶点。Wnt/β-catein[19-20]、Notch[21]、Hedgehog[22]和TGF-β[23-24]等信号通路在肿瘤干细胞中经常发生异常调节,对肿瘤干细胞的干细胞特性保持起着重要作用。例如Wnt/β-catein信号通路能够维持人胚胎干细胞、胃肠道干细胞、造血干细胞及皮肤干细胞的自我更新能力,抑制其分化[19]。在大肠癌干细胞中,Wnt信号通路活性增高,导致肿瘤细胞克隆形成能力增强、肠道分化标志表达下调[20]。故异常信号通路可作为促进肿瘤干细胞分化治疗的特异性靶点。
3.2.3 肿瘤干细胞的特异性免疫治疗 肿瘤特异性过继细胞免疫治疗,通过将体外大量扩增的肿瘤特异性效应细胞回输给患者,使其直接杀伤肿瘤细胞,是目前疗效最肯定的肿瘤生物治疗手段。如果能够获得肿瘤干细胞特异性效应细胞,将可直接杀伤肿瘤干细胞,消除肿瘤复发转移的根源。Visus等[83]发现ALDH1A1特异性CD8+T细胞能够有效识别肿瘤细胞系和移植瘤中的ALDH+细胞,对荷瘤小鼠进行特异性CD8+T细胞过继免疫治疗,能够清除体内ALDH+细胞,抑制肿瘤生长及转移,延长小鼠生存时间。
肿瘤干细胞疫苗,通过补体依赖性细胞毒性及细胞毒性T淋巴细胞直接靶向作用于肿瘤干细胞,诱导体液及细胞免疫反应,产生保护性抗肿瘤免疫。Ning等[84]证实肿瘤干细胞具有很强的免疫原性,能够有效刺激机体产生保护性抗肿瘤免疫;肿瘤干细胞免疫小鼠的血清中含有高滴度抗体,能够结合并裂解肿瘤干细胞;在体外实验中,来自肿瘤干细胞免疫小鼠的外周血或者脾脏的细胞毒性T淋巴细胞能够杀伤肿瘤干细胞。
以上结果显示肿瘤干细胞特异性免疫治疗能够靶向作用于肿瘤干细胞。在临床应用中,应密切考虑其与常规疗法如化疗和放疗等的结合,以增强肿瘤的治疗效果。肿瘤干细胞的免疫治疗必将成为肿瘤治疗的重要手段。
3.3肿瘤干细胞应用于临床治疗的双面性肿瘤干细胞理论获得了越来越多研究结果的支持,但目前还没有一种肿瘤干细胞治疗方案应用于临床。肿瘤干细胞的临床应用仍面临着很多挑战:首先,肿瘤干细胞与正常干细胞的生物学特性有很多相同之处,在肿瘤干细胞治疗中,必须确保对肿瘤干细胞的特异性杀伤,避免对正常干细胞的攻击。其次,肿瘤干细胞研究成果主要是在动物实验中获得的,由于人与动物间免疫系统存在较大差异,迄今尚无法将研究成果直接应用于人体。第三,肿瘤干细胞表面标志物研究迄今尚无统一标准,如Ricci-Vitiani等[50]认为CD133+细胞为结肠癌干细胞,但是Shmelkov等[85]却发现CD133+和CD133-结肠癌细胞的致瘤性没有太大差别。已报道的肿瘤干细胞表面标志物能否应用于肿瘤干细胞的分离,是否与肿瘤干细胞的功能有关,尚需更加广泛而深入的研究证实。最后,由于肿瘤干细胞仅是一小部分细胞群体,被杀伤后并不会出现明显的肿瘤缩小等直观反映,因此,关于肿瘤干细胞治疗的疗效评价,需要确切的评价指标。
4 展望
近年来,大量肿瘤干细胞研究结果验证了肿瘤干细胞学说,并已取得了很多鼓舞人心的成果。研究证实血液系统肿瘤和大多数实体瘤中存在肿瘤干细胞;CD133、CD44、ALDH和Epcam极有可能是肿瘤干细胞的表面标志物;SOX2、NANOG、OCT4、C-MYC、ABCG2、ALDH1A1等转录因子可能与肿瘤干细胞的生物学特性有关;并且在裸鼠实验中证实了肿瘤干细胞具有很强的致瘤性。这些成果提示了肿瘤干细胞靶向治疗的研究方向。
然而,在肿瘤干细胞的研究领域中还存在许多问题有待探索,如肿瘤干细胞维持干细胞特性及分化能力的机制等。总之,肿瘤干细胞的存在为肿瘤复发和转移提供了一种新的理论解释,也为肿瘤的诊断及预后评价开辟了一条新思路,同时肿瘤干细胞靶向治疗药物和普通肿瘤治疗药物的临床结合应用,将提高肿瘤治愈率。相信通过研究人员的不懈努力,随着肿瘤干细胞研究的不断深入,一定可以找到肿瘤干细胞耐受放化疗的具体机制,从而引发新一轮临床肿瘤治疗模式及靶向治疗药物研发的变革,推动肿瘤干细胞特异性治疗的发展,为人类控制肿瘤、改善肿瘤预后增加希望。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69
[2]Sell S.Stem cell origin of cancer and differentiation therapy[J].Crit Rev Oncol Hematol,2004,51(1):1
[3]Reya T,Morrison SJ,Clarke MF,et al.Stem cells,cancer,and cancer stem cells[J].Nature,2001,414(6859):105
[4]Hamburger AW,Salmon SE.Primary bioassay of human tumor stem cells[J].Science,1977,197(4302):461
[5]Bonnet D,Dick JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J].Nat Med,1997,3(7):730
[6]Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983
[7]Velasco-Velazquez MA,Homsi N,De La Fuente M,et al.Breast cancer stem cells[J].Int J Biochem Cell Biol,2012,44(4):573
[8]Meirelles K,Benedict LA,Dombkowski D,et al.Human ovarian cancer stem/progenitor cells are stimulated by doxorubicin but inhibited by Mullerian inhibiting substance[J].Proc Natl Acad Sci USA,2012,109(7):2358
[9]Kryczek I,Liu S,Roh M,et al.Expression of aldehyde dehydrogenase and CD133 defines ovarian cancer stem cells[J].Int J Cancer,2012,130(1):29
[10]Salmanzadeh A,Romero L,Shafiee H,et al.Isolation of prostate tumor initiating cells(TICs) through their dielectrophoretic signature[J].Lab Chip,2012,12(1):182
[11]O’Brien CA,Pollett A,Gallinger S,et al.A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J].Nature,2007,445(7123):106
[12]Singh SK,Clarke ID,Terasaki M,et al.Identification of a cancer stem cell in human brain tumors[J].Cancer Res,2003,63(18):5821
[13]Clarke MF,Dick JE,Dirks PB,et al.Cancer stem cells--perspectives on current status and future directions:AACR Workshop on cancer stem cells[J].Cancer Res,2006,66(19):9339
[14]Cao L,Zhou Y,Zhai B,et al.Sphere-forming cell subpopulations with cancer stem cell properties in human hepatoma cell lines[J].BMC Gastroenterol,2011,11:71
[15]Zhang Y,Wang Z,Yu J,et al.Cancer stem-like cells contribute to cisplatin resistance and progression in bladder cancer[J].Cancer Lett,2012,322(1):70
[16]Zhang L,Jiao M,Li L,et al.Tumorspheres derived from prostate cancer cells possess chemoresistant and cancer stem cell properties[J].J Cancer Res Clin Oncol,2012,138(4):675
[17]Lopez J,Poitevin A,Mendoza-Martinez V,et al.Cancer-initiating cells derived from established cervical cell lines exhibit stem-cell markers and increased radioresistance[J].BMC Cancer,2012,12:48
[18]Piao LS,Hur W,Kim TK,et al.CD133+ liver cancer stem cells modulate radioresistance in human hepatocellular carcinoma[J].Cancer Lett,2012,315(2):129
[19]Reya T,Clevers H.Wnt signalling in stem cells and cancer[J].Nature,2005,434(7035):843
[20]Vermeulen L,De Sousa E Melo F,van der Heijden M,et al.Wnt activity defines colon cancer stem cells and is regulated by the microenvironment[J].Nat Cell Biol,2010,12(5):468
[21]Yu S,Zhang R,Liu F,et al.Notch inhibition suppresses nasopharyngeal carcinoma by depleting cancer stem-like side population cells[J].Oncol Rep,2012,28(2):561
[22]Santini R,Vinci MC,Pandolfi S,et al.Hedgehog-GLI signaling drives self-renewal and tumorigenicity of human melanoma-initiating cells[J].Stem Cells,2012,30(9):1808
[23]Massague J,Xi Q.TGF-beta control of stem cell differentiation genes[J].FEBS Lett,2012,586(14):1953
[24]Wang H,Wu J,Zhang Y,et al.Transforming growth factor beta-induced epithelial-mesenchymal transition increases cancer stem-like cells in the PANC-1 cell line[J].Oncol Lett,2012,3(1):229
[25]Ye J,Wu D,Shen J,et al.Enrichment of colorectal cancer stem cells through epithelial-mesenchymal transition via CDH1 knockdown[J].Mol Med Report,2012,6(3):507
[26]Yoon CH,Kim MJ,Lee H,et al.PTTG1 oncogene promotes tumor malignancy via epithelial to mesenchymal transition and expansion of cancer stem cell population[J].J Biol Chem,2012,287(23):19516
[27]Wang YC,Yo YT,Lee HY,et al.ALDH1-bright epithelial ovarian cancer cells are associated with CD44 expression,drug resistance,and poor clinical outcome[J].Am J Pathol,2012,180(3):1159
[28]Chen SF,Chang YC,Nieh S,et al.Nonadhesive culture system as a model of rapid sphere formation with cancer stem cell properties[J].PLoS One,2012,7(2):e31864
[29]Bhaskara VK,Mohanam I,Rao JS,et al.Intermittent hypoxia regulates stem-like characteristics and differentiation of neuroblastoma cells[J].PLoS One,2012,7(2):e30905
[30]Hu X,Ghisolfi L,Keates AC,et al.Induction of cancer cell stemness by chemotherapy[J].Cell Cycle,2012,11(14):2691
[31]Chien CY,Chuang HC,Chen CH.The side population of cancer stem-like cells in human oral cancer[J].Oral Oncol,2012,48(10):913
[32]Zhang S,Balch C,Chan MW,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J].Cancer Res,2008,68(11):4311
[33]Meng E,Long B,Sullivan P,et al.CD44+/CD24- ovarian cancer cells demonstrate cancer stem cell properties and correlate to survival[J].Clin Exp Metastasis,2012,29(8):939
[34]Ginestier C,Hur MH,Charafe-Jauffret E,et al.ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome[J].Cell Stem Cell,2007,1(5):555
[35]Dubrovska A,Kim S,Salamone RJ,et al.The role of PTEN/Akt/PI3K signaling in the maintenance and viability of prostate cancer stem-like cell populations[J].Proc Natl Acad Sci U S A,2009,106(1):268
[36]Collins AT,Berry PA,Hyde C,et al.Prospective identification of tumorigenic prostate cancer stem cells[J].Cancer Res,2005,65(23):10946
[37]Hurt EM,Kawasaki BT,Klarmann GJ,et al.CD44+CD24(-) prostate cells are early cancer progenitor/stem cells that provide a model for patients with poor prognosis[J].Br J Cancer,2008,98(4):756
[38]Patrawala L,Calhoun T,Schneider-Broussard R,et al.Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells[J].Oncogene,2006,25(12):1696
[39]Hellsten R,Johansson M,Dahlman A,et al.Galiellalactone inhibits stem cell-like ALDH-positive prostate cancer cells[J].PLoS One,2011,6(7):e22118
[40]Rutella S,Bonanno G,Procoli A,et al.Cells with characteristics of cancer stem/progenitor cells express the CD133 antigen in human endometrial tumors[J].Clin Cancer Res,2009,15(13):4299
[41]Yao T,Chen Q,Zhang B,et al.The expression of ALDH1 in cervical carcinoma[J].Med Sci Monit,2011,17(8):HY21
[42]Su J,Xu XH,Huang Q,et al.Identification of cancer stem-like CD44+ cells in human nasopharyngeal carcinoma cell line[J].Arch Med Res,2011,42(1):15
[43]Zhao JS,Li WJ,Ge D,et al.Tumor initiating cells in esophageal squamous cell carcinomas express high levels of CD44[J].PLoS One,2011,6(6):e21419
[44]Huang SD,Yuan Y,Liu XH,et al.Self-renewal and chemotherapy resistance of p75NTR positive cells in esophageal squamous cell carcinomas[J].BMC Cancer,2009,9:9
[45]Takaishi S,Okumura T,Tu S,et al.Identification of gastric cancer stem cells using the cell surface marker CD44[J].Stem Cells,2009,27(5):1006
[46]Song W,Li H,Tao K,et al.Expression and clinical significance of the stem cell marker CD133 in hepatocellular carcinoma[J].Int J Clin Pract,2008,62(8):1212
[47]Ma S,Chan KW,Hu L,et al.Identification and characterization of tumorigenic liver cancer stem/progenitor cells[J].Gastroenterology,2007,132(7):2542
[48]Yang ZF,Ngai P,Ho DW,et al.Identification of local and circulating cancer stem cells in human liver cancer[J].Hepatology,2008,47(3):919
[49]Dalerba P,Dylla SJ,Park IK,et al.Phenotypic characterization of human colorectal cancer stem cells[J].Proc Natl Acad Sci USA,2007,104(24):10158
[50]Ricci-Vitiani L,Lombardi DG,Pilozzi E,et al.Identification and expansion of human colon-cancer-initiating cells[J].Nature,2007,445(7123):111
[51]Du L,Wang H,He L,et al.CD44 is of functional importance for colorectal cancer stem cells[J].Clin Cancer Res,2008,14(21):6751
[52]Carpentino JE,Hynes MJ,Appelman HD,et al.Aldehyde dehydrogenase-expressing colon stem cells contribute to tumorigenesis in the transition from colitis to cancer[J].Cancer Res,2009,69(20):8208
[53]Hermann PC,Huber SL,Herrler T,et al.Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer[J].Cell Stem Cell,2007,1(3):313
[54]Li C,Heidt DG,Dalerba P,et al.Identification of pancreatic cancer stem cells[J].Cancer Res,2007,67(3):1030
[55]Bussolati B,Bruno S,Grange C,et al.Identification of a tumor-initiating stem cell population in human renal carcinomas[J].FASEB J,2008,22(10):3696
[56]Jones RJ,Gocke CD,Kasamon YL,et al.Circulating clonotypic B cells in classic Hodgkin lymphoma[J].Blood,2009,113(23):5920
[57]Cheung AM,Wan TS,Leung JC,et al.Aldehyde dehydrogenase activity in leukemic blasts defines a subgroup of acute myeloid leukemia with adverse prognosis and superior NOD/SCID engrafting potential[J].Leukemia,2007,21(7):1423
[58]Jin L,Hope KJ,Zhai Q,et al.Targeting of CD44 eradicates human acute myeloid leukemic stem cells[J].Nat Med,2006,12(10):1167
[59]Yamazaki H,Nishida H,Iwata S,et al.CD90 and CD110 correlate with cancer stem cell potentials in human T-acute lymphoblastic leukemia cells[J].Biochem Biophys Res Commun,2009,383(2):172
[60]Mitra M,Kandalam M,Harilal A,et al.EpCAM is a putative stem marker in retinoblastoma and an effective target for T-cell-mediated immunotherapy[J].Mol Vis,2012,18:290
[61]Eramo A,Lotti F,Sette G,et al.Identification and expansion of the tumorigenic lung cancer stem cell population[J].Cell Death Differ,2008,15(3):504
[62]Dou J,Pan M,Wen P,et al.Isolation and identification of cancer stem-like cells from murine melanoma cell lines[J].Cell Mol Immunol,2007,4(6):467
[63]Monzani E,Facchetti F,Galmozzi E,et al.Melanoma contains CD133 and ABCG2 positive cells with enhanced tumourigenic potential[J].Eur J Cancer,2007,43(5):935
[64]Civenni G,Walter A,Kobert N,et al.Human CD271-positive melanoma stem cells associated with metastasis establish tumor heterogeneity and long-term growth[J].Cancer Res,2011,71(8):3098
[65]Tirino V,Desiderio V,d’Aquino R,et al.Detection and characterization of CD133+ cancer stem cells in human solid tumours[J].PLoS One,2008,3(10):e3469
[66]Wang L,Park P,Zhang H,et al.Prospective identification of tumorigenic osteosarcoma cancer stem cells in OS99-1 cells based on high aldehyde dehydrogenase activity[J].Int J Cancer,2011,128(2):294
[67]Suva ML,Riggi N,Stehle JC,et al.Identification of cancer stem cells in Ewing’s sarcoma[J].Cancer Res,2009,69(5):1776
[68]Yunoue S,Arita K,Kawano H,et al.Identification of CD133+ cells in pituitary adenomas[J].Neuroendocrinology,2011,94(4):302
[69]Prince ME,Sivanandan R,Kaczorowski A,et al.Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma[J].Proc Natl Acad Sci U S A,2007,104(3):973
[70]Clay MR,Tabor M,Owen JH,et al.Single-marker identification of head and neck squamous cell carcinoma cancer stem cells with aldehyde dehydrogenase[J].Head Neck,2010,32(9):1195
[71]Steffensen KD,Alvero AB,Yang Y,et al.Prevalence of epithelial ovarian cancer stem cells correlates with recurrence in early-stage ovarian cancer[J].J Oncol,2011,2011:620523
[72]Silva IA,Bai S,McLean K,et al.Aldehyde dehydrogenase in combination with CD133 defines angiogenic ovarian cancer stem cells that portend poor patient survival[J].Cancer Res,2011,71(11):3991
[73]Marcato P,Dean CA,Pan D,et al.Aldehyde dehydrogenase activity of breast cancer stem cells is primarily due to isoform ALDH1A3 and its expression is predictive of metastasis[J].Stem Cells,2011,29(1):32
[74]Curley MD,Garrett LA,Schorge JO,et al.Evidence for cancer stem cells contributing to the pathogenesis of ovarian cancer[J].Front Biosci,2011,16:368
[75]Vaiopoulos AG,Kostakis ID,Koutsilieris M,et al.Colorectal cancer stem cells[J].Stem Cells,2012,30(3):363
[76]Bao S,Wu Q,McLendon RE,et al.Glioma stem cells promote radioresistance by preferential activation of the DNA damage response[J].Nature,2006,444(7120):756
[77]Frank NY,Margaryan A,Huang Y,et al.ABCB5-mediated doxorubicin transport and chemoresistance in human malignant melanoma[J].Cancer Res,2005,65(10):4320
[78]Jang JY,Kim MK,Jeon YK,et al.Adenovirus adenine nucleotide translocator-2 shRNA effectively induces apoptosis and enhances chemosensitivity by the down-regulation of ABCG2 in breast cancer stem-like cells[J].Exp Mol Med,2012,44(4):251
[79]Cheng C,Liu ZG,Zhang H,et al.Enhancing chemosensitivity in ABCB1- and ABCG2-overexpressing cells and cancer stem-like cells by an aurora kinase inhibitor CCT129202[J].Mol Pharm,2012,Jun 13[Epub ahead of print]
[80]Eyler CE,Rich JN.Survival of the fittest:cancer stem cells in therapeutic resistance and angiogenesis[J].J Clin Oncol,2008,26(17):2839
[81]Ding XW,Wu JH,Jiang CP.ABCG2:a potential marker of stem cells and novel target in stem cell and cancer therapy[J].Life Sci,2010,86(17/18):631
[82]Singh S,Srivastava SK,Bhardwaj A,et al.CXCL12-CXCR4 signalling axis confers gemcitabine resistance to pancreatic cancer cells:a novel target for therapy[J].Br J Cancer,2010,103(11):1671
[83]Visus C,Wang Y,Lozano-Leon A,et al.Targeting ALDH(bright) human carcinoma-initiating cells with ALDH1A1-specific CD8(+) T cells[J].Clin Cancer Res,2011,17(19):6174
[84]Ning N,Pan Q,Zheng F,et al.Cancer stem cell vaccination confers significant antitumor immunity[J].Cancer Res,2012,72(7):1853
[85]Shmelkov SV,Butler JM,Hooper AT,et al.CD133 expression is not restricted to stem cells,and both CD133+ and CD133- metastatic colon cancer cells initiate tumors[J].J Clin Invest,2008,118(6):2111

