胃腺癌组织中SLP-2的表达及其对SGC7901细胞增殖能力的影响
张 剑,李建生,吴 敏,赵 晔,张自森
1)郑州大学第一附属医院消化内科 郑州450052 2)郑州大学第五附属医院肿瘤科 郑州 450052
胃癌是世界上最为常见的恶性肿瘤之一,居男性恶性肿瘤发病率的第3位,女性恶性肿瘤发病率的第4位。包括中国在内的东亚地区是世界上胃癌发病率和病死率最高的地区[1],其病理学类型主要为腺癌。肿瘤的发生是涉及多基因、多分子水平变化、多阶段的一个复杂过程,而癌基因的激活和抑癌基因的失活是该过程的重要事件之一。SLP-2基因是stomatin基因超家族的成员[2],其具体特性和功能尚未查明。中国医学科学院张立勇等[3]首次发现SLP-2基因在食管鳞状细胞癌中的表达水平是正常食管黏膜中的6倍以上,并发现其与肿瘤的发生发展关系密切。作者采用免疫组化法检测人胃腺癌组织中SLP-2的表达,并观察小干扰RNA(small interfering RNA,siRNA)沉默胃腺癌SGC7901细胞株中SLP-2的表达后,SGC7901细胞增殖能力的改变,探讨SLP-2在胃腺癌中的表达特点及其与胃腺癌发生发展的关系。
1 材料与方法
1.1胃腺癌及配对组织收集郑州大学第五附属医院2010年5月至2011年4月手术切除胃癌标本45例,取癌组织及癌旁正常组织(距离癌组织边缘>5 cm)。所有标本均经病理学检查确诊为胃腺癌,患者术前未接受过放、化疗。其中男27例,女18例;年龄45~78岁,中位年龄63岁。临床分期按TNM分期标准(AJCC 2010年第7版)。
1.2SLP-2蛋白表达的免疫组化检测所有组织均用体积分数10%福尔马林溶液固定,经脱水、包埋、3 μm厚连续切片。鼠抗人SLP-2单克隆抗体购自美国Proteintech Group公司(按200倍稀释)。即用型一步法(非生物素)检测试剂盒购自福州迈新生物技术开发有限公司。操作步骤按试剂盒说明书进行。用PBS代替一抗作阴性对照,用已知阳性片作阳性对照。免疫组化染色由两位高年资病理科医师在双盲条件下进行评定,判定标准参照文献[4],每张切片根据阳性细胞染色程度及细胞阳性百分数进行分级。染色程度根据每张切片的大多数细胞染色特征决定:细胞膜及细胞质无着色为0分,浅黄色为1分,黄色为2分,棕黄色为3分。阳性细胞百分数:无阳性细胞为0分,1%~为1分,26%~为2分,51%~为3分,>75%为4分。两项评分相乘,总值≥8分为阳性表达,<8分为阴性表达。
1.3SGC7901细胞中SLP-2mRNA表达的检测
1.3.1 SGC7901细胞的培养 用含体积分数10%胎牛血清、100 U/mL青霉素、0.1 g/L链霉素的RPMI 1640培养液于37 ℃、体积分数5% CO2培养箱中培养人中分化胃腺癌SGC7901细胞系(购自上海中国科学院典型培养物保藏委员会细胞库),4~6 d传代1次,选用对数生长期细胞进行实验。
1.3.2 SLP-2 mRNA检测 SLP-2及内参β-actin扩增引物由上海生工生物工程有限公司设计合成。SLP-2上游引物序列5’- CTGGAGCCTGGTTTGAAC AT-3’,下游引物序列5’- AGGATCTGGGCCTGT TTCTT-3’,产物大小为500 bp。β-actin上游引物序列5’- ACACTGTGCCCATCTACGACC-3’,下游引物序列5’-AGGGGCCGGACTCGTCATAGA-3’,产物大小为242 bp。按照TRIzol试剂盒(美国Invitrogen公司产品)说明书提取细胞总RNA。PCR反应体系: 2×Taq PCR MasterMix 12.5 μL,β-actin上、下游引物各1 μL,SLP-2上、下游引物各1 μL,cDNA 2 μL,ddH2O补至25 μL。PCR反应条件:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 50 s,共30个循环;最后72 ℃延伸7 min。取扩增产物进行15 g/L琼脂糖凝胶电泳,凝胶成像仪扫描电泳条带,以SLP-2与β-actin条带灰度值的比值表示SLP-2 mRNA的相对表达水平。
1.4siRNA转染对SGC7901细胞增殖的影响SLP-2 siRNA序列由上海吉玛公司设计合成,Sense:5’- UGCUGCCUGAUUUAUCUGUUCAGCC-3’,Antisense:5’-GGCUGAACAGAUAAAUCAGGCAGCA-3’。细胞按5×104个/孔接种于24孔板上,参考LipofectamineTM2000 说明书进行转染。实验设阴性对照组和空白对照组。转染后24、48、72和96 h各取1块24孔板,每孔加入200 μL(5 g/L) MTT,置于37 ℃、体积分数5%CO2培养箱中培养4 h。弃MTT,每孔加入200 μL二甲基亚砜(DMSO),酶标仪(Bio-Rad)测定490 nm处的光密度值。
1.5siRNA转染对SGC7901细胞周期的影响转染48 h后收集siRNA转染组、阴性对照组和空白对照组细胞,参考文献[5]处理后,采用流式细胞仪检测细胞周期。实验中每组各设3个平行对照。
1.6统计学处理采用SPSS 16.0进行分析。应用McNemar检验比较2种组织中SLP-2蛋白表达的差异,应用χ2检验或校正χ2检验比较不同临床病理特征胃腺癌SLP-2蛋白表达的差异,应用单因素方差分析和LSD-t检验分析转染SLP-2 siRNA后SGC7901细胞增殖及细胞周期的变化。检验水准α=0.05。
2 结果
2.1癌旁正常胃黏膜及胃腺癌组织中SLP-2蛋白的表达见图1及表1。癌旁正常胃黏膜中SLP-2蛋白多呈低表达(图1A),而在胃腺癌组织中则多呈高表达(图1B)。胃腺癌和癌旁正常胃黏膜组织中SLP-2蛋白阳性表达率分别为68.9%(31/45)和26.7%(12/45),差异有统计学意义(χ2=15.429,P<0.001)。

表1 正常胃黏膜及胃腺癌组织中SLP-2蛋白的表达 例
2.2SLP-2蛋白表达与胃腺癌临床病理特征的关系见表2。
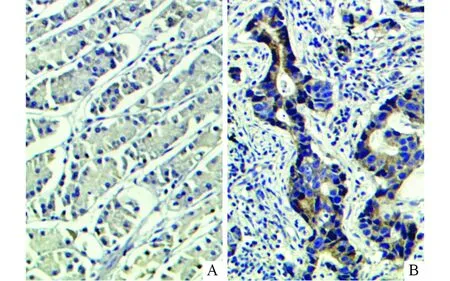
图1 正常胃黏膜(A)及胃腺癌(B)组织中SLP-2蛋白的表达(SP,×100)
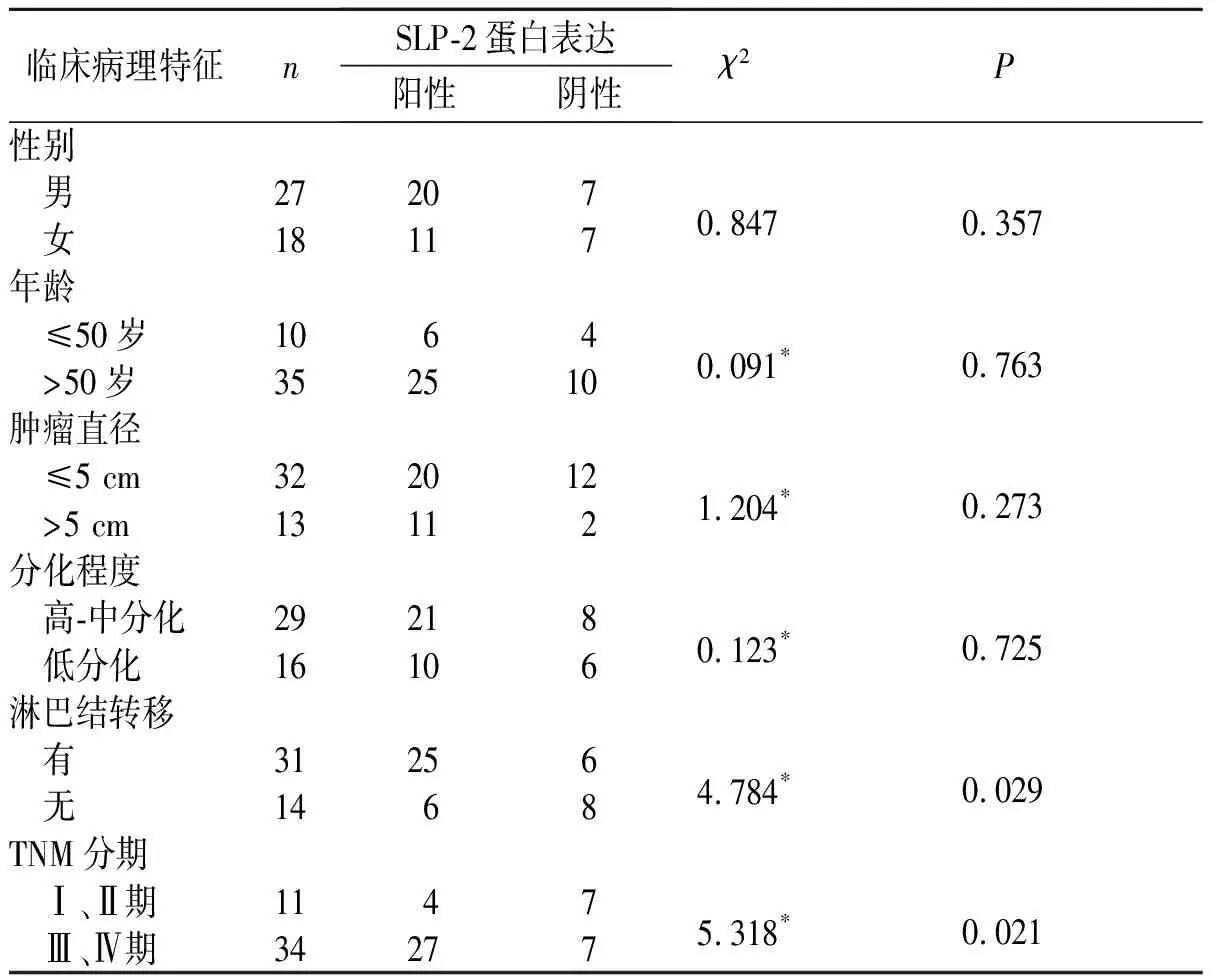
临床病理特征nSLP-2蛋白表达阳性阴性χ2P性别 男272070.8470.357 女18117年龄 ≤50岁10640.091 0.763 >50岁352510肿瘤直径 ≤5 cm3220121.204 0.273 >5 cm13112分化程度 高-中分化292180.123 0.725 低分化16106淋巴结转移 有312564.784 0.029 无1468TNM分期 Ⅰ、Ⅱ期11475.318 0.021 Ⅲ、Ⅳ期34277
:校正χ2检验。
2.3siRNA转染有效序列和时间点的确定见图2。结果显示,图2中的序列为有效序列,且转染后48 h后表达抑制率最高,表达降低幅度最大,因此该时间点被选做转染有效时间点。
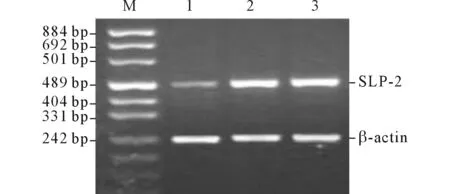
图2 SLP-2 siRNA转染48 h后各组SGC7901细胞中SLP-2 mRNA的表达
2.4SLP-2siRNA转染对SGC7901细胞增殖的影响见表3。SLP-2 siRNA转染组细胞与空白对照组和阴性对照组相比,增殖活性降低。
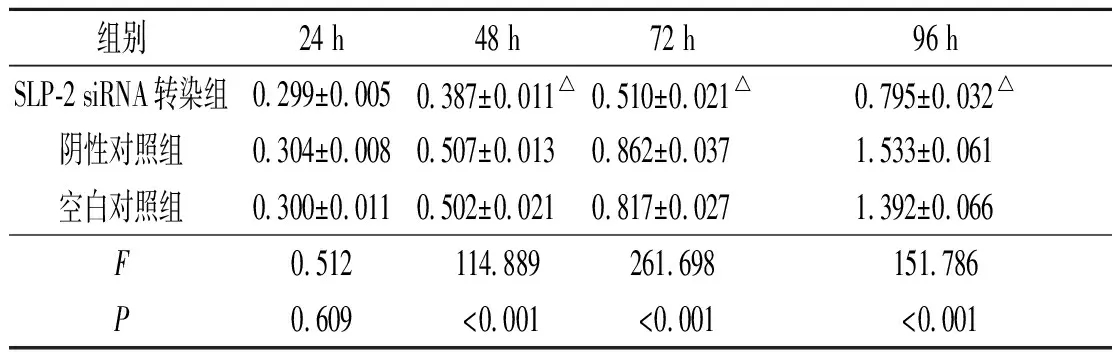
表3 3组SGC7901细胞增殖活性检测结果 (n=3)
△:分别与两对照组相比,P<0.01。
2.5SLP-2siRNA转染后细胞周期的变化见表4。

表4 3组SGC7901细胞的细胞周期变化 %
△:分别与两对照组相比,P<0.01。
3 讨论
SLP-2基因是2000年首次发现并命名的一个新基因,并在当时被鉴定为细胞膜相关蛋白[2]。近年来关于线粒体的蛋白组学研究发现,SLP-2存在于细胞的线粒体中[6],并与一些线粒体内膜相关蛋白直接结合,可能参与调节与其结合的线粒体膜相关蛋白的稳定性[7-8]。
张立勇等[3]首次发现SLP-2基因在食管鳞状细胞癌中过表达,并与肿瘤的发生﹑发展关系密切。此后的一些研究[9-14]表明,SLP-2基因在肺癌、子宫内膜癌、结直肠癌等恶性肿瘤中也存在高表达。作者的实验结果显示胃腺癌组织中SLP-2蛋白表达水平较癌旁正常胃黏膜组织明显升高,且晚期胃腺癌组织中的表达水平高于较早期癌组织,在有淋巴结转移的病例中表达水平高于无淋巴结转移的病例。
作者采用RNA干扰技术沉默SGC7901细胞SLP-2的表达,结果表明,SLP-2基因沉默后,SGC7901细胞增殖活性降低,细胞被阻滞在G1期。
综上所述,SLP-2基因异常表达在胃腺癌的发生和发展中具有重要作用。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69
[2]Wang Y,Morrow JS.Identification and characterization of human SLP-2,a novel homologue of stomatin(band 7.2b) present in erythrocytes and other tissues[J].J Biol Chem,2000,275(11):8062
[3]张立勇,王涛,丁芳,等.SLP-2基因在食管鳞癌中的差异表达及其生物信息学分析[J].世界华人消化杂志,2004,12(7):1517
[4]Wang YQ,Cao WF,Yu ZC,et al.Downregulation of a mitochondria associated protein SLP-2 inhibits tumor cell motility,proliferation and enhances cell sensitivity to chemo-therapeutic reagents[J].Cancer Biol Ther,2009,8(17):1651
[5]张立勇,丁芳,刘仲敏,等.SLP-2基因反义核酸对食管鳞癌细胞系TE12生长和增殖的影响[J].癌症,2005,24(2):155
[6]Chevallet M,Lescuyer P,Diemer H,et al.Alterations of the mitochondrial proteome caused by the absence of mitochondrial DNA:A proteomic view[J].Electrophoresis,2006,27(8):1574
[7]Hājek P,Chomyn A,Attardi G.Identification of a novel mitochondrial complex containing mitofusin 2 and stomatin-like protein 2[J].J Biol Chem,2007,282(8):5670
[8]Da Cruz S,Parone PA,Gonzalo P,et al.SLP-2 interacts with prohibitins in the mitochondrial inner membrane and contributes to their stability[J].Biochim Biophys Acta,2008,1783(5):904
[9]苏雷,张建,魏秀琴,等.Slp2基因的差异表达与肺癌的分化和转移[J].中国肿瘤临床,2005,32(12):678
[10]Chang D,Ma K,Gong M,et al.SLP-2 overexpression is associated with tumor distant metastasis and poor prognosis in pulmonary squamous cell carcinoma[J].Biomarkers,2010,15(2):104
[11]冯旺琴,崔竹梅,刘芝华,等.SLP-2 mRNA在子宫内膜癌中的表达及其意义[J].中华妇产科杂志,2005,40(2):553
[12]祁代华,李建生,王康康.SLP-2和CDC42蛋白在结直肠癌组织中的表达及临床意义[J].中华消化杂志,2009,29(3):191
[13]曹文枫,张立勇,张斌,等.SLP-2蛋白在食管鳞状细胞癌中的表达及其与肿瘤侵袭转移的关系[J].中华肿瘤杂志,2010,32(11):830
[14]Cao W,Zhang B,Liu Y,et al.High-level SLP-2 expression and HER-2/neu protein expression are associated with decreased breast cancer patient survival[J].Am J Clin Pathol,2007,128(3):430

