子痫前期患者血浆对人脐静脉内皮细胞增殖及Edg4表达的影响
李留霞,李秀芳,张兰兰,张 毅
1)郑州大学第一附属医院妇产科;河南省高等学校临床医学重点学科开放实验室 郑州 450052 2)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 3)郑州大学生物工程系 郑州 450001
子痫前期(pre-eclampsia,PE)是指妊娠20周以后出现以高血压、蛋白尿为主要临床表现的一组临床综合征,发病率高达9.4%~10.4%[1],严重危害孕产妇和围产儿的生命安全,其病因及发病机制迄今尚未完全阐明。有研究[2]证实多数PE患者存在有血管内皮损伤及血液高凝状态。Sheppard等[3]认为患者血液中存在某种毒性物质导致血管内皮细胞损伤和凝血异常,但毒性物质的性质及来源仍不明确。有研究[4-5]报道PE患者血浆溶血磷脂酸(lysophosphotidic acid,LPA)水平明显升高,其胎盘组织中LPA受体内皮分化基因-4/7(endothelial differentiation gene-4/7,Edg4/7)表达明显升高,并与疾病的严重程度正相关,但LPA是否参与PE患者血管内皮细胞损伤以及损伤机制至今未见报道。作者观察了PE患者血浆对人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)增殖能力和Edg4蛋白、mRNA表达的影响。
1 材料与方法
1.1血浆的制备收集2011年10月至2012年3月在郑州大学第一附属医院就诊的PE患者40例,诊断标准参考乐杰主编的全国统编教材《妇产科学》(7版)[1]。轻度PE患者20例,年龄(30.5±4.8)岁,孕(36.7±2.5)周;重度20例,年龄(31.4±5.9)岁,孕(34.0±4.2)周;选取同期入院正常晚期孕妇20例,年龄(28.5±2.0)岁,孕(39.0±0.4)周;3组孕妇均无其他产科并发症及合并症。分别于产前采集静脉血,无菌条件下分离血浆,于-20 ℃保存备用。
1.2HUVEC的培养及实验分组HUVEC购于湘雅医学院细胞中心,使用含体积分数12%小牛血清的RPMI 1640培养液,于37 ℃、体积分数5%CO2恒温培养箱中孵育。细胞贴壁生长,呈铺路石样紧密排列。待生长至80%左右融合时用2.5 g/L胰蛋白酶消化、传代。收集对数生长期的细胞,以5×104mL-1密度接种于96孔板中,每孔200 μL,置于恒温培养箱培养,24 h后更换无血清RPMI 1640培养液,继续37 ℃孵育24 h,使细胞生长同步化。将细胞分为对照组、正常晚孕组、轻度PE组和重度PE组,分别加入等体积RPMI 1640培养液、含体积分数20%正常晚期孕妇血浆、20%轻度PE患者血浆和20%重度PE患者血浆的RPMI 1640培养液继续孵育48 h后,倒置相差显微镜下观察细胞形态,并进行以下各项指标检测。
1.3MTT比色法检测细胞增殖能力每个样本设3个复孔。每孔加入20 μL MTT孵育4 h,弃去培养液,每孔加入DMSO 100 μL,平板摇床振摇20 min,待结晶充分溶解后,酶标仪测490 nm波长处各孔的D值,计算细胞增殖抑制率(IR)。IR=(1-实验孔平均D值/对照孔平均D值)×100%。
1.4免疫细胞化学法检测Edg4蛋白各组细胞在24孔板中爬片后,采用免疫细胞化学SP法检测Edg4蛋白。一抗为兔抗人Edg4蛋白多克隆抗体(按1100稀释),购于Santa Cruz公司。二抗为山羊抗兔IgG抗体(按1100稀释)。以PBS代替一抗作为阴性对照。根据阳性细胞分布和细胞染色强度确定Edg4蛋白的表达水平。首先,高倍镜下选取5个视野,每个视野计数100个细胞,计算阳性细胞百分比,0%为0分,<25%为1分,25%~为2分,>50%为3分。再根据细胞染色强度计分:无染色或染色不清为0分,浅黄色为1分,棕黄色为2分,深黄色或褐色为3分。取以上两项的乘积:积分 0~1为阴性(-)表达;≥2分为阳性(+)表达。
1.5RT-PCR检测Edg4mRNA收集各组细胞(5~10)×106个,采用Trizol一步法提取总RNA,按逆转录试剂盒(加拿大Fermentas公司)说明书操作合成cDNA。以β-actin作为内参基因。根据GenBank中目的基因cDNA序列,由上海生工生物有限公司设计并合成PCR引物。Edg4上游引物序列:5’-GTCGAGCCTGCTTGTCTTC-3’,下游引物序列:5’-CCAGGAGCAGTACCACCTG-3’,产物大小为205 bp;β-actin上游引物序列:5’-CGGGAAATCGT GCGTGAC-3’,下游引物序列:5’-TGGAAGGTGGA CAGCGAGG-3’,产物大小为434 bp。扩增条件:94 ℃预变性3 min;94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸60 s,35个循环;72 ℃延伸5 min。PCR产物经15 g/L琼脂糖凝胶电泳分离,用Quantity软件对电泳图像进行分析。以目的基因与β-actin条带灰度值的比值作为目的基因mRNA的相对表达量。
1.6统计学处理用SPSS 17.0进行数据处理。4组Edg4蛋白阳性率的比较采用χ2检验,4组IR、Edg4 mRNA相对表达量的比较采用单因素方差分析,两两比较采用LSD-t检验法,检验水准α=0.05。
2 结果
2.1 4组细胞的形态PE组细胞培养48 h后,倒置相差显微镜下可见细胞形态由长梭形或多边形变为椭圆或圆形,细胞间隙加大,细胞排列变疏松(图1)。
2.2 4组细胞增殖能力测定结果PE组IR较正常晚孕组增大,重度PE组IR增大更明显,见表1。
2.3 4组细胞Edg4蛋白的检测结果Edg4蛋白主要表达于HUVEC的胞质和胞膜,镜下可见棕黄色颗粒由浅至深(图2)。4组Edg4蛋白表达比较,差异有统计学意义,病情越重,Edg4蛋白表达越强(表1)。
2.4 4组细胞Edg4mRNA的检测结果见图3和表1。PE组细胞Edg4 mRNA表达高于对照组和正常晚孕组,重度PE组高于轻度PE组。
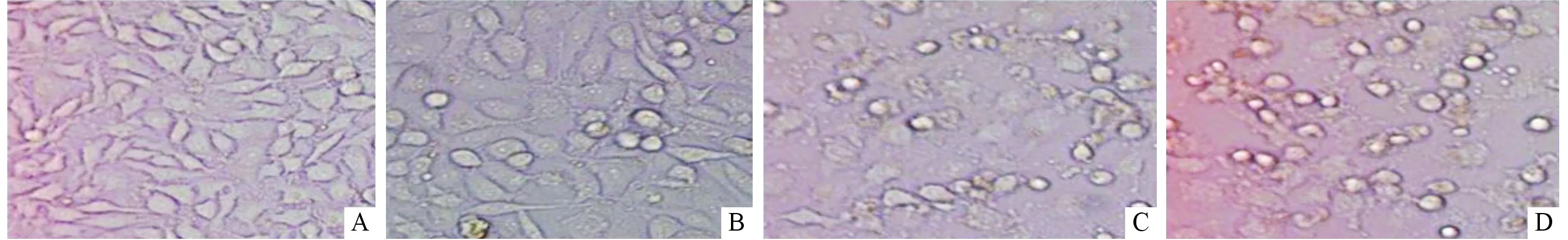
图1 倒置相差显微镜下4组细胞培养48 h后的形态(×200)

图2 4组细胞中Edg4蛋白的表达(SP,×400)

组别nIR/%Edg4蛋白/阳性例数Edg4 mRNA对照组200.00±0.00 30.176±0.013 正常晚孕组2016.13±5.9380.380±0.018轻度PE组2034.23±5.16∗160.787±0.017∗重度PE组2047.79±3.30∗#190.959±0.003∗#F/χ2104.20032.9415 803.360P<0.001<0.001<0.001
*与正常晚孕组比较,P<0.05;#与轻度PE组比较,P<0.05。
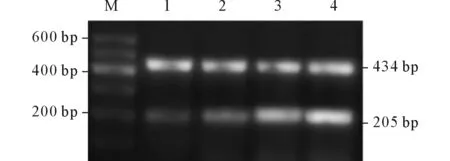
图3 4组细胞中Edg4 mRNA的表达
M:Marker;1:对照组;2:正常晚孕组;3:轻度PE组;4重度PE组。
3 讨论
PE是一种“多理论疾病”,其发病机制可能与血管内皮细胞损伤、凝血纤溶机制异常、免疫机制异常等有关[6-8],其中血管内皮细胞损伤和功能紊乱是引起该病一系列临床症状的重要病理生理学基础,也是疾病进展过程中的关键环节。在分子水平上,冯亚玲等[9]发现Rho-GDI在PE蜕膜组织中表达下调,通过调节血管平滑肌舒缩状态,参与PE的发生发展。刘大艳等[10]发现早发型与晚发型重度PE的发病机制可能不同。研究[11]证实多数PE患者存在血管内皮损伤及血液高凝状态。临床研究[12]显示,PE患者胎盘绒毛及血管内皮细胞变性坏死,存在动脉粥样硬化、管腔狭窄及血栓形成伴梗死,从形态学上肯定了重度PE患者内皮细胞损伤和血栓形成。
该研究分别用PE患者血浆及正常晚孕孕妇血浆干预HUVEC,通过观察内皮细胞形态和检测细胞增殖能力以评估PE患者血浆对内皮细胞功能的影响。结果显示,PE组细胞间隙加大,细胞排列变疏松,增殖能力明显受到抑制,即内皮细胞明显受到损伤,重度PE组较轻度组损伤更为明显。据此推测,PE患者血浆中可能存在可溶性“毒性因子”,可使内皮细胞受损,且病情越重这种毒性物质的浓度越高。
LPA是一种具有细胞间信号传导作用的多功能磷脂分子,主要由活化的血小板产生[13],通过G蛋白偶联受体发挥多种生物学效应[14]。Edg2、4、7是其特异性高亲和受体,LPA与其受体结合后可以激活PI3K/Akt、Ras-MAPK及Rho等多条细胞信号转导通路,发挥促进蛋白合成、细胞骨架重建、细胞增殖及细胞凋亡等作用[15-16]。凝血功能改变和血栓前状态患者血液中LPA水平也明显升高,且阿司匹林治疗能有效降低其水平并降低血栓的发生,因此LPA被认为是中风和血栓前状态的敏感预警因子。当血液中LPA水平明显升高时,凝血过程开始启动,预示有血栓形成的可能[17-18]。
作者的前期研究[4-5]表明,整个妊娠过程中在母体血浆和胎盘组织中分别可检测到LPA及其受体Edg4、7蛋白的表达,但在PE患者血浆及胎盘组织中LPA和Edg4、7蛋白表达水平显著升高,并与病情轻重程度正相关,提示LPA及其受体Edg4、7的过度表达可能参与了PE的发生发展。LPA不仅能促进细胞增殖,也可促进细胞凋亡和线粒体损伤,参与氧化应激、免疫反应及炎症反应等过程[19]。该研究发现PE患者血浆可诱导HUVEC高表达Edg4蛋白、mRNA,抑制HUVEC的增殖能力,并且重度PE患者的血浆上述诱导作用更强。说明PE患者血浆LPA水平升高,Edg4活化,LPA水平升高及Edg4蛋白表达增高,可以增加血管内皮细胞通透性,损伤内皮细胞功能,促进血管平滑肌痉挛,导致血管形态改变。
总之,血浆LPA水平升高及Edg4活化可能是引起PE患者血管内皮损伤的原因之一,但是LPA是否就是血液中的毒性物质以及LPA其他受体的作用有待今后进一步研究。
[1]乐杰.妇产科学[M].7版.北京:人民卫生出版社,2008:94
[2]Vucic N,Frleta M,Petrovic D,et al.Thrombophilia,preeclampsia and other pregnancy complications[J].Acta Med Croatica,2009,63(4):297
[3]Sheppard SJ,Khalil RA.Risk factors and mediators of the vascular dysfunction associated with hypertension in pregnancy[J].Cardiovasc Hematol Disord Drug Targets,2010,10(1):33
[4]李留霞,张建好,王淼,等.妊娠期高血压疾病患者血浆溶血磷脂酸水平测定及其意义[J].中华妇产科杂志,2007,42(1):58
[5]李留霞,周蔚,乔玉环,等.妊娠期高血压疾病患者胎盘组织中溶血磷脂酸受体Edg4、7的表达及其意义[J].中华妇产科杂志,2007,42(6):386
[6]Wagner SJ,Barac S,Garovic VD.Hypertensive pregnancy disorders:current concepts[J].J Clin Hypertens,2007,9(7):560
[7]Farina A,Rapacchia G,Freni SA,et al.Prospetive evaluation of ultrasound and biochemical-based multivariable models for the prediction of late pre-eclampsia[J].Prenatal Diagn,2011,31(12):1147
[8]杨博萍,韩健,韩新美,等.重度子痫前期胎盘合体滋养细胞微绒毛膜脱落与Rho/ROCK分子表达的关系[J].解放军医学杂志,2012,37(3):190
[9]冯亚玲,梁小勤,周昌菊.Rho-GDI在子痫前期蜕膜组织中的表达及其意义[J].南方医科大学学报,2011,31(1):167
[10]刘大艳,陈士岭,王晨虹,等.早发型与晚发型重度子痫前期患者胎盘绒毛组织代谢足迹差异的研究[J].南方医科大学学报,2011,31(9):1547
[11]Pennings JL,Kuc S,Rodenburg W,et al.Integrative date mining to identify novel candidate serum biomarkers for pre-eclampsia screening[J].Prenatal Diagn,2011,31(12):1153
[12]敖礼,尚涛.血栓前状态与子痫前期[J].国际妇产科杂志,2009,36(3):207
[13]Xing Y,Ganji SH,Noh JW,et al.Cell density-dependent expression of EDG family receptors and mesangial cell proliferation:role in lysophosphatidic acid-mediated cell growth[J].Am J Physiol Renal Physiol,2004,287(6):F1250
[14]Choi JW,Herr DR,Noguchi K,et al.LPA receptors:subtypes and biological actions[J].Annu Rev Pharmacol Toxicol,2010,50:157
[15]Jeong KJ,Park SY,Cho KH,et al.The Rho/ROCK pathway for acid-induced proteolytic enzyme expression and ovarian cancer cell invasion[J].Oncogene,2012,31(39):4279
[16]Sengupta S,Wang Z,Tipps R,et al.Biology of LPA in health and disease[J].Semin Cell Dev Biol,2004,15(5):503
[17]王洪生.短暂性脑缺血发作患者血浆溶血磷脂酸水平变化及不同剂量阿司匹林治疗效果研究[J].中国医药导报,2011,8(31):62
[18]Teo ST,Yung YC,Herr DR,et al.Lysophosphatidic acid in vascular development and disease[J].IUBMB Life,2009,61(8):791
[19]Kato K,Fukui R,Okabe K,et al.Constitutively active lysophosphatidic acid receptor-1 endances the induction of matrix metalloproteinase-2[J].Biochem Biaphys Res Commun,2012,417(2):790

