四种呋喃香豆素类药物与溶菌酶的作用机制及构效关系研究
宋志英,韩 冬,王 娟,仝月菊,高晓亚,文 雯,张爱平
(山西医科大学 药学院,山西 太原 030001)
溶菌酶(LYSO)是一种作用于微生物细胞壁的小分子碱性蛋白[1],能与许多内、外源性物质结合,行使其抗菌、消炎和抗病毒等诸多的生物功能[2-4],被广泛应用于医药和食品等领域。LYSO是药物发挥药效的一种重要载体,因而常被用作研究药物小分子与蛋白相互作用的模型蛋白[5]。
中药补骨脂具有补肾壮骨、升达脾胃及纳气止泻的功效[6]。其主要有效成分有补骨脂素(Psoralen,PSO)、异补骨脂素(Isopsoralen,ISO)、5-甲氧基补骨脂素(5-Methoxypsoralen,5-MOP)和8-甲氧基补骨脂素(8-Methoxypsoralen,8-MOP)4种呋喃香豆素类药物(结构式如图1所示)。

图1 4种呋喃香豆素类药物的结构式Fig.1 The structure of four furanocoumarin drugs
呋喃香豆素类药物进入人体后首先与蛋白结合,然后到达靶组织,从而发挥其药理活性。呋喃香豆素类药物与蛋白的结合力决定其利用率及从循环系统向靶组织扩散的程度,呋喃香豆素类药物的药代动力学特性及毒性均会受到蛋白的显著影响与控制[7-8]。因此,研究呋喃香豆素类药物与蛋白的相互作用对了解呋喃香豆素类药物的作用机理及指导该类药物的临床合理用药等具有实际的应用价值[9-10]。
本文在模拟人体生理条件下,系统研究了4种呋喃香豆素类药物与LYSO的相互作用,探讨了其对LYSO的荧光猝灭作用机制,同时获得其与LYSO结合反应的结合参数及作用力类型;并通过对比4种呋喃香豆素类药物与LYSO的相互作用,探讨其间的构效关系。研究结果对于香豆素类药物的结构改造、开发利用及毒性机理研究等均具有重要意义[11-13]。
1 实验部分
1.1 仪器与试剂
Cary Eclipse荧光光度计(Peltier电子恒温装置,美国Varian公司);TU-1901紫外可见分光光度计(北京普析通用仪器有限责任公司);MOS 450型圆二色谱仪(法国Biologic公司);AL-104型电子天平(Mettler Toledo仪器(上海)有限公司);pHS-3C数字酸度计(上海雷磁仪器厂)。
补骨脂素、异补骨脂素、5-甲氧基补骨脂素和8-甲氧基补骨脂素均购自上海顺勃生物技术有限公司(纯度均大于98%);储备液(1.00×10-3mol·L-1)用无水乙醇(99.7%)配制。其它所用试剂均为分析纯。
Tris-HCl缓冲溶液(pH 7.4)用 0.20 mol·L-1的 Tris 和 0.10 mol·L-1盐酸配制,内含 0.1 mol·L-1的 NaCl溶液。
LYSO(美国,Sigma公司)储备液:准确称取0.069 8 g LYSO标准品,用pH 7.4的三羟基甲基氨基甲烷-盐酸(Tris-HCl)缓冲溶液配制,其储备液(1.00×10-4mol·L-1)于4℃下避光保存。
1.2 实验方法
1.2.1 紫外光谱的测定 在10 mL比色管中分别准确加入4.00 mL 1.00×10-4mol·L-1的溶菌酶溶液、不同体积的呋喃香豆素类药物溶液,用pH 7.4的Tris-HCl缓冲溶液定容至刻度,摇匀,差减相应浓度的4种呋喃香豆素类药物的光谱,在TU-1901紫外可见分光光度计上记录250~320 nm的紫外光谱。
1.2.2 荧光光谱的测定 在10 mL比色管中分别准确加入20 μL 1.00×10-4mol·L-1的溶菌酶溶液、不同体积的呋喃香豆素类药物的溶液,用pH 7.4的Tris-HCl缓冲溶液定容至刻度,摇匀,差减相应浓度的呋喃香豆素类药物的光谱,以280 nm为激发波长,扫描速度为1 200 nm· min-1,狭缝宽度皆为10 nm的Cary Eclipse荧光光度计绘制荧光光谱。
1.2.3 同步荧光光谱的测定 在10 mL比色管中分别准确加入1.00 mL 1.00×10-4mol·L-1的溶菌酶溶液、不同体积的呋喃香豆素类药物的溶液,用pH 7.4的Tris-HCl缓冲溶液定容至刻度,摇匀,差减相应浓度的呋喃香豆素类药物的光谱,在Δλ=60 nm下扫描荧光激发光谱,得到LYSO中色氨酸残基的同步荧光光谱。
1.2.4 圆二色谱(CD)的测定 在10 mL比色管中分别准确加入3.57 mL 1.00×10-4mol·L-1的溶菌酶溶液、不同体积的呋喃香豆素类药物的溶液,用pH 7.4的Tris-HCl缓冲溶液定容至刻度,摇匀,使用0.1 cm石英池,于室温下测定190~255 nm波长范围内LYSO与呋喃香豆素类药物作用前后的圆二色谱图。α-螺旋结构的含量根据208 nm处的摩尔椭圆率(Molar Ellipticity,MRE)值按如下公式进行计算[14-15]:
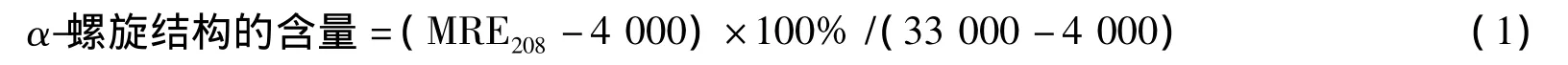
式(1)中:MRE208为208 nm处观测到的MRE值;4 000为208 nm处β-折叠和无规卷曲构象的MRE值;33 000为208 nm处纯α-螺旋结构的MRE值。
2 结果与讨论
2.1 呋喃香豆素类药物与LYSO的紫外吸收光谱
在室温下,固定LYSO的浓度,逐渐滴加呋喃香豆素类药物溶液,反应结束后,扫描体系的紫外光谱,差减相应浓度的补骨脂素、异补骨脂素、5-甲氧基补骨脂素和8-甲氧基补骨脂素溶液的光谱后,得到紫外差光谱,结果见图2。
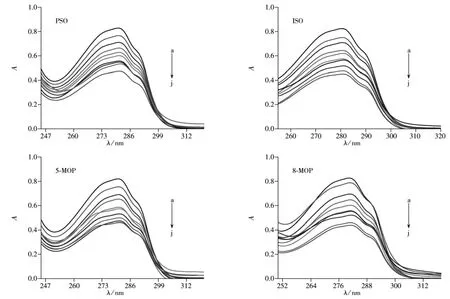
图2 4种呋喃香豆素类药物与LYSO相互作用的紫外吸收光谱图Fig.2 UV-absorption spectra of four furanocoumarin drugs and LYSO cLYSO=2.50 ×10-5mol·L-1;cPSO=cISO=c5-MOP=c8-MOP(a→j):0.00,0.909,1.67,2.31,4.74,2.86,3.33,3.75,4.12,4.44(×10 -5mol·L-1);pH 7.4;room temperature
由图2知,随着呋喃香豆素类药物溶液的逐渐滴加,LYSO在280 nm处的吸收均发生减色效应,表明反应前后其所处的微环境发生改变,初步推测4种呋喃香豆素类药物均与LYSO发生了相互作用。
根据 Scatchard 模型和公式[16-17]:
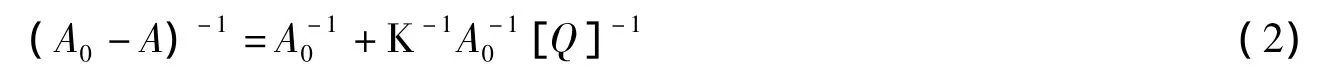
式(2)中A0和A分别表示蛋白和药物作用前后的紫外吸光强度,[Q]为药物的浓度,K为结合常数。以(A0-A)-1对[Q]-1作Lineweaver-Burk双倒数图。由该直线的斜率和截距,求得补骨脂素、异补骨脂素、5-甲氧基补骨脂素和8-甲氧基补骨脂素与LYSO的结合常数K分别为8.01×103、8.93×103、8.98×103、9.98×103L·mol-1,相关系数(r)分别为0.999 4、0.993 0、0.998 5和0.999 2。可知呋喃香豆素类药物与LYSO的结合强弱顺序依次为:8-甲氧基补骨脂素>5-甲氧基补骨脂素>异补骨脂素>补骨脂素。
2.2 荧光光谱法研究呋喃香豆素类药物与LYSO的相互作用
2.2.1 呋喃香豆素类药物对LYSO的荧光猝灭机制 固定LYSO溶液的浓度,以呋喃香豆素类药物的溶液对LYSO进行滴定,以280 nm为激发波长,在200~400 nm范围内扫描荧光发射光谱,结果见图3。本文所用荧光强度均为考虑稀释效应后的值。
由图3可知,随着呋喃香豆素类药物浓度的增加,LYSO的荧光发射峰强度均有规律地降低,进一步证实呋喃香豆素类药物均可与LYSO发生结合,进而猝灭LYSO的荧光。荧光猝灭主要分为动态猝灭和静态猝灭两类。动态猝灭是猝灭剂和荧光物质的激发态分子之间的相互作用过程,其作用过程遵循Stern -Volmer方程[18]:

式(3)中F0和F分别为溶菌酶和呋喃香豆素类药物相互作用前后的荧光强度,[Q]为呋喃香豆素类药物的浓度,KSV为Stern-Volmer动态猝灭常数,Kq为双分子速率猝灭常数,无猝灭剂时生物大分子的平均寿命 τ0取 10-8s[19]。
分别以F0/F对呋喃香豆素类药物浓度[Q]作图,所求得的KSV见表1。
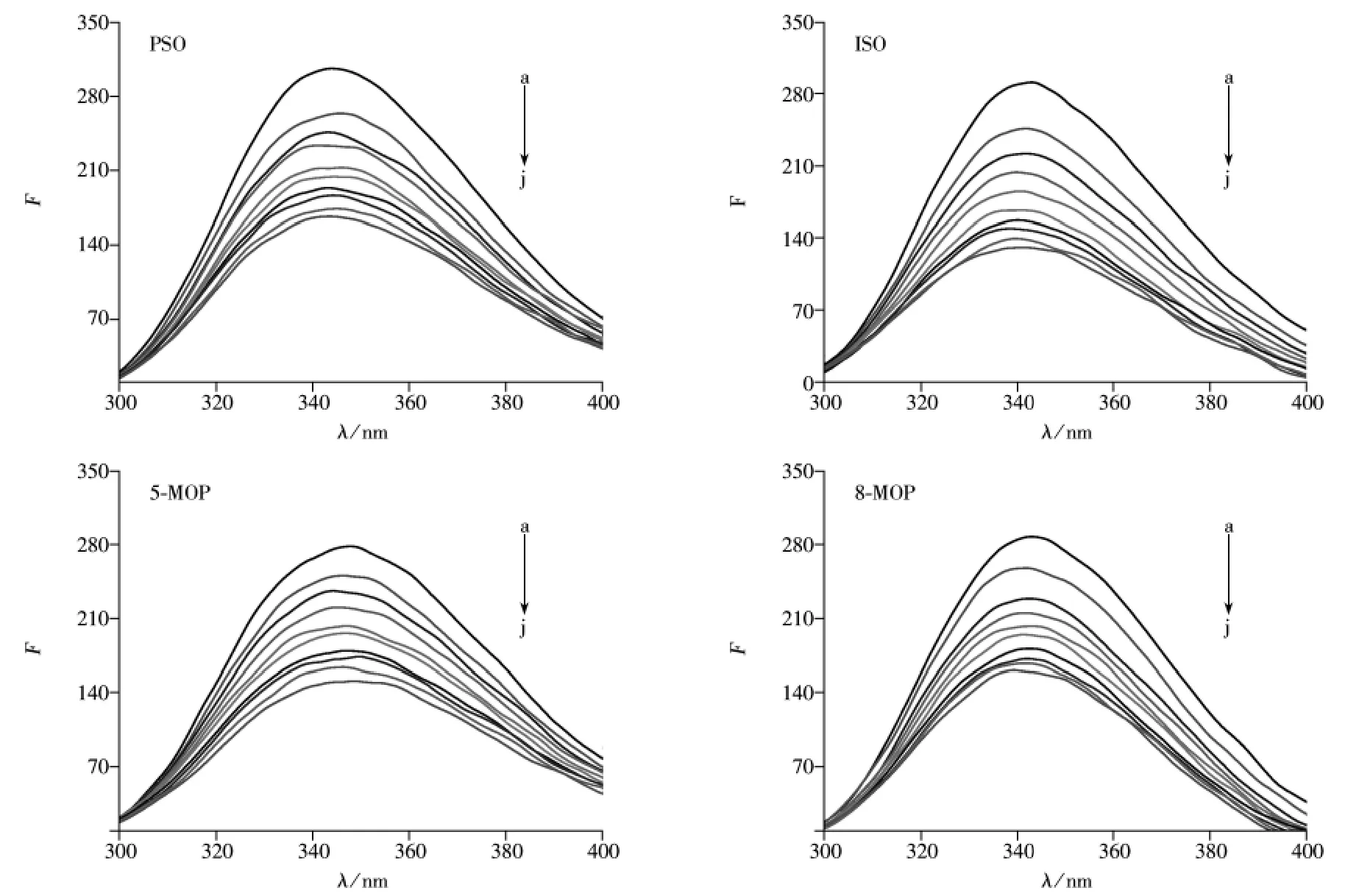
图3 4种呋喃香豆素类药物对LYSO荧光猝灭图Fig.3 Effect of four furanocoumarin drugs on fluorescence spectra of LYSO
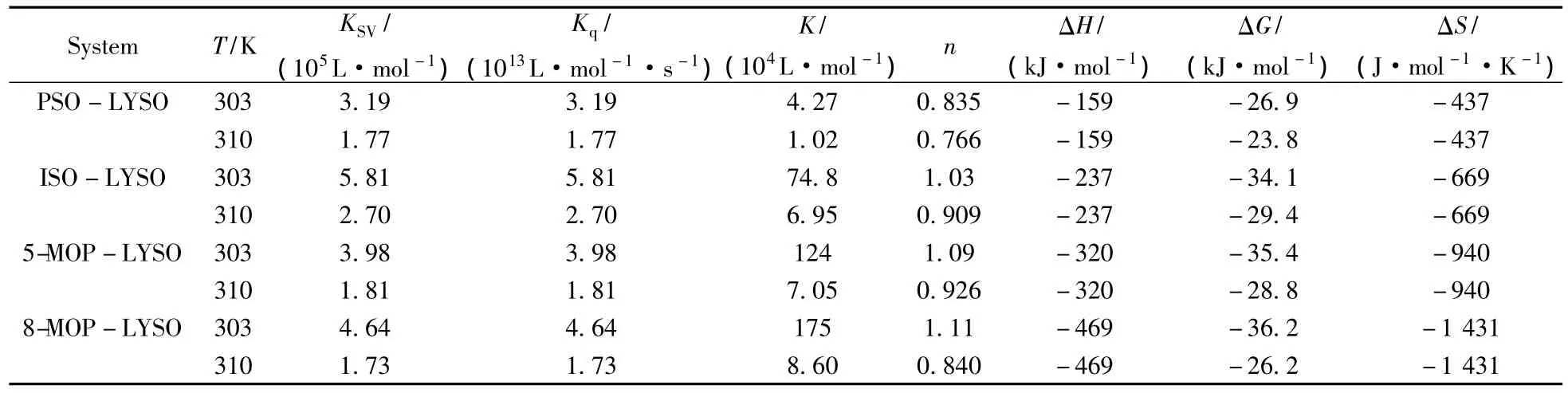
表1 4种呋喃香豆素类药物与LYSO作用的相关参数Table 1 Correlating parameters of interaction between four furancoumarin drugs and LYSO
表1结果表明,随着温度的升高,体系的动态猝灭常数逐渐降低,且4种呋喃香豆素类药物对LYSO的动态猝灭速率常数Kq均远大于各类猝灭剂对生物大分子的最大猝灭常数(2.0×1010L·mol-1·s-1)[19],据此判定4种呋喃香豆素类药物对LYSO的荧光猝灭机制均为静态猝灭。
2.2.2 呋喃香豆素类药物与LYSO的结合位点数及结合常数 在静态猝灭作用中,荧光强度与猝灭剂的关系由公式(4)表示[20]:

以lg(F0-F)/F对lg[Q]作双对数图,由双对数图中直线的斜率和截距可得4种呋喃香豆素类药物与LYSO的结合位点数n和结合常数K,结果见表1。由表1可知4种呋喃香豆素类药物与LYSO均存在一个结合位点,均与LYSO形成1∶1复合物。4种呋喃香豆素类药物与LYSO的结合常数不同,据此推测其与LYSO的相互作用强弱不同,其作用力顺序为:8-甲氧基补骨脂素>5-甲氧基补骨脂素>异补骨脂素>补骨脂素,这与紫外光谱结果相一致。
2.2.3 呋喃香豆素类药物与LYSO的结合距离 根据F ster偶极-偶极非辐射能量转移机制[21-23],结合LYSO的荧光光谱和4种呋喃香豆素类药物吸收光谱的重叠图(如图4所示),可求得4种呋喃香豆素类药物的吸收光谱与LYSO的荧光光谱的重叠积分值分别为4.16×10-14、8.36×10-14、1.99×10-13、4.33×10-13L·mol-1·cm3;非辐射转移效率E分别为0.117、0.136、0.172和0.083;临界能量转移距离R0分别为3.11、3.49、4.04、4.59 nm;补骨脂素、异补骨脂素、5-甲氧基补骨脂素和8-甲氧基补骨脂素与色氨酸残基之间的距离r分别为4.36、4.75、5.25、5.89 nm。由于r<7 nm,并且0.5 R0<r<1.5 R0,表明补骨脂素、异补骨脂素、5-甲氧基补骨脂素和8-甲氧基补骨脂素均与LYSO发生了非辐射能量转移,使LYSO荧光发生猝灭。
2.2.4 呋喃香豆素类药物与LYSO结合的热力学性质 药物与蛋白的作用力主要包括氢键、范德华力、静电引力和疏水作用力等。当温度变化范围不大时,作用过程的焓变ΔH随温度的改变可忽略不计,根据热力学参数之间的关系式[24]:

可分别得到不同温度下4种呋喃香豆素类药物与LYSO相互作用的焓变ΔH、熵变ΔS和生成自由能变ΔG。根据药物与蛋白相互作用的相关热力学参数,可以判断二者的作用力类型。若ΔH>0,ΔS<0,则分子间作用力主要为静电作用力和疏水作用力;若ΔH<0,ΔS<0,分子间作用力主要为范德华力和氢键;若ΔH<0,ΔS>0,则分子间作用力主要为静电作用力;若ΔH>0,ΔS>0,分子间作用力主要为疏水作用力[25]。
根据上述公式求得303 K和310 K下4种呋喃香豆素类药物与LYSO作用的热力学参数,结果见表1。由ΔH<0,ΔS<0,可知补骨脂素、异补骨脂素、5-甲氧基补骨脂素及8-甲氧基补骨脂素类药物与LYSO之间的作用力均为范德华力和氢键。
2.2.5 呋喃香豆素类药物对LYSO二级结构的影响 为了考察4种呋喃香豆素类药物与LYSO相互作用后对其二级结构的影响,在室温条件下,测定了LYSO和药物-LYSO体系的圆二色谱图(见图5)。
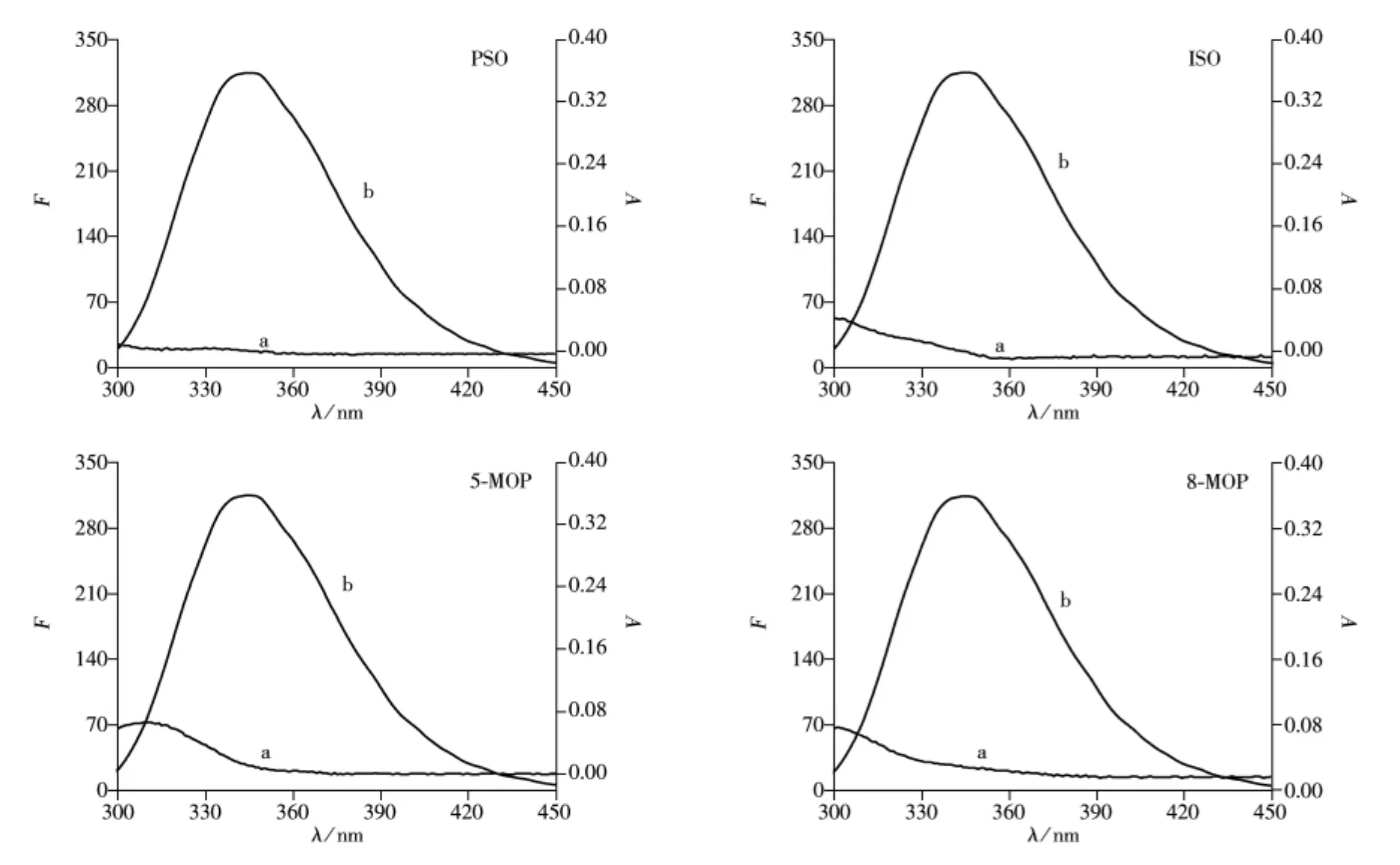
图4 303 K时4种呋喃香豆素类药物的吸收光谱(a)与LYSO的荧光光谱(b)重叠图Fig.4 Overlaps of the absorption spectra of four furanocoumarin drugs(a)and the fluorescence spectrum of LYSO(b)at 303 K
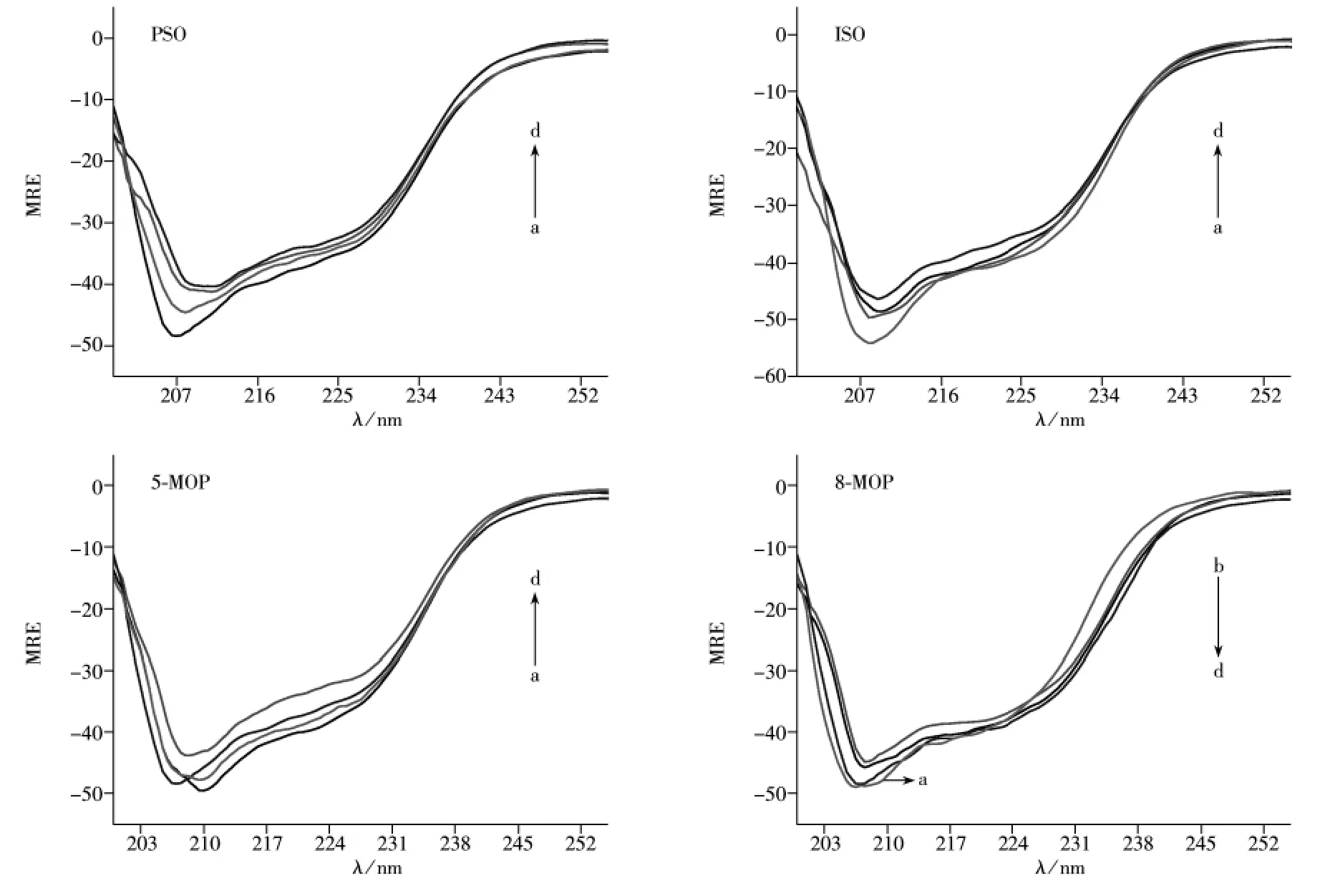
图5 4种呋喃香豆素类药物与LYSO的圆二色谱图Fig.5 Circular dichroism spectra of four furanocoumarin drugs with LYSO
由图5可知,LYSO的α-螺旋结构在208 nm和222 nm的紫外区出现2个负的特征肩峰谱带,这是LYSO中α-螺旋结构的特征峰[25]。随着呋喃香豆素类药物浓度的逐渐增加,LYSO峰强度均减小,表明4种呋喃香豆素类药物对LYSO的二级结构均有不同程度的影响。为了定量分析LYSO中α-螺旋结构的含量,对LYSO的圆二色光谱进行了分析,结果见表2。

表2 4种呋喃香豆素类药物对LYSO二级结构α-螺旋含量的影响Table 2 Effect of various concentrations of four furanocoumarin drugs on α-helix content of LYSO secondary structure
由表2可知,在游离态的LYSO中α-螺旋结构(规则的α-螺旋和不规则的α-螺旋)的含量为21.8%,当补骨脂素、异补骨脂素和5-甲氧基补骨脂素与LYSO的摩尔比由0∶1变至4∶1时,LYSO中α-螺旋结构的含量分别降至15.9%、19.3%和19.5%,推测可能是这3种呋喃香豆素类药物与LYSO中的氨基酸残基结合,破坏了LYSO中多肽链上的氢键,从而导致肽链变得疏松[26-27],使得LYSO的二级结构有所伸展。而8-甲氧基补骨脂素与LYSO的摩尔比由0∶1变至4∶1时,LYSO中α-螺旋结构的含量先降至20.4%后又升至21.6%,表明8-甲氧基补骨脂素在较低浓度时与LYSO中的氨基酸残基结合,导致肽链变得疏松;而较高浓度时则对LYSO的肽链影响较小。总之,4种药物的加入导致LYSO中α-螺旋结构的含量有不同程度的降低,分别降低了27.1%、11.5%、10.6%和0.917%。因此,4种呋喃香豆素类药物与LYSO相互作用后对LYSO的二级结构均产生不同程度的影响。
2.2.6 同步荧光光谱法研究呋喃香豆素类药物与LYSO的相互作用 固定LYSO的浓度,逐渐增加呋喃香豆素类药物溶液的浓度,固定Δλ=60 nm,可得LYSO中色氨酸残基的同步荧光光谱,结果见图6。
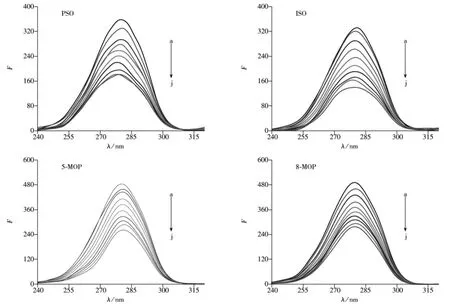
图6 4种呋喃香豆素类药物与LYSO作用的同步荧光光谱图Fig.6 Synchronous fluorescence spectra of the interaction between four furanocoumarin drugs with LYSO
由图6可知,随着4种呋喃香豆素类药物浓度的增加,LYSO中色氨酸残基的荧光发生了猝灭。补骨脂素的加入导致了LYSO中色氨酸残基的峰蓝移约2.0 nm,说明色氨酸残基所处环境的疏水性增强[26],故而导致LYSO的构象发生改变。由图6还可观察到,异补骨脂素的加入并未使得色氨酸残基的峰位发生变化,说明在加入异补骨脂素的前后,色氨酸残基周围的疏水性环境并未发生改变。而5-甲氧基补骨脂素和8-甲氧基补骨脂素分别使LYSO中的色氨酸峰红移约1.5 nm和1.0 nm,说明这两种药物的加入均降低了色氨酸残基所处环境的疏水性,导致LYSO构象发生改变。实验结果表明,补骨脂素、5-甲氧基补骨脂素和8-甲氧基补骨脂素与LYSO相互作用后均对LYSO的构象产生影响,而异补骨脂素则对LYSO的构象影响较小。
2.2.7 呋喃香豆素类药物与LYSO的相互作用及其构效关系 上述研究结果表明,4种呋喃香豆素类药物与LYSO均发生结合,呋喃环和甲氧基位置的不同导致了4种呋喃香豆素类药物与LYSO的作用强弱不同,其作用力顺序依次为8-甲氧基补骨脂素>5-甲氧基补骨脂素>异补骨脂素>补骨脂素。
通过分析4种呋喃香豆素类药物的分子结构,表明由于呋喃环位置的不同导致异补骨脂素分子的偶极矩不同,而偶极矩越大,药物分子与溶菌酶的作用力则越强[28]。此外,呋喃环与香豆素母核相比其平面刚性特征较弱,会呈现不同的空间取向,进而影响其空间构象及与溶菌酶的相互作用[29]。因此异补骨脂素中的呋喃环的位置更有利于香豆素母核与LYSO发生相互作用。此研究结果与何文英等[6]报道的补骨脂素与异补骨脂素键合人血清白蛋白相互作用的结果不同,推测可能是蛋白的种属差异所致。
甲氧基的引入增大了呋喃香豆素母核分子的脂溶性,有利于呋喃香豆素母核与LYSO的结合;另外,-OCH3是给电子基团,它的引入使呋喃香豆素母核上的电子云密度增大,故增强了呋喃香豆素母核中酮基与LYSO中氨基酸残基之间形成的分子间氢键。因此,5-甲氧基补骨脂素和8-甲氧基补骨脂素与LYSO结合的能力较补骨脂素强。而甲氧基位置的不同又导致8-甲氧基补骨脂素与LYSO的结合较5-甲氧基补骨脂素强。这是因为8位较5位的甲氧基更能增大2位酮基的电子云密度[30],且8位较5位的甲氧基对呋喃香豆素母核与LYSO形成氢键的空间位阻较小。
本文研究结果表明,对呋喃香豆素母核进行一定的化学修饰,可以增强呋喃香豆素类药物与LYSO的结合力,使香豆素类药物在血浆中的贮留时间相应延长,释放更缓慢,从而提高呋喃香豆素类药物的临床药效,同时减少其毒副作用的发生,此结果为临床药代动力学和药效学的研究提供了一定的实验依据和理论指导[31]。此外呋喃环和甲氧基位置的不同导致了4种呋喃香豆素类药物与LYSO的作用强弱不同,这对于呋喃香豆素类药物的开发利用具有指导意义。
3 结论
本文在模拟人体生理条件下,采用紫外光谱、荧光光谱、同步荧光光谱及圆二色谱法研究了补骨脂素、异补骨脂素、5-甲氧基补骨脂素和8-甲氧基补骨脂素与LYSO相互作用的光谱行为。结果表明:4种物质对LYSO的内源荧光均存在显著的猝灭作用,且猝灭机制主要为静态猝灭和非辐射能量转移。4种呋喃香豆素类药物均可与LYSO形成1∶1复合物,以范德华力和氢键作用力为主。4种呋喃香豆素类药物分子结构中呋喃环和甲氧基位置的不同导致了4种药物与LYSO作用力强弱的不同,其作用力顺序依次为8-甲氧基补骨脂素>5-甲氧基补骨脂素>异补骨脂素>补骨脂素。本文结果阐明了该类药物的构效关系,为呋喃香豆素类药物的临床药代动力学和药效学研究及该类药物的开发利用等提供了一定的实验依据和理论指导。
[1]Dong W X,Liu S X,Zhong D,Wang T.Central South Pharmacy(董卫星,刘淑鑫,钟丹,王霆.中南药学),2012,10(1):58-61.
[2]Zhang G W,Zhao N,Li W B,Hu X.J.Nanchang Univ.:Nat.Sci.(张国文,赵楠,李蔚博,胡兴.南昌大学学报(理科版)),2009,33(4):350-353.
[3]Bukharin O V,Valyshev A V.Zh.Mikrobiol.Epidemiol.Immunobiol.,2006,(4):8-13.
[4]Ding F,Zhao G Y,Huang J L,Sun Y,Zhang L.Eur.J.Med.Chem.,2009,44(10):4083 -4089.
[5]Lu D M,Wang T.Guangdong Pharm.J.(卢冬梅,王霆.广东药学),2005,15(5):62-64.
[6]He W Y,Yao X J,Hu Z D,Chen G Y.Chem.J.Chin.Univ.(何文英,姚小军,胡之德,陈光英.高等学校化学学报),2010,5(31):911-918.
[7]Adachi K,Watarai H.Anal.Chem.,2006,78(19):6840-6846.
[8]Shahabadi N,Maghsudi M,Kiani Z,Pourfoulad M.Food Chem.,2011,124(3):1063-1068.
[9]Liu J Q,Tian J N,Hu Z D,Chen X G.Biopolymers,2004,73(4):443 -450.
[10]Ge F,Chen C Y,Liu D Q,Han B Y,Xiong X F,Zhao S L.J.Lumin.,2010,130(1):168-173.
[11]Paul B K,Samanta A,Guchhait N.J.Phys.Chem.B,2010,114(18):6183-6196.
[12]Zhu R R,Ni Y N.Chem.Res.Appl.(朱瑞瑞,倪永年.化学研究与应用),2011,23(10):1281-1289.
[13]Nahid S,Maryam M.J.Mol.Struct.,2009,929(1/3):193 -199.
[14]Wang Y,Chen Y P,Zhang Y Z.Chem.Bioeng.(王洋,陈艳萍,张业中.化学与生物工程),2011,28(5):28-33.
[15]Yuan L L,Liu X,Zhang Y Z,Dai J.Chem.Bioeng.(苑莉莉,刘雄,张业中,戴捷.化学与生物工程),2012,29(4):18-22.
[16]Hao J,Zhang A P,Huang Q,Yang J Y,Zheng M D,Mao H S.J.Instrum.Anal.(郝娟,张爱平,黄茜,杨锦艳,郑茂东,毛红胜.分析测试学报),2010,29(11):1173-1179.
[17]Zhang A P,Huang Q,Hao J,Wen W,Gao X Y.J.Instrum.Anal.(张爱平,黄茜,郝娟,文雯,高晓亚.分析测试学报),2011,30(2):140-145.
[18]Tang R R,Tang C H,Tang C Q.J.Organomet.Chem.,2011,696(10):2040-2046.
[19]Sun Y,Wei S,Yin C,Liu L S,Hu C M,Zhao Y Y,Ye Y X,Hu X Y,Fan J.Bioorg.Med.Chem.Lett.,2011,21(12):3798-3804.
[20]Zhang H R,Li J P.Chem.Res.Appl.(张海荣,李金平.化学研究与应用),2012,24(3):375-379.
[21]Zhang H M,Xu Y Q,Zhou Q H,Wang Y Q.J.Photochem.Photobiol.B,2011,104(3):405-413.
[22]Bao G R,Ling X,Bo G R L T,Na R S.Chin.J.Anal.Lab.(宝贵荣,领小,博·格日勒图,娜日苏.分析试验室),2012,31(3):7-10.
[23]Xu J M,Tao H L,Gao J Y.J.Instrum.Anal.(徐金明,陶慧琳,高炅杨.分析测试学报),2008,27(2):181-184.
[24]Gao X Y,Wen W,Song Z Y,Zhang A P,Hao J,Huang Q.Acta Physico-Chim.Sin.(高晓亚,文雯,宋志英,张爱平,郝娟,黄茜.物理化学学报),2012,28(2):470-478.
[25]Li Y Q,Jia B X,Ji H W,Guo F G,Qi Y X.J.Instrum.Anal.(李玉琴,贾宝秀,冀海伟,郭丰广,齐永秀.分析测试学报),2009,28(5):544-549.
[26]Chang X J,Huang Y,He Q.Chem.Online(常希俊,黄艳,贺群.化学通报),2005,63(3):223-228.
[27]Xu X Y,Sun X J,Liu M,Sun D Z,Li L W.Thermochim.Acta,2010,501(1/2):46-49.
[28]Yang R,Chen X L,Li P,Qu L B.Chem.J.Chin.Univ.(杨冉,陈晓岚,李萍,屈凌波.高等学校化学学报),2006,27(9):1673-1676.
[29]Jiang Q J,Li W H,Zeng H P,Yang D Q.J.Hubei Univ:Nat.Sci.Ed.(蒋启军,李文辉,曾和平,杨定乔.湖北大学学报:自然科学版),2005,27(4):373-375,380.
[30]Guo W S,Guo F,Liu Q T.Acta Chim.Sin.(郭文生,郭放,刘祁涛.化学学报),2001,59(5):718-723.
[31]Liu X F,Li L,Fang Y.Acta Chim.Sin.(刘雪锋,李磊,方云.化学学报),2008,66(17):1967-1973.

