夏季苹果新梢生理指标与抗苹果绵蚜的关系
王西存,周洪旭,于 毅,程在全,张安盛,褚 栋,李丽莉
(1. 青岛农业大学农学与植物保护学院,山东省植物病虫害综合防控重点实验室,青岛 266109; 2. 山东省农业科学院植物保护研究所,济南 250100 3.云南省农业科学院生物技术与种质资源研究所,昆明 650223)
夏季苹果新梢生理指标与抗苹果绵蚜的关系
王西存1,2,周洪旭1,*,于 毅2,程在全3,张安盛2,褚 栋1,李丽莉2
(1. 青岛农业大学农学与植物保护学院,山东省植物病虫害综合防控重点实验室,青岛 266109;
2. 山东省农业科学院植物保护研究所,济南 250100 3.云南省农业科学院生物技术与种质资源研究所,昆明 650223)
研究苹果生理指标与其对苹果绵蚜 (EriosomalanigerumHausmann) 抗性的关系,为筛选培育抗性品种,实现持续有效治理苹果绵蚜提供依据。田间调查不同苹果品种对苹果绵蚜的抗性,测定比较各品种正常枝条生理指标,以及被苹果绵蚜危害后生理指标的变化。结果表明,正常枝条中可溶性糖(r=0.99)、蛋白质(r=0.86)含量与感蚜率呈正相关;氨基酸含量与感蚜率呈负相关(r=-0.96);酚类物质和4种酶活性与苹果感蚜率均不存在明显相关性。被害后昭锦108可溶性糖含量有所下降,红富士、金冠分别上升1.4%、7.0%;蛋白质、氨基酸、酚类物质含量均有所下降,其中红富士总酚含量明显下降,达23.5%,总酚下降率与感蚜率呈正相关(r=0.94);超氧化物歧化酶(Superoxide Dismutase, SOD)、过氧化氢酶(Catalase, CAT)活性均上升,其中CAT变化率与感蚜率存在相关性 (r=-0.92),昭锦108 CAT活性明显上升,达91.2%;多酚氧化酶(Polyphenol Oxidase, PPO)、过氧化物酶(Peroxidase, POD)活性增减不一;金冠4种酶活性均上升。研究表明,对苹果绵蚜抗性较强的品种:可溶性糖、蛋白质含量较低,游离氨基酸含量较高;受害后可溶性糖含量下降,总酚含量下降率较低,游离氨基酸含量下降率较高。酶活性对抗蚜性的影响不明显。
苹果绵蚜;苹果品种;生理指标;抗性
苹果绵蚜EriosomalanigerumHausmann属于半翅目Hemiptera瘿绵蚜科Pemphigida,是一种重要害虫[1]。1787年最先于美国发现,1801年传入欧洲,现在已扩散到世界各苹果产区[2]。我国于1914年传入山东威海,后又扩散到烟台、昆明、河南、西藏等地[3]。苹果绵蚜能危害地上部和地下部,在地上部一开始主要危害剪锯口、伤疤、叶腋等部位,随着季节变化,会逐渐侵害新梢[4],甚至危害果实,造成果树减产[5]。地下部危害树根,而且造成更严重的伤害[6],能导致树体枯死[7- 8]。培育抗性品种能够从根本上解决害虫的危害,国外研究发现Raritan(力登)对苹果绵蚜抗性最强;Royal Gala(皇家嘎拉)、Court Pendu Plat属于敏感品种;Aotea、Winter Majetin、Twenty Ounce、Malus 6、IrishPeach、Colonel Vaughan具有部分抗性[1]。尹学伟等通过人工接种苹果绵蚜和对被害部位肿瘤进行石蜡切片的方法比较了富士、金帅和和昭锦108的抗性,发现昭锦108抗性为最强,其次为金帅,富士为最易感品种[9]。而从生理角度揭示抗性品种的特征,为抗性品种的选育以及实现对苹果绵蚜持续有效地防治提供依据,具有重要意义。本项目组前期工作研究表明,春梢生长期不同苹果生理指标与其对苹果绵蚜的抗性存在一定关系,其中可溶性糖含量与苹果绵蚜的选择性呈正相关,而且营养物质/糖的比例低可能有利于苹果绵蚜的危害,但游离氨基酸、酶活性与苹果树抗蚜的关系以及各物质含量与感蚜率的相关性均不甚明确[10],而且不同生长季节苹果枝条各物质含量对苹果绵蚜抗性是否有差异还有待于进一步研究。因此,本文在夏季进一步测定了苹果正常枝条以及危害加重后生理指标的变化差异,以明确不同抗性苹果生理指标与其对苹果绵蚜抗性的关系,确定抗性品种在不同生长季节的生理特征,为筛选培育抗苹果绵蚜品种提供理论依据。
1 材料与方法
1.1 田间调查
2011年,选择云南省昭通市的主栽品种,红富士、金冠、昭锦 108作为调查对象,于苹果夏季新梢生长期对苹果绵蚜发生率进行调查。分别在红富士、金冠、昭锦 108为主栽品种的16年生管理粗放的苹果园中,每个果园随机调查12棵树,记录感蚜株数,重复3次。根据以下公式计算感蚜率。
感蚜率(%)=(感蚜株数/调查总株数)×100%
1.2 供试材料
以调查果园作为供试果园,每个品种选取10棵树,剪取树体中下部被苹果绵蚜危害的1年生枝条,每个枝条约有10个虫落。另外,剪取健康的1年生枝条作为对照。洗净后用保鲜膜包裹放入干冰盒中,带回试验室剪短后立刻放进超低温冰箱中-70℃保存。
1.3 试验方法
可溶性糖的测定采用蒽酮比色法,氨基酸含量、SOD、CAT活性测定采用邹琦的方法[11],略有改动;总酚测定采用福林法[12]略有改动;PPO、POD活性测定采用郝建军的方法[13],略有改动,以上每个测定各重复4次。
1.4 数据处理
数据处理采用SPSS statistics 17.0数据处理软件,其中品种间差异采用邓肯新复极差检测单因素方差分析;同品种正常与被害枝条差异采用配对样本T检验;相关性采用双变量相关性分析。
2 结果
2.1 3种苹果品种的感蚜性调查比较
表13种苹果品种的感蚜性
Table1ThedamageoftheEriosomalanigerumHausmannonthethreecultivars
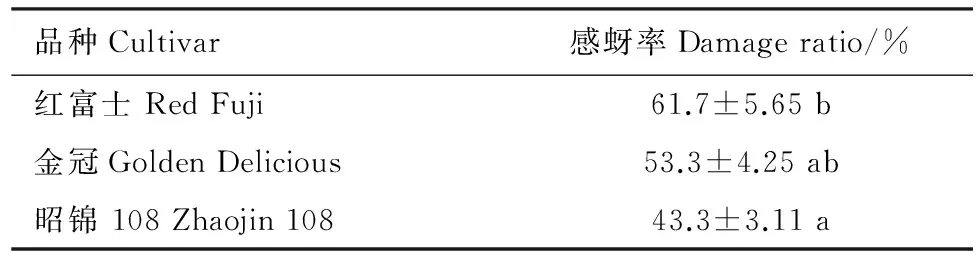
品种Cultivar感蚜率Damageratio/%红富士RedFuji61.7±5.65b金冠GoldenDelicious53.3±4.25ab昭锦108Zhaojin10843.3±3.11a
表中数据表示平均数±标准误差;同列数据后的不同小写字母表示差异显著 (Duncan′s新复极差测验,Plt;0.05)
田间调查发现,3个品种的感蚜率依次为:红富士61.7%、金冠53.3%、昭锦108 43.3%,易感程度依次为红富士gt;金冠gt;昭锦108与资料结果一致[9]。
2.2 不同苹果品种可溶性糖的含量
红富士、金冠等易感品种的正常、被害枝条内可溶性糖含量均显著高于昭锦108 (表2)。正常枝条含糖量与其感蚜率存在相关性 (r=0.99,P=0.09)。被危害后各品种含糖量增减不一,昭锦108下降1.7%,红富士、金冠均呈现上升趋势,其中金冠上升幅度较大,达到7.0%。
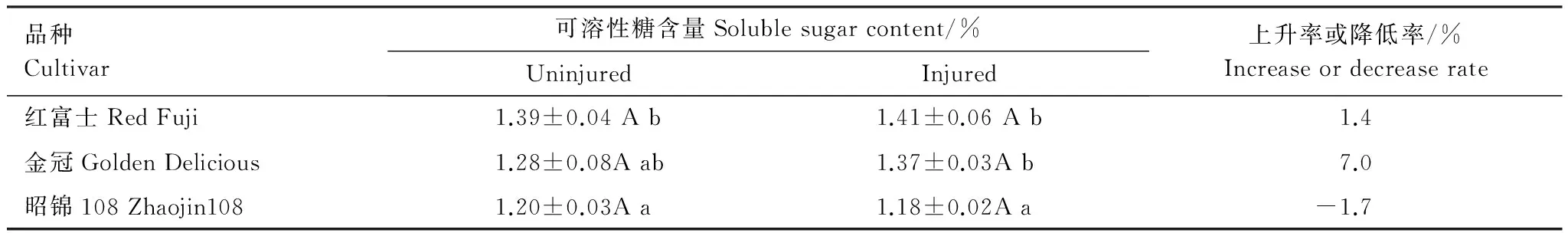
表2 被苹果绵蚜危害后不同品种可溶性糖含量变化
同行数据后的不同大写字母表示差异显著 (配对样本T检验,Plt;0.05)
2.3 不同苹果品种蛋白质、氨基酸的含量
夏季新稍生长期,红富士正常枝条中蛋白质含量显著高于金冠、昭锦108,而游离氨基酸含量显著低于金冠和昭锦108。相关性分析发现,蛋白质含量与感蚜率呈正相关 (r=0.86,P=0.34);游离氨基酸含量与感蚜率存在负相关 (r=-0.96,P=0.18)。被危害后,3种苹果枝条内蛋白质和游离氨基酸含量均下降。蛋白质下降率依次为:红富士(34.8%)gt;昭锦108(6.9%)gt;金冠(3.4%),红富士下降最明显;游离氨基酸下降率依次为:昭锦108 (30.4%) gt;金冠 (12.9%) gt;红富士 (10.5%) (表3),昭锦108下降率最高。结果表明,被危害后较不易感的品种游离氨基酸含量下降更明显;易感的品种蛋白质含量下降更明显。
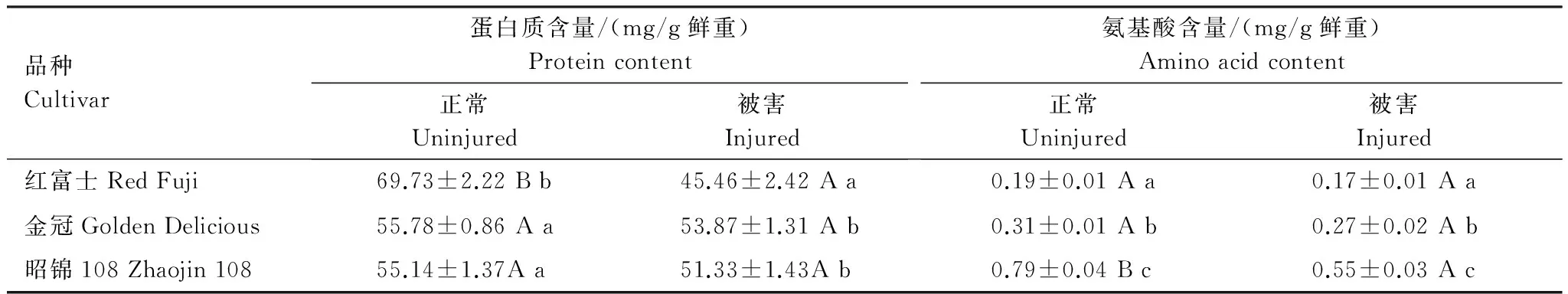
表3 被苹果绵蚜危害后不同品种蛋白质、氨基酸含量变化
2.4 不同苹果品种总酚的含量
夏季新稍生长期不同品种正常枝条中总酚含量与其感蚜率无明显相关性。被苹果绵蚜危害后枝条内总酚含量均下降,下降率依次为:红富士 (23.5%)gt;金冠 (22.0%)gt;昭锦108 (12.7%),下降率与感蚜率呈正相关性(r=0.94,P=0.22)。结果表明,被危害后各品种总酚含量均下降,但易感品种下降更加明显(表4)。
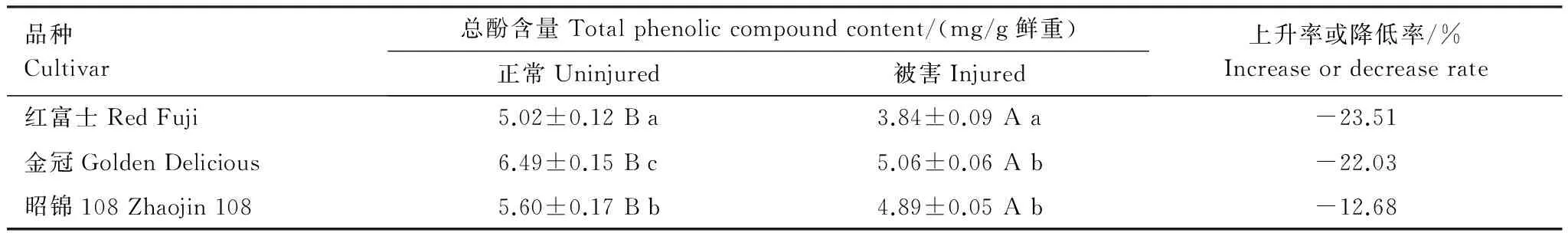
表4 被苹果绵蚜危害后不同品种的总酚含量变化
2.5 不同苹果品种防御性酶的活性
夏季新稍生长期,金冠正常枝条SOD活性最低,低于红富士、昭锦108;被害后,SOD活性均上升 (图1),上升率依次为:金冠 (14.7%) gt;红富士(12.1%) gt;昭锦108 (10.4%)。危害前后,较不易感的昭锦108 SOD活性始终最高。
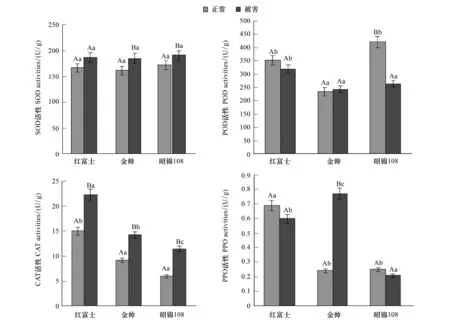
图1 苹果绵蚜危害前后不同苹果品种枝条内SOD、POD 、CAT、PPO活性Fig.1 Differences of SOD, POD, CAT, PPO activities in the branches of different apple cultivars
昭锦108正常枝条中POD活性最高 (图1),明显高于金冠。被害后POD活性增减不一,金冠上升4.2%,红富士、昭锦108均下降,其中昭锦108下降率达37.2%。
最易感的红富士CAT活性最高,被害后3个品种均出现明显上升 (图1),上升率依次为:昭锦108 (91.2%) gt;金冠 (53.8%)gt;红富士 (45.9%) 与其感蚜率呈显著负相关 (r=-0.95,P=0.20),较不易感的昭锦108上升最显著。
正常红富士枝条PPO活性最高 (图1),明显高于金冠、昭锦108。被害后,金冠PPO活性上升220.8%,活性最高。而红富士、昭锦108分别降低13.0%、16.0%。
3 讨论与结论
植物能为昆虫提供营养成分,同时植物体内还存在多酚、丹宁等防御物质以抵御害虫的危害[14]。营养物质的缺乏[15],以及营养物质的不平衡[16]等都会影响害虫对植物的选择性。
3.1 糖与植物的抗虫性
Bryant等研究发现,植物可以通过降低营养物质含量来抵御害虫的危害[17]。Haukioja研究表明,植物被害后不是单纯的增加次生物质含量,还可以通过降低糖的含量以增加抗性[18]。因而,植物体内的糖含量影响害虫对寄主的选择。本文研究发现,苹果正常枝条中可溶性糖含量与其感蚜率呈正相关 (r=0.98),被危害后红富士、金冠可溶性糖含量增加,昭锦108下降,被害前后糖含量均为红富士gt;金冠gt;昭锦108。结果表明,苹果枝条中可溶性糖对苹果绵蚜具有吸引作用与春梢生长期结果一致。推测,被害后可溶性糖含量的增加是导致红富士和金冠受害严重的主要原因。
3.2 氨基酸和蛋白质与植物的抗虫性
植食性昆虫从植物中获取蛋白质、氨基酸以满足自身营养需求。植物也可以通过调节营养物质的含量抵御害虫的危害[19]。刘俊认为在冬小麦对麦长管蚜Sitobionavenae和禾谷缢管蚜Rhopalosiphumpadi的抗性中,蚜虫数量与全部游离氨基酸含量成比例[20]。Ciepiela发现冬小麦蚜虫侵害量与游离氨基酸和必需氨基酸成正相关[21]。魏书艳等研究发现,被绿盲蝽危害后各寄主体内的蛋白质含量出现不同程度下降。以上研究表明,植物对害虫的抵御与植物体内蛋白质、氨基酸的含量有一定关系[22]。本研究发现,蛋白质和游离氨基酸均与感蚜率存在相关性,相关系数分别为0.83和-0.97。被危害后各品种枝条内蛋白质、氨基酸均下降,其中红富士中蛋白质下降明显,达34.8%。研究表明植物受害后体内蛋白酶活性升高将导致可溶性蛋白含量下降[23]。作为一种抗性反应,苹果受害后会降低体内苹果绵蚜生长所必需氨基酸的含量,进而导致氨基酸总量的下降。李镇宇等研究证明,植物体内游离氨基酸含量下降是植物的一种抗性表现[24]。受害前昭锦108体内高含量的氨基酸可能大部分是苹果绵蚜非必需的。
3.3 酚类与植物的抗虫性
植物次生代谢物质是植物防御系统中的主要部分,它们可以单独或协同起作用以抵御害虫的危害[25]。萜类、酚类、生物碱、丹宁、糖苷等是形成植物化学防御的重要因素[26]。戴沿海研究发现,松树受松突圆蚧轻度为害时总酚含量明显增加,以抵御松突蚧的为害[27]。王志刚等研究证明,酚类物质是杨树对天牛抗性的因素[28]。因而,酚类物质对植物的抗虫性有一定影响。本试验结果表明,正常枝条中总酚含量与其抗蚜性无明显关系,但被害后总酚下降率与感蚜率存在相关性 (r=0.96)。易感的红富士总酚显著下降 (23.5%),这可能是导致其受害严重的因素之一。受害后总酚含量下降的现象,可能与苹果绵蚜的适应机制或危害程度有关。已有研究发现蚜虫唾液中的酚氧化酶能够分解酚类物质进而导致酚含量下降[29], Rossiter等也报道,北方红栎 (Quercuubra) 叶片受害较轻时,叶片中酚类化合物的含量降低;而当为害程度较重时,酚类化合物的含量上升[30]。
3.4 防御性酶与植物的抗虫性
活性氧清除系统的3个主要酶 (SOD、POD、CAT) 能有效抑制活性氧自由基对机体的伤害,PPO在植物抵御伤害中也起重要作用[31]。Constabel发现野生型蕃茄受伤害后叶片内PPO活性升高[32],谭永安等也证明,棉花被绿盲蝽危害后SOD、POD和CAT酶活性呈现动态变化[33]。因而,植物的这几种防御性酶能够清除有害物质,而且能够改变活性以修复植物受到的伤害。本实验发现,正常枝条中4种酶与苹果的感蚜率均不存在明显相关性。但受害后,SOD、CAT活性均上升,其中CAT变化率与感蚜率存在相关性 (r=0.98),昭锦108 CAT活性上升率高达91.2%,表明CAT在昭锦 108体内起主要作用;POD、PPO活性增减不一;金冠4种酶活性均上升,表明金冠受害后具有较强的自愈能力。以上与前人研究存在差异,这可能与研究对象不同有关,而且植物受害后酶活的变化还与危害时间有关,因此还应从危害时间与酶活变化方面展开进一步研究。
苹果枝条内营养物质的含量是影响苹果绵蚜选择寄主的重要因素。其中,抗性较强的品种正常枝条中可溶性糖、蛋白质含量较低,游离氨基酸含量较高,受害后可溶性糖含量下降游离氨基酸含量明显下降;酚和防御性酶对苹果绵蚜影响不明显,但受害后部分酶活上升,且抗性较强品种总酚含量下降率较低,综合春季研究表明可溶性糖是影响苹果绵蚜危害的主要因子。总之,不同植物的抗性机理不同,同一种植物在不同时期的防御机制也不同。植物对虫害的抵御因子多种多样,也不是几种方式的简单组合。还可能与植物的种类、结构、具体的生态条件有关,而且在虫害的不同阶段起主导作用的因素也不同[34]。因而,植物受害后生理特征的变化也不尽相同,还应从结构、害虫危害方式以及营养物质和次生物质的具体种类方面进行更深入的研究。
[1] Sandanayaka W R M, Bus V G M, Connolly P. Mechanisms of woolly aphid [Eriosomalanigerum(Hausm.)] resistance in apple. Journal of Applied Entomology, 2005, 129(9/10): 534- 541.
[2] Bus V G M,Changne D,Bassett H C M,Bowatte D,Calenge F,Celton J M,Durel E,Malone M T,Patocchi A,Ranatunga A C,Rikkerink E H A,Tustin D S,Zhou J and Gardiner S E. Genome mapping of three major resistance genes to woolly apple aphid (EriosomalanigerumHausm.). Tree Genet Genomes, 2008, 4(2): 223- 236.
[3] Zhang Q, Luo W C. Study on damage characteristics and control of Woolly Apple Aphid. Entomological Knowledge, 2002, 39(5): 340- 342.
[4] Nicholas A H, Spooner-hart R N, Vickers R A. Abundance and natural control of the woolly aphidEriosomalanigerumin an Australian apple orchard IPM program. BioControl, 2005, 50(2): 271- 291.
[5] Brown M W, Schmitt J J, Ranger S, Hogmire H W. Yield reduction in apple by edaphic woolly apple aphid (Homoptera: Aphididae) Populations. Journal of economic entomology, 1995, 88(1): 127- 133.
[6] Ateyyat M A, Al-Antary T M. Susceptibility of nine apple cultivars to woolly apple aphid,Eriosomalanigerum(Homoptera: Aphididae) in Jordan. International Journal of Pest Management, 2009, 55(1): 79- 84.
[7] Klimstra D E, Rock G C. Infestation of rootstocks by woolly apple aphid on weak or dead apple trees in North Carolina orchards. Journal of agricultural entomology, 1985, 2(3): 309- 312.
[8] Feng S M. The occurrence and risk assessments of forest quarantine objects in Yunnan province. Forest Pest and Disease, 2001, (3): 31- 33.
[9] Yin X W, Li X Y, Zhang L, Chen B. Resistance Determination of the apple varieties against the woolly apple aphid,Eriosomalanigerum. Journal of Yunnan Agricultural University, 2010, 25(1): 30- 33.
[10] Wang X C, Yu Y, Zhou H X, Cheng Z Q, Zhang A S, Men X Y, Li L L. Effects ofEriosomalanigerum(Hausmann) on physiological indices of different apple cultivars. Acta Ecologica Sinica, 2012, 32(7): 2075- 2081.
[11] Zou Q. The Exprimental Guide for Plant Biochemistry. Beijing: Chinese Agricultural Press, 1995: 59- 99.
[12] Han F G, Liu X Z, Jiao G Z. The use of Folin method for determining the total phenols content in tobacco leaves. Acta Agriculturae Universitatis Henanensis, 1993, 27(1): 95- 98.
[13] Hao J J, Kang Z L, Yu Y. Plant Physiology Experiment Technology. Beijing: Chemical Industry Press, 2006: 100- 102.
[14] Edwards P J, Wratten S D, Greenwood S. Palatability of British trees to insects: Constitutive and induced defenses. Oecologia, 1986, 69(2): 316- 319.
[15] Chen S L, Du R Q, Wu H, Zhang H F. Discriminant analysis of the relationship between nutrient contents in needles ofPinusmassonianaand its resistance againstHemiberlesiapitysophila(Hemiptera:Diaspididae). Acta Entomologica Sinica, 2011, 54(3): 312- 319.
[16] Leather S R, Watt A D, Forrest G I. Insect-induced chemical changes in young lodgepole pine (Pinuscontorta): the effect of previous defoliation on oviposition, growth and survival of the pine beauty moth,Panolisflammea. Ecological Entomology, 1987, 12(3): 275- 281.
[17] Bryant J P, Reicherdt P B, Clausen T P, Werner R A. Effects of mineral nutrition on delayed inducible resistance in Alaska paper birch. Ecology, 1993, 74(7): 2077- 2084.
[18] Haukioja E. Induction of defenses in trees. Annual Review of Entomology, 1990, 36: 25- 42.
[19] Mo S S, Wang Y J, Zhao D X. Induced resistance of plant to insects and application in pest management. Hubei Agricultural Sciences, 2011, 50(4): 655- 659.
[20] Liu Jun. Summarizing the mechanism of resistant to aphids in cereal crops. Entomological Knowledge, 1989, 26(4): 247- 250.
[21] Ciepiela A. Biochemical basis of winter wheat resistance to the grain aphid,Sitobionavenae. Entomologia Experimentalis et Applicata, 1989, 51(3): 269- 275.
[22] Wei S Y, Xiao L B, Tan Y A, Zhao H X, Bai L X. Changes of physiological indices of host plants infested byLyguslucorumMeyer-Dür (Hemiptera: Miridae). Acta Phytophylacica Sinica, 2010, 37(4): 359- 364.
[23] He W T, Peng D L. Physiological and biochemical response of plant to nematode stress. Plant Protection, 2007, 33(2): 11- 15.
[24] Li Z Y, Wang Y, Chen H S, Xu Z C, Lu Y B. Induced chemical defenses and delayed induced resistance ofPinusTabulaeformisCarr. toDendrolimusSpectabilisButler. Scientia Silvae Sinicae, 2000, 36(1): 66- 70.
[25] Zhu H J, Chen L S. Application prospect of plant secondary metabolism substance in pest control and relationship with plant resistance to insects. Journal of South China University of Tropical Agriculture, 2001, 7(1): 26- 32.
[26] Qin J D. The adaptations and co-evolution between insects and host plants. Bulletin of Biology, 1996, 31(1): 1- 2.
[27] Dai Y H. The injury influences ofHemiberlesiapitysophilaon the secondary metabolites content of needle-leaves ofPinusmassoniana. Entomological Journal of East China, 2006, 15(2): 103- 106.
[28] Wang Z G, Zhang Y G, Huang D Z. The analysis on secondary metabolites in branch xylem of various poplar tree species. Journal of Agricultural University of Hebei, 1999, 22(4): 75- 78.
[29] Miles P W. Aphid saliva. Biological Reviews, 1999, 74(1): 41- 85.
[30] Rossiter M C, Schultz J C, Baldwin L T. Relationships among defoliation, Red Oak Phenolics, and Gypsy Moth growth and reproduction. Ecology, 1988, 69(1): 267- 277.
[31] Huang W, Jia Z K, Han Q F. Effects of herbivore stress byAphismedicaginisKoch on the contents of MDA and activities of protective enzymes in different alfalfa varieties. Acta Ecologica Sinica, 2007, 27(6): 2177- 2183.
[32] Constabel C P, Bergey D R, Ryan C A. Systemic activates synthesis of wound-inducible tomato leaf polyphenol oxidase via the octadecanoid defense signaling pathway. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(2): 407- 411.
[33] Tan Y A, Bai L X, Xiao L B, Wei S Y, Zhao H X. Herbivore stress byLyguslucoruminducing protective enzyme activity and MDA content on different cotton varieties. Cotton Science, 2010, 22(5): 479- 485.
[34] Jia Z, Ma Y S, Mao X W, Lan X P. The research advances in the reaction and resistance to insects of plant. Journal of Hexi University, 2005, 21(5): 53- 55.
参考文献:
[3] 张强, 罗万春. 苹果绵蚜发生危害特点及防治对策. 昆虫知识, 2002, 39(5): 340- 342.
[8] 冯士明. 云南省森林植物检疫对象发生及危险性评估. 中国森林病虫, 2001, (3): 31- 33.
[9] 尹学伟, 李向永, 张 龙, 陈斌. 苹果品种对苹果绵蚜的抗性测定. 云南农业大学学报, 2010, 25(1): 30- 33.
[10] 王西存, 于毅, 周洪旭, 程在全, 张安盛, 门兴元, 李丽莉. 苹果绵蚜对不同苹果品种春梢生长期生理指标的影响. 生态学报, 2012, 32(7): 2075- 2081.
[11] 邹琦. 植物生理生化实验指导(第1版). 北京: 中国农业出版社, 1995, 59- 99.
[12] 韩富根, 刘学芝, 焦桂珍. 用福林法测定烟叶中总酚含量的探讨. 河南农业大学学报, 1993, 27(1): 95- 98.
[13] 郝建军, 康宗利, 于洋. 植物生理学实验技术(第1版). 北京: 化学工业出版社, 2006, 100- 102.
[15] 陈顺立, 杜瑞卿, 吴晖, 张华峰. 不同抗性马尾松针叶中营养物质含量与对松突圆蚧抗性关系的判别分析. 昆虫学报, 2011, 54(3): 312- 319.
[19] 莫圣书, 王玉洁, 赵冬香. 植物诱导抗虫性及其在害虫治理中的应用. 湖北农业科学, 2011, 50(4): 655- 659.
[20] 刘俊. 禾谷类作物抗蚜性机制综述. 昆虫知识, 1989, 26(4): 247- 250.
[22] 魏书艳, 肖留斌, 谭永安, 赵洪霞, 柏立新. 不同寄主受绿盲蝽危害后生理代谢指标的变化. 植物保护学报, 2010, 37(4): 359- 364.
[23] 贺文婷, 彭德良. 植物对线虫胁迫的生理生化响应机制. 植物保护, 2007, 33(2): 11- 15.
[24] 李镇宇, 王燕, 陈华盛, 许志春, 路永波. 油松对赤松毛虫的诱导化学防御及滞后诱导抗性. 林业科学, 2000, 36(1): 66- 70.
[25] 朱俊洪, 程立生. 植物次生性物质与植物抗虫性的关系及其在害虫防治中的前景. 华南热带农业大学学报, 2001, 7(1): 26- 32.
[26] 钦俊德. 昆虫与寄主植物的适应性及协调进化. 生物学通报, 1996, 31(1): 1- 2.
[27] 戴沿海. 松突圆蚧为害对马尾松针叶主要次生物质的影响. 华东昆虫学报, 2006, 15(2): 103- 106.
[28] 王志刚, 张彦广, 黄大庄. 不同杨树树种枝条木质部酚类次生代谢物质的分析. 河北农业大学学报, 1999, 22(4): 75- 78.
[31] 黄伟, 贾志宽, 韩清芳. 蚜虫(AphismedicaginisKoch)危害胁迫对不同苜蓿品种体内丙二醛含量及防御性酶活性的影响. 生态学报, 2007, 27(5): 2177- 2183.
[33] 谭永安, 柏立新, 肖留斌, 魏书艳, 赵洪霞. 绿盲蝽危害对棉花防御性酶活性及丙二醛含量的诱导. 棉花学报, 2010, 22(5): 479- 485.
[34] 贾贞, 马银山, 毛学文, 兰小平. 植物的虫害反应与抗虫机制研究进展. 河西学院学报, 2005, 21(5): 53- 55.
TherelationshipbetweenphysiologicalindexesofapplecultivarsandresistancetoEriosomalanigeruminsummer
WANG Xicun1,2, ZHOU Hongxu1,*,YU Yi2, CHENG Zaiquan3, ZHANG Ansheng2, CHU Dong1, LI Lili2
1CollegeofAgronomyandPlantProtection,KeyLabofIntegratedCropPestManagementofShandongProvince,QingdaoAgriculturalUniversity,Qingdao266109,China2InstituteofPlantProtection,ShandongAcademyofAgriculturalSciences,Jinan250100,China3InstituteofBiotechnologyandGermPlasmResources,YunnanAcademyofAgriculturalSciences,Yunnan, 650223,China
To reveal the relationship between physiological indices in apples and resistance to woolly apple aphid (EriosomalanigerumHausmann), and provide basis for breeding resistant cultivars. Apple cultivars with different resistibility were selected through field survey, the physiological indexes and the changes of them damaged byE.lanigerumin the apple cultivars were studied. Result: In the uninjured branches, the contents of soluble sugar (r=0.99) and protein (r=0.86) are positive correlated with the hazard ratios of woolly apple aphid; amino acid contents are negative corrected with the hazard ratios(r=-0.96); total phenolic compound and enzyme activities have no significant relationship with the resistance toE.lanigerum. After been infested the sugar contents in Fuji and Golden Delicious increased by 1.4% and 7.0%; protein contents, amino acid contents and total phenolic compound contents decreased in all cultivars, the rates of change in total phenolic compound have obvious relationship with the hazard ratios(r=0.94) and the phenolic compound decreased by 23.5% in Red Fuji; the SOD (Superoxide Dismutase), CAT (Catalase) activities were increased in all the injured cultivars, the rates of increase in CAT are positive correlated with the hazard ratios(r=-0.92), and increased by 91.2% in Zhaojin108; PPO (Polyphenol Oxidase) and POD (Peroxidase) activities have no regularly changes; in Golden Delicious all the four enzymes were increased. It is suggested that the resistant cultivar has high amino acid contents and low soluble sugar, protein contents. In the injured branches of resistant cultivar the amino acid were decreased obviously and the phenolic compound, soluble sugar were decreased slightly. Enzyme activities have no significant relationship with the resistance toE.lanigerum.
Woolly apple aphid; apple cultivars; physiological indexes; resistance
农业部现代苹果产业技术体系建设科研专项(nycytx- 008);农业公益性行业科研专项(201103026- 5- 2),“泰山学者”建设工程专项经费资助
2012- 06- 08;
2012- 11- 19
*通讯作者Corresponding author.E-mail: hxzhou@qau.edu.cn
10.5846/stxb201206080825
王西存,周洪旭,于毅,程在全,张安盛,褚栋,李丽莉.夏季苹果新梢生理指标与抗苹果绵蚜的关系.生态学报,2013,33(17):5177- 5183.
Wang X C, Zhou H X,Yu Y, Cheng Z Q, Zhang A S, Chu D, Li L L.The relationship between physiological indexes of apple cultivars and resistance toEriosomalanigerumin summer.Acta Ecologica Sinica,2013,33(17):5177- 5183.

