秸秆还田与施肥对稻田土壤微生物生物量及固氮菌群落结构的影响
刘骁蒨,涂仕华,孙锡发,辜运富,张先琴,张小平,*
(1. 四川农业大学资源环境学院微生物系, 成都 611130; 2. 四川省农业科学院土壤肥料研究所,成都 610066)
秸秆还田与施肥对稻田土壤微生物生物量及固氮菌群落结构的影响
刘骁蒨1,涂仕华2,孙锡发2,辜运富1,张先琴1,张小平1,*
(1. 四川农业大学资源环境学院微生物系, 成都 611130; 2. 四川省农业科学院土壤肥料研究所,成都 610066)
利用氯仿熏蒸法和变性梯度凝胶电泳法(PCR-DGGE)研究了秸秆覆盖还田与施肥对灰棕冲积水稻土0—10cm和10—20cm土层土壤微生物生物量碳、氮和固氮菌群落结构的影响。结果表明:土壤微生物量碳、氮和固氮菌多样性从0—10cm土层到10—20cm土层均呈现降低趋势。无秸秆覆盖处理(对照组)的土壤微生物生物量碳(SMB-C)和微生物生物量氮(SMB-N)量最小。在秸秆覆盖还田处理中,低氮和无钾处理的SMB-C和SMB-N都显著低于全量氮磷钾肥处理。虽然无磷处理的SMB-N低于全量氮磷钾处理, 但差异不显著。说明秸秆覆盖还田配施充足氮磷钾肥能显著提高土壤微生物生物量碳、氮。由DGGE图谱多样性指数分析得知,配施充足氮磷钾肥的处理土壤的固氮菌多样性最丰富。UPGMA聚类分析显示,10种不同处理的聚类图也不同,对照(无秸秆)处理0—10cm和10—20cm的微生物不同于其它处理单独聚在了一个群里。DGGE条带测序得知,14个条带的近缘种大部分为非培养细菌nifH基因片段,主要优势菌群其归属于变形菌门(Proteobacteria)的β-变形菌纲(Betaproteobacteria)。应用PCR-DGGE技术可以解释灰棕冲积水稻土秸秆覆盖不同肥料用量固氮菌分子群落结构特点。
秸秆还田;灰棕冲积水稻土;微生物生物量;PCR-DGGE;固氮菌群落结构
我国的秸秆资源十分丰富,据统计全国每年共产生秸秆数量为6.2亿t,约占世界的20%—30%[1],农作物秸秆中蕴含有大量的氮、磷、钾和中、微量元素等矿质养分。农作生产中产生的大量秸秆被焚烧,造成了营养物质流失和严重环境污染。秸秆还田作为秸秆利用的一种重要且有效的方式,既可以避免资源浪费和环境污染,同时也可以增加土壤有机质和养分的含量,提高孔隙度,降低土壤容重,还可以提高土壤微生物生物量及增强各种土壤酶的活性[2],从而使作物更好更快地生长,提高作物产量。
土壤微生物是土壤生态系统的重要组成部分,在有机质分解、土壤养分循环和植物养分吸收利用过程中发挥着至关重要的作用[3]。生物多样性越高的生态系统越稳定的Elton假说,受到大多数学者的认同。Tilman通过直接控制生物多样性,对147个草地进行了实验研究。结果表明,草地生态系统的生物多样性影响着草地短期和长期的生产率及发展[4]。一些研究者指出随着有机质的施入和化学肥料的减少,土壤微生物生物量和微生物活性都明显增加[5]。秸秆覆盖与土壤微生物之间作用是相互促进相互影响的,一方面秸秆覆盖增加了土壤微生物生物量,提高微生物的活性[6],另一方面土壤微生物生物量及活性的提高也会加快秸秆的腐解[7]。
传统平板培养分离方法可分离出的微生物种类只占土壤微生物种类总数的0.1%—1%[8]。应用PCR-DGGE技术可以有效地避免在传统菌落培养分离过程由于微生态生境无法复制而造成的大量微生物多样性的丢失,能够更加全面而可靠的反映土壤微生物的组成情况,故其在微生物群落多样性研究中得到越来越广泛的应用[9]。固氮细菌是生态系统中一类重要的功能菌群,它在土壤氮素循环发挥着不可取代的作用[10]。目前有关秸秆还田条件下配合化肥使用对土壤微生物量和特殊生理类群微生物群落结果影响的研究还不多,关于秸秆还田下施用不同肥料对四川灰棕冲积水稻土微生物量及固氮菌群落结构的影响的研究更无报道。本研究将应用PCR-DGGE技术研究秸秆还田下不同施肥土壤固氮菌群落结构,并对土壤中的主要固氮菌群进行测序分析,从微生物角度了解秸秆还田土壤生态状况,为秸秆还田与合理施肥、水分管理、保护土壤微生物等方面的工作提供科学依据。
1 材料与方法
1.1 试验点及实验处理
试验土壤采集于四川省农业科学院土壤肥料研究所于2002年建立在四川省广汉市西高镇的试验基地。该地为亚热带湿润气候,年均气温16.3℃,积温5980.4℃,降水量为890.8mm,日照时数为1229.2h,无霜期达281d。试验开始于2004年10月,作物轮作为小麦水稻,一年两熟。土壤为灰棕冲积水稻土,试验前的土壤基本理化性质见表1。试验采取完全随机区组设计方案,5个处理:N150P60K90(CK,无覆盖),秸秆覆盖+N90P60K90(SNL),秸秆覆盖+N150P60K90(SCK),秸秆覆盖+N150P60K0(SNP)和秸秆覆盖+N150P0K90(SNK),3次重复,小区面积为3m×4m。试验小区四周为20cm高田埂,重复之间有排水沟。各处理肥料用量分别为,氮肥(N,尿素) 90、150 kg/hm2;磷肥(P2O5,磷酸一铵) 0、60 kg/ hm2;钾肥(K2O,氯化钾) 0、90 kg/hm2。每季作物收获后,秸秆全部均匀覆盖于原试验小区,连续覆盖免耕。小麦和水稻施肥时间和比例分别为,氮肥30%作底肥施用,70%作分蘖肥施用;磷肥全部作底肥施用;钾肥50%作底肥,50%作分蘖肥。

表1 供试土壤基本理化性质
1.2 取样方法
于2009年7月水稻生长旺盛期,在田间采用“梅花型”布点取样,取样深度分别为0—10cm(在处理代码后加T下标)和10—20cm(在处理代码后加s下标)。将每一小区内同一取样点中相同深度土壤混匀,用无菌PET树脂袋封装带回实验室。立即进行土壤微生物数量分析和DNA的提取。另取一部分放于室内风干,研细过2 mm筛,用于土壤理化性质的分析。其它放在-20℃的冰箱里保存以备后续分析。
1.3 土壤微生物生物量的测定。
土壤微生物生物量土壤微生物生物量碳(MBC)、微生物量氮(MBN)的测定采用氯仿熏蒸法[11]。
1.4 土壤固氮菌群落结构的PCR-DGGE分析和系统发育树的构建
1.4.1主要仪器和试剂DGGE所用仪器the D-code TM Universal Mutation Detection System (Bio-Rad Co)。采取巢式一步PCR扩增nifH基因,巢式一轮引物为FGPH19和PolR,巢式第二轮引物为AQER和PolF-GC。(引物均由Invitrogen英杰生命技术公司合成),具体引物序列参见文献[12]。切胶纯化试剂盒(TaKaRa,大连宝生物)纯化。
1.4.2土壤微生物总DNA提取 采用土壤总DNA提取试剂盒(北京天恩泽基因科技有限公司),称取0.5g于20℃保存的土样,按试剂盒提供的操作步骤进行土壤微生物总DNA的提取,在0. 8%的琼脂糖凝胶中对提取的DNA进行电泳检测。
1.4.3固氮菌nif-H基因的PCR扩增采用Nested-PCR程序。
第一次PCR 所用引物为固氮菌nif-H基因的引物FGPH 19和Po1R,反应体系为:PCR Master Mix (Tiangen Biotech, Bejing) 25L,每种引物0.5μL (20pmol/μL),0.5μL 10倍稀释的土壤总DNA提取液,加ddH2O至反应终体积50μL。为减少扩增过程中的非特异性产物,采用Touch-down PCR程序,反应程序:94℃预变性5min,94℃ 1min,65—55℃ 50s (每个循环温度降低0.5℃,72℃ 1.30min,20个循环,然后在其它条件不变的情况下,在55℃的退火温度下继续扩增15个循环,72℃ 7 min,最后于4℃恒定保存。
第二次PCR 第一次PCR产物1∶10稀释后作为二次PCR反应的模板进行,引物为AQER和PolF-GC,反应的体系为:10×PCR buffer缓冲液5μL, MgCl2(25mmol/μL) 3μL, dNTP(2.5mmol/μL) 1μL, PolF-GC (20pmol/μL) 0.5μL, AQER(20pmol/μL) 0.5μL, Taq DNA聚合酶(5u/μL) (Tiangen Biotech, Bejing)0.5μL,模板DNA1μL,加ddH2O至终体积50μL。反应程序是在第一轮PCR的基础上,退火温度变为在前20个循环为63—53℃,接下来的后15个循环的退火温度为53℃,其它步骤与第一轮PCR反应相同。
1.4.4 PCR产物的变性梯度凝胶电泳(DGGE)分析
取第一次PCR产物15μL进行DGGE分析,变性剂梯度范围为20%—50%,自配的聚丙烯酰胺凝胶浓度为8% (100%的变性剂为尿素7 mol/L和40%的去离子甲酰胺)。在1×TAE缓冲液中,50V电压进胶30 min,然后在150V 60℃缓冲液中电泳6h。电泳后采用银染法进行染色。然后用数码相机拍照。DGGE指纹图谱分析借助于Bio-Rad公司的凝胶成像系统(Quantity One Bio-Rad, USA)分析样品电泳条带。
在图像处理过程中,在DGGE电泳图谱上有一些肉眼可见、但被软件忽略掉的细小条带进行手动添加,条带的密度由该软件自动算出。
1.4.5 DGGE条带的切割、克隆与测序
从DGGE凝胶上仔细切下有用的DGGE条带装于PCR反应管中,用50μL无菌水反复冲洗3次后,加人20μL无菌水在4℃冰箱过夜。次日12000g离心5 min,收集上清液。以此作为模板进行下一步的PCR扩增,用引物AQER和PolF,进行nif-H基因PCR扩增。PCR反应程序同1.4.3中第一次PCR反应。将上述PCR产物连接到pMD19-T载体(Takara, 大连)上,转化到E.coliDH5α感受态细胞中,在含有氨苄青霉素的LB培养基上选择具有氨苄青霉素抗性的白色转化子。采用T载体通用引物M13F, M13R进行菌落PCR,PCR产物经1%琼脂糖凝胶电泳检测是否为阳性克隆。测序工作由北京华大基因科技有限公司完成。
1.4.6 固氮基因nif-H序列分析
所得序列提交到GenBank数据库中,并用BLAST程序进行同源性比对,获得与本实验所得序列相似性最高的序列。将这些相似性较高序列与本实验获得的固氮基因nif-H序列一起,使用Clustal X1.83工具进行多序列比对。然后使用MEGA软件中的Kimura双参数修正模型进行系统发育树的构建。
1.5 数据处理
用Quantity One分析软件分析得到相似性指数;以Shannon-Wiener指数反映固氮菌多样性,香浓指数计算方法采用Eichner等[13]和Hedrick等[14]的方法;数据处理用Microsoft Excel 2000进行,统计与显著性检测利用SPSS11.0软件进行。
2 结果与分析
2.1 秸秆覆盖与不同施肥量对土壤微生物生物量碳、氮的影响
农田生态系统中土壤微生物生物量的变化受到多种因素的影响如环境条件、施肥管理等,同时它们能够灵敏地反映环境因子的变化,故常被用于土壤质量生物学的评价指标之一[15]。本研究中由于覆盖秸秆和不同的施肥处理,导致土壤微生物利用的碳源数量、方式发生变化,从而使不同处理的土壤微生物生物量碳、氮表现出差异。供试土壤微生物生物量碳的变化范围介于156.97—229.37mg/kg,微生物生物量氮的变化则介于21.87—35.85mg/kg,最低值均是没有覆盖秸秆的对照组的下层(10—20cm)土样。SCKT与CKT处理的微生物生物量碳、氮差异显著说明覆盖秸秆配施定量的氮磷钾肥能够使土壤微生物量碳、氮有明显的提高。处理SCKT的微生物生物量碳、氮明显高于SNLT,说明秸秆覆盖还田后只有当氮素充足时微生物才更容易繁殖。SNPT处理的微生物量碳、氮明显低于SCKT,表明秸秆覆盖还田配施相同的氮肥磷肥,但不施钾肥不利于微生物生长。处理SNKT微生物量碳显著低于处理SCKT,而其微生物量氮虽也较低但却没有显著性差异,说明磷肥对于土壤微生物生物量碳、氮的影响不相同。同时说明磷对于微生物的代谢具有重要的作用[16]。不同处理的下层土壤之间的差异与上层相似,且同一处理的上下层土壤的微生物生物量碳有显著性差异,而微生物生物量氮均没有显著性差异。
土壤微生物生物量碳氮比(SMBC/SMBN)可反映微生物群落结构信息,其显著的变化表明微生物群落结构变化直接影响微生物量的高低[17]。一般情况下细菌的碳氮比在5∶1左右。Petra Marschnera等[18]认为土壤有机碳的含量和碳氮比能够显著影响土壤细菌群落结构的变化。不同处理间土壤微生物群落结构的相似性或多样性变化主要是由于秸秆还田下不同施肥土壤的微域生境的改变所致,这种改变影响了土壤生境对多种微生物的适宜性。从表2看出,微生物生物量碳氮比的范围5.52—7.26之间。同一层土样不同处理的微生物碳氮比并没有差异,同一处理的上层土壤与下层之间也没有显著性差异。说明秸秆还田为微生物提供了充足的碳源,配施适量氮磷钾肥增加了土壤养分,但是对土壤微生物生物量碳、氮的影响却不相同,这可能是因为复杂的环境因素对微生物有着多方面的影响。只有微生物碳氮比合适,且具有较高有效利用性,才能促进微生物繁殖,从而增加土壤微生物生物量。
2.2 DGGE图谱分析
固氮菌被认为是土壤氮素循环中固氮环节不可或缺的重要成员。对固氮菌群落结构和与固氮相关的种群动态研究对于人们了解不同环境下的生态系统过程十分重要。许多研究试图通过不同的分离技术去研究土壤中具有固氮功能的固氮菌,但是对大多数生态系统来说,细菌中不可培养部分占了总数的绝大多数。通过靶定固氮酶编码基因nifH的PCR扩增和变性梯度凝胶电泳(DGGE)分析,为深入了解固氮菌种群提供了很好的途径[22]。
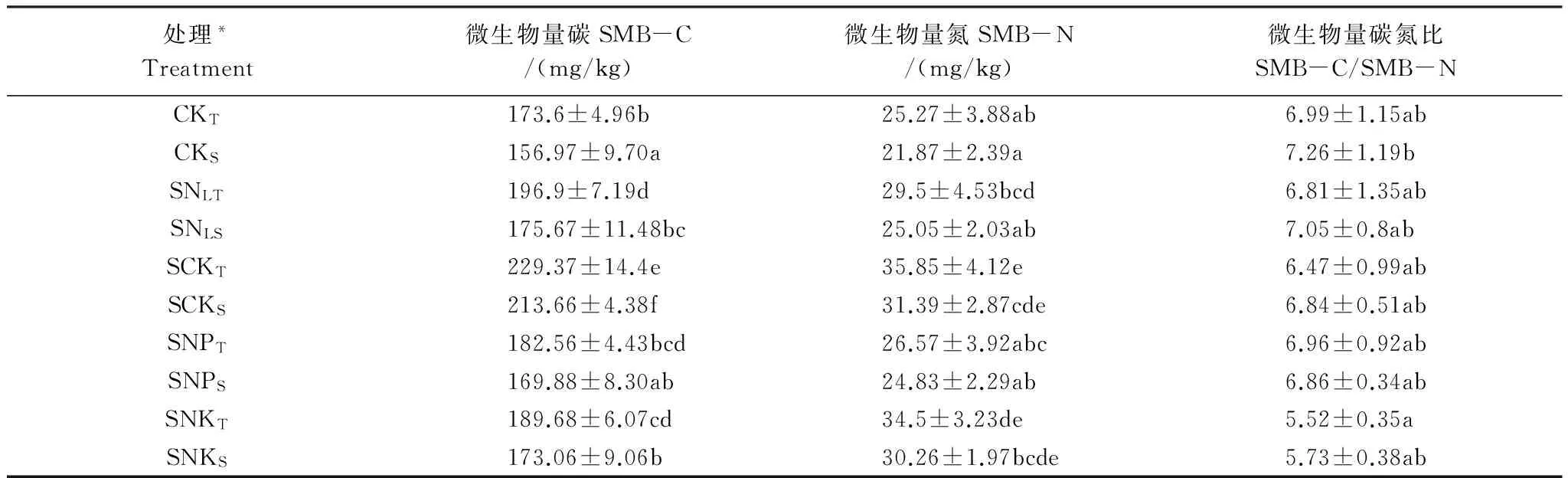
表2 秸秆还田下不同施肥处理的土壤微生物生物量碳氮
*CK为无秸秆覆盖处理(N10P4K6), SNL为秸秆覆盖+N6P4K6(低量氮肥),SCK为秸秆覆盖+N10P4K6,SNP为秸秆覆盖+N10P4K0,SNK为秸秆覆盖+N10P0K6,处理代码的下标T表示0—10cm土层,S表示10—20cm土层;表中数据为平均值±标准差;表中同列相同小写字母表示P≥0.05水平无显著性差异

图1 土壤固氮菌nifH基因的PCR-DGGE图谱Fig.1 PCR-DGGE profiles of soil microbial nifH genes条带近缘菌株依次为Closest relatives in turn:1. Azospirillum brasilense strain AWB12 (GQ161239.1,90%); 2. Uncultured soil bacterium clone T01(EU331520.1, 92%); 3. Uncultured bacterium clone KW-B4(HQ335637.1,96%); 4. Uncultured bacterium clone BNnif4 (HQ190124.1, 96%); 5. Uncultured bacterium clone U1C_12(DQ520301.1,97%); 6. Pseudacidovorax sp ptl-2(GQ249664.1, 94%); 7. Azospira oryzae strain(U97115.2,90%); 8. Uncultured bacterium clone(DQ140703.1,88%); 9. Uncultured bacterium clone pPS204 (FJ381614.1,95%); 10. Uncultured Burkholderia sp isolate DGGE(HM565855.1,94%); 11. Uncultured bacterium isolate DGGE (GU097344,95%); 12. Uncultured bacterium clone BNnif22 (HQ190133.1,95%); 13. Uncultured bacterium clone BNnif17 (HQ190131.1, 98%); 14. Ideonella dechloratans (EU542578.1,93%)
土壤中固氮酶编码基因nifH的扩增片段通过DGGE被分成了许多条带,不同的条带代表不同的固氮细菌及基因片段。结果如图1,从图中我们可以初步看出:供试土壤在DGGE图谱中电泳条带数目、强度和迁移率均存在一定程度的差异,充分显示了固氮细菌的多样性。每个泳道中条带的亮度反映出固氮菌相对生物量的多少,电泳条带的多少可以直观地反映样品中固氮菌群落的遗传多样性。从指纹图谱可以看出每个样品均可分离到10到18条不等的条带。条带数目最少的是CKS处理,条带数目最多的是SCKT处理,表明配施足够的氮磷钾肥+秸秆覆盖能够维持土样营养物质的充足,防止植物与微生物争氮,更有利于固氮细菌的生长繁殖。图谱中不同土壤间有一些共同的条带如条带1、4,说明供试土壤间存在共同的固氮菌类群,但是这些共有条带的亮度不相同,说明土壤固氮菌的数量有一定的改变。
2.3 土壤固氮菌多样性指数
根据电泳图谱中每个条带的信息,对不同处理土壤中固氮菌多样性指数(H)、丰度(S)和均匀度(EH)等指标进行综合分析,结果如表3所示。结果表明,多样性指数和丰富度最高的处理是SCKT,其值分别为2.86和18.00;而最低的是CKS,这两个值仅为2.38和10.33。统计学分析后得知,处理SCKT和CKT多样性指数及丰富度均有显著性差异,说明覆盖秸秆后配施氮磷钾肥能够明显的提高土壤固氮菌的多样性。处理SCKT的多样性指数和丰富度明显大于SNLS说明覆盖秸秆配施相同量的磷钾肥,氮肥施用高的土壤固氮菌多样性指数更大。土壤生境碳氮比需要维持在一定的水平,由于配施秸秆后土壤碳素增加,只有当配施足够的氮才能防止微生物与植物争氮,更有利于微生物的生长繁殖[2]。SNPT处理的多样性指数和丰富度明显低于SCKT处理,表明秸秆覆盖后只配施氮磷肥、缺少钾肥不利于固氮菌的生长。SNKT处理的多样性指数和丰富度低于SCKT处理但没有明显差异,表明磷肥对于固氮菌多样性指数有一定影响但是并没有统计学上的意义。从表3可以看出,同一个处理的上下层土壤多样性指数及丰富度均没有显著差异。同一处理的上层或下层土壤固氮菌的均匀度除了处理SCKT和SCKS有差异外,其余上下层处理均没有显著差异。不同处理的上层土壤固氮菌的均匀度中处理SCKT只与处理SNPT有显著性差异,不同处理的下层土壤中处理SCKs与处理SNPs也有显著性差异,说明钾肥对于固氮细菌均匀度也有一定的影响。
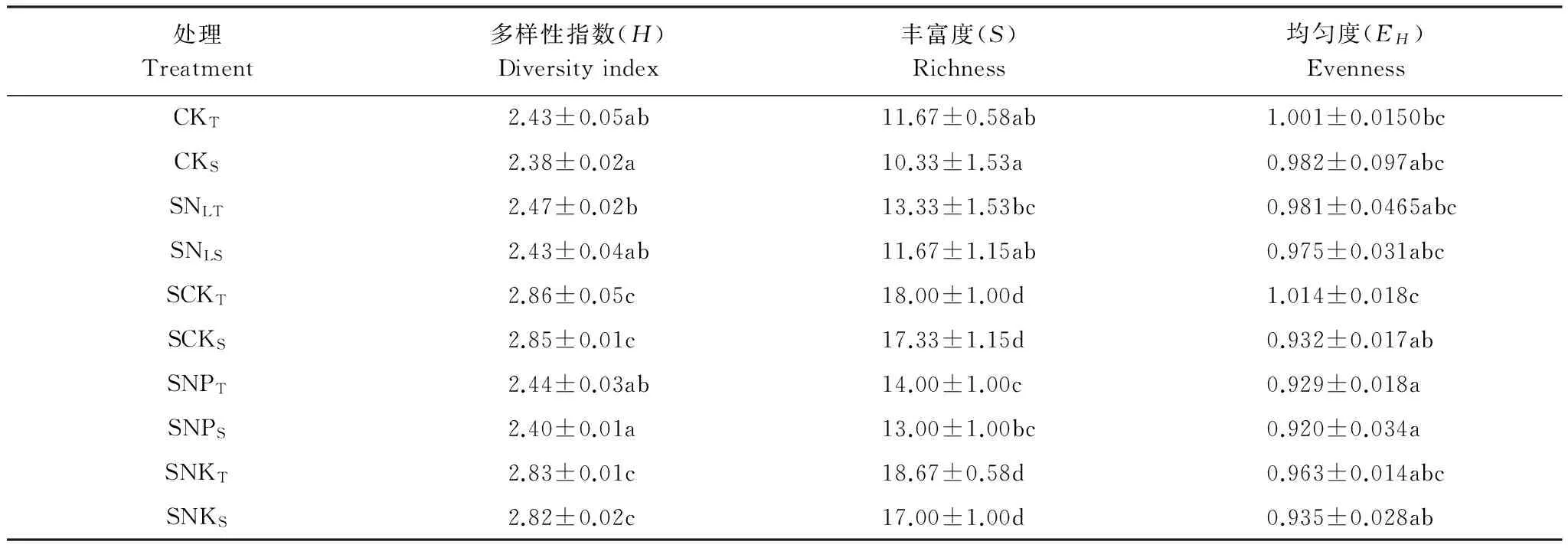
表3 秸秆还田下不同施肥处理土壤固氮基因nifH多样性指数
2.4 土壤固氮菌群落相似性分析
进一步利用Quantity One软件(Bio-Rad)对DGGE图谱的条带数和亮度进行数字化处理,并依此为据进行聚类分析,得到各处理间的聚类分析结果(图2) 。10个处理聚类为三大族群, CKT、CKS为一种族群;SNLT、SNLS、SNPT、SNPS为一个族群;SCKT、SCKS、SNKT、SNKS为第三族群。通过DGGE聚类图可以看出,相同的处理的上下层土壤聚到了一起,不同处理聚在了不同的族群里,说明秸秆覆盖和不同的施肥方式都导致土壤理化性质差异,从而导致不同处理间的土壤固氮菌群落结构的影响不一致。从图中可以看出,只施肥而不覆盖秸秆的处理单独聚成了一族,说明覆盖秸秆使土壤固氮菌的群落结构发生了明显变化。

图2 DGGE图谱聚类分析Fig.2 Cluster analysis of DGGE banding patterns
2.5 DGGE条带测序分析
根据土壤固氮菌DGGE图谱中出现的优势和特殊共有条带进行测序,将所得序列输入NCBI网站将同源性较高的序列下载,通过Clustal X1.83, Mega Soft等软件构建系统发育树。结果如图3。从系统树可见该固氮菌群有丰富的菌种组成多样性,14个条带的近缘种大部分为非培养细菌nifH基因片段,主要优势菌群其归属于变形菌门(Proteobacteria)的β-变形菌纲(Betaproteobacteria)非培养伯克氏菌属、假食酸菌属(Pseudacidovorax)、Azospira属、Ideonella属。14个条带分属于4个主要的簇,其中第一簇中的band 10、band 11、band 12、band 13与铜矿荒地的非培养伯克氏菌属固氮细菌HM565855.1 十分相似,band 3与荷兰Kollumerwaard土壤非培养细菌HQ335637.1十分相似、band 14与Ideonelladechloratans菌株EU542578.1相似性为94%,第二簇中band 2、band 5、band 6 与假食酸菌属(Pseudacidovorax)菌株聚在一起,band 1、band 4、band 7与Azospira属菌株聚为第三簇,band 8、band 9与其它序列差异较大单独成簇,其为未确定归属的固氮细菌。
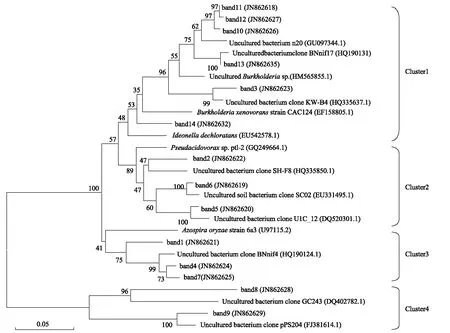
图3 DGGE切胶条带的系统发育树,序列的GenBank登录号列于括号中,尺长度为5%的核苷酸置换率Fig.3 Phylogenetic tree of sequences from DGGE bands. Numbers in parentheses represent the sequences accession number in GenBank. The scale bar: 5% sequence divergence
3 讨论
3.1秸秆还田能有效改善土壤物理性结构,改善各类土壤细菌营养条件与提高细菌活性,有机肥与秸秆还田措施均可以提高不同功能土壤微生物类群的活性,有效的提高了氮肥的利用效率,使农作物产量得到增加[19]。微生物生物量碳、氮被认为是土壤活性养分的储存库,是植物生长可利用养分的重要来源[11]。土壤微生物生物量碳、氮是土壤微生物躯体中所固定的碳素和氮素,其含量的多少决定于土壤中微生物的数量,是土壤微生物对碳素、氮素同化与固持作用这种动态过程的综合反映。Nie Jun[20]等研究表明秸秆覆盖提高了微生物生物量碳和微生物生物量氮,与只施化肥田块相比,分别提高了12.66%和15.07%;与对照相比,分别提高了7.76%和31.42%。
本试验表明秸秆覆盖还田配施适量氮磷钾肥土壤微生物生物量碳氮的含量明显高于对照处理,说明秸秆还田为微生物生长和繁殖提供了大量的碳源和能源,同时施用的氮肥又为微生物的生长提供了较多的氮源,刺激了微生物的生长。在秸秆覆盖的处理中SCKT、SCKS分别高于SNLT、SNLS,即施氮肥较高的处理具有更高的微生物生物量碳、氮值。秸秆还田后,随着施氮量的增加,提供给微生物的氮素增多,促进了微生物的繁殖,加快了秸秆腐解。处理SNPT、SNKT的微生物生物量碳氮低于SCKT,处理SNPS、SNKS的微生物生物量碳氮低于SCKS。说明秸秆覆盖后需同时配施适量氮磷钾才能更好地为微生物的生长提供更全面的能源物质。秸秆覆盖下不同施肥配比对表层土壤影响更大,并随着土层加深而减少。其原因是表层土壤能较好地与外界进行物质与能量交换,进入土壤的有机物质最先聚集于表层,养分条件好,土壤微生物活动旺盛,有利于微生物的繁殖。本试验同一处理的上下层土壤的微生物生物量碳有显著性差异,而微生物量氮均没有显著性差异。说明本研究中20cm表土层内微生物生物量碳氮均受到秸秆覆盖及施肥的影响,但是影响的程度和方式却不相同。
3.2PCR-DGGE技术是从微生物基因多样性的角度研究土壤微生物群落结构的方法,近年来己经成为国内外研究的热点[21]。与纯培养相比,PCR克隆、RFLP分析等非培养方法被用于研究不同环境下nifH基因的组成和多样性,更有利于对固氮生物进行完整和深入的探索和研究。采用PCR-DGGE方法对秸秆覆盖还田下不同施肥处理的土壤微生物nifH基因多样性及群落结构组成进行研究,从指纹图谱我们可以看出不同处理土壤固氮微生物群落结构有一定的差异。Juraeva等研究发现,土壤总氮含量能够影响固氮微生物的分布[22]。Keeling等研究表明,土壤碳氮比例影响着土壤固氮微生物的活性[23]。因此,土壤理化性质的差异可以影响固氮微生物的群落结构。对DGGE图谱进行聚类分析和多样性统计表明同层间SCKT、SCKS处理具有最高的多样性指数及丰富度,而仅CKT、CKS对照组这两个值最小。结果说明秸秆覆盖还田配合不同施肥措施改变了土壤的营养状况,改善土壤的生物学特征,导致土壤固氮微生物多样性发生变化。Baumann等研究也指出植物残留物能够影响微生物的呼吸和微生物群落结构[24]。从样品DGGE优势条带测序结果可以看出,这些条带中最多的是非培养固氮细菌,其余对应的同源性最高的微生物分别属于变形菌门(Proteobacteria),β-变形菌纲(Betaproteobacteria)的非培养伯克氏菌属、假食酸菌属(Pseudacidovorax)、Azospira属以及Ideonella属。说明本实验土壤中固氮菌遗传多样性较为丰富。Bodelier等也证明了像水稻这样的淹水作物的根际上壤中氧量较低,特别适合于进行生物固氮[25]。本研究运用PCR-DGGE方法得到的这些固氮细菌还未被培养或不可培养,故很难鉴定它们在耕作土壤中的生态功能,要具体了解这些优势菌群的结构与功能,还需要做更全面细致的研究。
[1] Jiang Y H, Yu Z R, Ma Y L. The effect of stubble return on Agro-ecological system and crop growth. Chinese Journal of Soil Science, 2001, 32(5): 209- 213.
[2] Hong C L, Wei Y Z, Huang J F, Wang R Y, Yang X E. Effects of total crop straw return on soil fertility and field ecological environment. Journal of Zhejiang University: Agriculture and Life Sciences, 2003, 29(6): 627- 633.
[3] Steenwerth K L, Jackson L E, Calderón F J, Stromberg M R, Scow K M. Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California. Soil Biology and Biochemistry, 2002, 34(11): 1599- 1611.
[4] David Tilman D, Johannes Knops J, David Wedin D, Reich P, Ritchie M, Siemann E. The influence of functional diversity and composition on ecosystem processes. Science, 1997, 277(5330): 1300- 1302
[5] Clough Y, Kruess A, Tscharntke T. Organic versus conventional arable farming systems: functional grouping helps understand staphylinid response. Agriculture, Ecosystems and Environment, 2007, 118(1/4): 285- 290.
[6] Yu C Y, Liu H, Xing Y D, Manukovskyd N S, Kovalevd V S, Gurevichd Y L. Bioconversion of rice straw into a soil-like substrate. Acta Astronautica 2008, 63(7/10): 1037- 1042.
[7] Bowen R M, Harper S H T. Decomposition of related compounds by fungi isolated from straw wheat straw and in arable soi1. Soil Biology Biochemistry, 1990, 22(3): 393- 399.
[8] Chen H, Tang X S, Lin J, Zhang B S, Ren D M. Community constitute and phylogenetic analysis on soil uncultured microorganism. Acta Microbiologica Sinica, 2002, 42(4): 478- 483.
[9] Kisand V, Wikner J. Limited resolution of 16S rDNA DGGE caused by melting properties and closely related DNA sequences. Journal of Microbiological Methods, 2003, 54(2): 83- 191.
[10] Dixon R, Kahn D. Genetic regulation of biological nitrogen fixation. Nature Reviews Microbiology, 2004, 2(8): 621- 631.
[11] Wu J S, Lin Q M, Huang Q Y, Xiao H A. The Method of Measuring Soil Microbial Biomass and Its Application. Beijing: China Meteorological Press, 2006.
[12] Dlallo M D, Wlllems A, Vloemans N, Cousin S, Vandekerckhove T T, de Lajudie P, Neyra M, Vyverman W, Gillis M, Van der Gucht K. Polymerase chain reaction denaturing gradient gel electrophoresis analysis of the N2-fixing bacterial diversity in soil under Acacia tortilis ssp. raddiana and Balanites aegyptiaca in the dryland part of Senegal. Environmental Microbiology, 2004, 6(4): 400- 415.
[13] Eichner C A, Erb R W, Timmis K N, Wagner-Döbler J. Thermal gradient gel electrophoresis analysis of bioprotection from pollutant shocks in the activated sludge microbial community. Applied and Environmental Microbiology, 1999, 65(1): 102- 109.
[14] Hedrick D B, Peacock A, Stephen J R, Macnaughton S J, Brüggemann J, White D C. Measuring soil microbial community diversity using polar lipid fatty acid and denaturing gradient gel electrophoresis data. Journal of Microbiological Methods, 2000, 41(3): 235- 248.
[15] Lin X G, Hu J L. Scientific connotation and ecological service function of soil microbial diversity. Acta Pedologica Sinica, 2008, 45(5): 892- 900.
[16] Zheng S X, Hu J L, Chen K, Yao J, Yu Z N, Lin X G. Soil microbial activity measured by microcalorimetry in response to long-term fertilization regimes and available phosphorous on heat evolution. Soil Biology and Biochemistry, 2009, 41(10): 2094- 2099.
[17] Lovell R D, Jarvis S C, Bardgett R D. Soil microbial biomass and activity in long-term grassland: effects of management changes. Soil Biology and Biochemistry, 1995, 27(7): 969- 975.
[18] Marschnera P, Kandeler E, Marschner B. Structure and function of the soil microbial community in a long-term fertilizer experiment. Soil Biology and Biochemistry, 2003, 35(3): 453- 461.
[19] Ye W P, Xie X L, Wang K R, Li Z G. Effects of rice straw manuring in different periods on growth and yield of rice. Chinese Journal of Rice Science, 2008, 22(1): 65- 70.
[20] Nie J, Zhou J M, Wang H Y, Chen X Q, Du C W. Effect of long-term rice straw return on soil Glomalin, Carbon and Nitrogen. Pedosphere, 2007, 17(3): 295- 302.
[21] Petra M, Pauline F G, Zed R. Microbial community composition and functioning in the rhizosphere of threeBanksiaspecies in native woodland in Western Australia. Applied Soil Ecology, 2005, 28(3): 191- 201.
[22] Juraeva D, George E, Davranov K, Ruppel S. Detection and quantification of thenifHgene in shoot and root of cucumber plants Canadian Journal of Microbiology, 2006, 52(8): 731- 739.
[23] Keeling A A, Cook J A, Wilcox A. Effects of carbohydrate application on diazotroph populations and nitrogen availability in grass swards established in garden waste compost. Bioresource Technology, 1998, 66(2): 3814- 3822.
[24] Baumann K, Marschner P, Smernik R J, Baldock J A. Residue chemistry and microbial community structure during decomposition of eucalypt, wheat and vetch residues. Soil Biology and Biochemistry, 2009, 41(9): 1966- 1975.
[25] Bodelier P L E. Interaction between oxygen-releasing roots and microbial processes in flooded soils and sediments//de Kroon H, Visser E J W, eds.Root Ecology. Ecology Studies. New York: Springer, 2003, 168: 331- 362.
参考文献:
[1] 江永红, 宇振荣, 马永良. 秸秆还田对农田生态系统及作物生长的影响. 土壤通报, 2001, 32(5): 209- 213.
[2] 洪春来, 魏幼璋, 黄锦法, 王润屹, 杨肖娥. 秸秆全量直接还田对土壤肥力及农田生态环境的影响研究. 浙江大学学报: 农业与生命科学版, 2003, 29(6): 627- 633.
[8] 陈灏, 唐小树, 林洁, 张伯生, 任大明. 不经培养的农田土壤微生物种群构成及系统分类的初步研究. 微生物学报, 2002, 42(4): 478- 483.
[11] 吴金水, 林启美, 黄巧云, 肖和艾. 土壤微生物量测定方法及其应用. 北京: 气象出版社, 2006: 54- 61.
[15] 林先贵, 胡君利. 土壤微生物多样性的科学内涵及其生态服务功能. 土壤学报, 2008, 45(5): 892- 900.
[19] 叶文培, 谢小立, 王凯荣, 李志国. 不同时期秸秆还田对水稻生长发育及产量的影响. 中国水稻科学, 2008, 22(1): 65- 70.
Effectofdifferentfertilizercombinationsandstrawreturnonmicrobialbiomassandnitrogen-fixingbacteriacommunityinapaddysoil
LIU Xiaoqian1, TU Shihua2, SUN Xifa2, GU Yunfu1, ZHANG Xianqin1, ZHANG Xiaoping1,*
1CollegeofResourcesandEnvironment,SichuanAgriculturalUniversity,Chengdu611130,China2SoilandFertilizerInstitute,SichuanAcademyofAgriculturalSciences,Chengdu610066,China
Chloroform fumigation and denaturing gradient gel electrophoresis(DGGE) were employed to study the influence of different fertilizer treatments with crop residue return on microbial biomass and nitrogen-fixing bacteria community in a gray brown alluvial paddy soil at soil depth of 0—10 cm and 10—20cm. Results show that soil microbial biomass carbon (SMB-C), microbial biomass nitrogen (SMB-N) and diversity of nitrogen-fixing bacteria decreased with soil depths. The control treatment with straw removal had the lowest amounts of SMB-C and SMB-N. Among the treatments receiving straw return, the quantity of SMB-C and SMB-N in the treatments with low nitrogen rate and omitting was significantly lower than the full rate NPK treatment. Omission of phosphate on the basis of NPK nonsignificantly reduced the SMB-N compared to the NPK treatment. It shows that straw mulching with addition of adequate NPK fertilizers can significantly increase the SMB-C and SMB-N. The diversity indices of DGGE profiles indicate that the treatment with adequate NPK had the most abundant nitrogen-fixing bacterial diversity. According to UPGMA cluster analysis, dendrogram of the 10 treatments were different, and the micro-organisms at the 0—10cm and 10—20cm in the control treatment differed from all the other treatments and stood alone in a separate group. DGGE bands sequencing further revealed that the 14 closely related species were largely uncultured bacterianifHgene fragment with the predominant community falling in the class of Proteobacteria in Betaproteobacteria. Application of PCR-DGGE can well interpret the community structure characteristics of the nitrogen-fixing bacteria molecules in the gray-brown alluvial paddy soil with straw return and different fertilizer treatments.
straw return; gray-brown alluvial paddy soil; microbial biomass; PCR-DGGE; nitrogen-fixing bacteria community
农业部公益性行业(农业)科研专项资助(201003016)
2012- 05- 29;
2012- 10- 26
*通讯作者Corresponding author.E-mail: luwenru@mail.caas.net.cn
10.5846/stxb201205290788
刘骁蒨,涂仕华,孙锡发,辜运富,张先琴,张小平.秸秆还田与施肥对稻田土壤微生物生物量及固氮菌群落结构的影响.生态学报,2013,33(17):5210- 5218.
Liu X Q, Tu S H, Sun X F, Gu Y F, Zhang X Q, Zhang X P.Effect of different fertilizer combinations and straw return on microbial biomass and nitrogen-fixing bacteria community in a paddy soil.Acta Ecologica Sinica,2013,33(17):5210- 5218.
——固氮微生物

