原发性胃腺鳞癌2 例报道并文献复习
沈 靖,芦华莉
原发性胃腺鳞癌(PACS)由Rolleston 在1905 年首先报道,是一类高度恶性极其少见的恶性肿瘤,其好发部位和肉眼形态与一般的腺癌大致相似,组织学表现为肿瘤中同时有腺癌和鳞癌成分混杂存在,有人认为它与胃鳞癌属同一类型,因为在鳞癌病例中如多作切片仔细寻找终可找到腺癌病灶[1]。本文报道2 例PACS,复习临床资料,对其组织学、免疫组化进行观察并复习文献[2],旨在探讨其发病率、临床病理特点、鉴别诊断及预后。
1 资料与方法
1.1 资料 例1:患者男,83 岁。纳差、乏力20 余天。CT 显示胃壁局限性增厚,胃腔内见团块状中等密度影。胃镜检查见胃体大弯侧巨大隆起新生物,表面糜烂呈分叶状,质地脆易出血,组织活检病理诊断为恶性肿瘤。入院行远端胃癌根治术,术中见胃大弯侧有一直径约5 cm 肿块向胃腔内生长。例2:患者女,59 岁。上腹胀痛不适、消瘦、乏力6 个月。经胃镜检查病理诊断胃癌入院行胃癌根治术,术中见胃窦部小弯侧巨大溃疡直径约7 cm。
1.2 方法 2 例标本均经10%福尔马林固定,常规石蜡切片,HE 染色,常规病理学检查。采用S-P 法进行免疫组化染色:选用CK 高分子,CK 低分子,NSE,Syn,CgA 均购自福州迈新生物技术开发有限公司。
2 结果
2.1 肉眼观察 例1 标本:远端胃大部切除标本,距上切缘1.6 cm 胃体大弯侧见隆起型肿块6.0 cm×3.5 cm,切面灰白,底部深约3.0 cm。例2 标本:次全胃,于胃窦部小弯侧见一巨大溃疡型肿块9.0 cm×8.0 cm,边缘隆起,底部深2.5 cm,外观灰褐色,切面灰白,质地粗糙无光泽,肿瘤边缘至切除缘间黏膜完好,小弯及大弯侧淋巴结肿大。
2.2 镜检 2 例标本镜下形态相似,病变由鳞癌和腺癌2 种成分混合构成,腺癌分化相对较好呈腺腔样结构,鳞癌分化较差,肿瘤细胞呈巢团状,边界清楚,巢周围细胞呈栅栏状排列,巢内可见微囊性腔隙,中央可见坏死,部分巢团中央见角化珠,肿瘤细胞大小不一,核异型明显,核分裂多见。见图1~图4。
2.3 免疫组化 肿瘤细胞NSE(-),CgA(-),Syn(-),巢团中间瘤细胞CK 高分子(+),巢团周边及腺体CK 低分子(+)。见图5~图6。
3 讨论
3.1 胃腺鳞癌发病率 胃腺鳞癌是一种罕见的胃恶性肿瘤,占所有胃癌的0.5%,检索1999~2012 年国内文献,确诊胃腺鳞癌51 例,中位年龄58 岁,最小34 岁,最大91 岁,男、女发病率之比为2.6:1,好发部位依次为胃窦部、胃体、胃窦体部,胃底。本组2 例:男、女各1 例,年龄分别为83 岁、59 岁,部位分别位于胃体大弯侧,胃窦部小弯侧。

图1 肿瘤呈巢状分布,中央可见细胞角化(HE 中倍放大)

图2 细胞巢外周呈栅栏状排列,中央见角化珠(HE高倍放大)

图3 细胞分化较差,但部分细胞仍可见角化(HE 高倍放大)

图4 可见明显的腺腔样结构(HE 中倍放大)
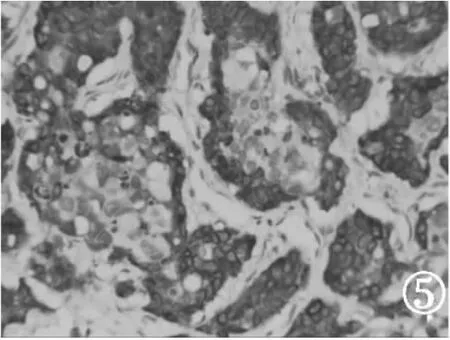
图5 CK 低分子部分肿瘤巢周边细胞阳性(HE 高倍放大)

图6 CK 高分子肿瘤巢中央细胞阳性(HE 高倍放大)
3.2 病理表现 PACS 由鳞状上皮与柱状上皮或腺上皮2 种成分组成,均表现为明显的异型性。其病理诊断要点:必须有肯定腺癌和鳞癌2 种成分相互混合构成,在数量上均不占优争议,国内有些学者认为两者必须都在10%以上,也有认为两者成分的量几乎相等或其中之一不少于1/3,国外ROBERT D.ODZE 等[3]认为肿瘤性鳞状成分至少占30%,本组2 例肿瘤腺癌和鳞癌数量都在30%以上。PACS 鳞状上皮可呈实性巢状排列,部分细胞似基底细胞样,细胞巢周围呈栅栏状排列伴粉刺状坏死,腺上皮有时分化很差如印戒细胞样,但两者在部分区域总能找到各自特征性的结构,鳞癌如角化珠、细胞间桥、角化细胞,腺癌如明显的柱状上皮及腺体或有黏液生成。PACS 免疫组化表现为鳞状上皮CK5/6 、CK 高分子、P63 明显阳性而CK8/18 呈灶性表达,腺上皮CK 低分子、CK8/18 明显表达。
3.3 鉴别诊断 (1)碰撞癌:由腺癌和鳞癌构成,但2 种成分有明显分界而PACS 两种成分相互混合。(2)腺棘皮癌:腺癌中有鳞状上皮化生成分而无鳞癌成分。(3)胃小细胞癌:也可呈实性或片状生长方式,偶尔伴有腺泡状或小梁状结构,基底呈栅栏状排列。免疫组化Syn 和CgA 阳性表达。(4)胃腺癌伴神经内分泌分化:也常表现巢团状结构,但找不到明确鳞癌成分,神经内分泌标记如NSE 常阳性。(5)其它:诊断胃腺鳞癌时需要排除食管下段鳞状细胞癌及其它脏器如肺、喉、宫颈等鳞癌转移或浸润至胃。
3.4 发病机制 有关腺鳞癌中鳞癌的起源仍存在争论,部分学者认为鳞状成分可能起源于腺癌细胞的鳞状化生;或异位鳞状上皮或多能干细胞的双向分化[3]。本组2 例均在肿瘤成分旁可见部分腺体鳞状上皮化生,支持腺鳞癌是由腺体鳞化所致这一观点。国外有1 例报道腺鳞癌伴EBV 病毒感染,推测它发生可能与EBV 病毒感染有关[3]。
3.5 治疗与预后 本病对放疗和化疗均不敏感,治疗主要以手术切除为主。大多数病例发生于胃窦部,诊断时已是晚期,肿瘤浸润深常伴淋巴管侵犯,病变进展快,预后差;肿块位于黏膜层和黏膜下层的腺鳞癌对大剂量化疗有很好反应,预后相对较好。Ikeda 等[4]报道1 例进展期胃腺鳞癌采用新辅助化疗,术后13 个月无复发。一般认为胃鳞癌预后比腺癌好,腺鳞癌预后最差,其生物学行为主要取决于腺癌的分化程度。朱慧能等[5]报道11 例胃腺鳞癌,随访10 例,术后生存4~38 个月,平均(13.72 + / -3.64)个月,中位生存时间11 个月,1、2、和3 年生存率分别为4.8%、12.5%和12.5%。裴炜等[6]报道11 例胃腺鳞癌术后中位生存时间为8 个月。周慧娟等[7]报道9 例腺鳞癌术后生存期平均为6.6 个月。本组1 例男性患者电话随访术后生存10 个月。
[1] 顾绥岳,主编. 实用外科病理学[M]. 镇江:江苏科学技术出版社,1987:265-266.
[2] 回允中,主译.Rosai&Ackerman 外科病理学[M]. 第9 版. 北京:北京大学出版社,2006:351-667.
[3] Robert D. Odze &Johnr. Goldblum. Surgical Pathology of the GI Tract,Liver,Biliary Tract,and Pancreas[M].2nd ed. Philadelphia:Saunders Co,2009:Part1-Gastrointestinal Tract-Morphologic Subtypes Of Gastric Adenocarcinoma-ADENOSQUAMOUS AND SQUAMOUS CELL CARCINOMA.
[4] Ikeda E,Shigematsu T,Hidaka K,et al. A case of adenosquamous gastric carcinoma successfully treated with TS-1,lowdose CDDP and docetaxel as neoadjuvant chemotherapy[J]. Gan To Kagaku Ryoho,2007,34:423-426.
[5] 朱慧能,吴 捷,孙文勇.胃腺鳞癌11 例临床病理分析[J].浙江医学,2009,(31)11:360-361.
[6] 裴 炜,张海增,石素胜,等. 原发性胃腺鳞癌11 例临床病理分析[J].实用癌症杂志,2008,23(4):369-371.
[7] 周素娟,刘素香.胃原发性鳞状细胞癌和腺鳞癌13 例临床病理分析[J].中国肿瘤临床,2003,30(3):217-218.

