两种苹果砧木根系水力结构及其PV曲线水分参数对干旱胁迫的响应
张林森,张海亭,胡景江,权 静,胥生荣,韩明玉,马锋旺
(1.西北农林科技大学园艺学院,杨凌 712100;2.西北农林科技大学生命科学学院,杨凌 712100)
西北黄土高原地区是世界苹果优生区之一,该区苹果栽植规模大、分布集中,近年来已发展为中国苹果的重要产地,种植面积为114万hm2,其产量占中国苹果产量的40%。但是由于该地区自然降水量少、季节性分布不均,蒸发量大,干旱已经成为该地区苹果发展的主要限制因子,采用抗旱型砧木等生物节水措施是苹果节水栽培的一个重要方向。在土壤-植物-大气连续体(SPAC系统)中,根系能够率先感知干旱信号,协调地上部分的行为,从而促使植物适应干旱环境。近年来国内外学者对植物根系水力结构和压力室-容积PV曲线水分参数及其影响因素做了大量的研究,认为影响植物根系水力结构差异性除去不同植物品种砧木因素外,还有环境因素,如温度、水分、养分等。在水分方面,植物在遭受一定的干旱胁迫时导水率会有明显的降低,植物体内导水阻力会显著升高[1-3]。对乳香树(Pistacia lentiscus L.)和软木槲(Quercus suber L.)研究发现,在水分亏缺的前提下,高浓度混合肥能够使根的脆弱性增加[4]。Morales对番茄(Lycopersicon esculentum Mill)研究发现,高温处理初期西红柿导水率出现降低[5]。Atkinson研究了苹果 M.27、M.9、MM.106等砧木品种[6]和Clearwater研究了猕猴桃不同生长势的砧木品种[7],发现根系导水率差异性很大,可能最终影响到砧木对干旱胁迫的响应。同时,根系导水率的降低与解剖结构和水通道蛋白活性降低密切相关[8]。
PV曲线作为植物抗旱性研究的重要手段,在灌木和乔木的比较抗旱性研究中都有应用。同时有学者结合PV曲线技术对木本植物栓塞恢复进行了研究,从多方面阐述了植物的抗旱性机理[9-10]。平邑甜茶和楸子作为苹果生产中广泛应用的砧木,其综合特性比较典型。近年来,国内外学者对单一植物经过不同胁迫下(高温、盐胁迫、干旱)植物水力结构方面做了大量研究,但是利用高压流速仪(HPFM),分析干旱胁迫对苹果不同砧木类型水通道蛋白与根系导水率之间的关系以及苹果砧木PV曲线水分参数方面的研究尚未见报道。通过对不同水分条件下2种砧木根系水力结构和PV曲线参数、水通道蛋白抑制和去抑制的研究,来反映植物根系水力结构和PV曲线参数在干旱逆境来临后,其参数上的适应性变化,从而探讨不同水分处理下苹果砧木的根系水力结构和PV曲线参数变化的机理,进而为抗旱苹果砧木的应用、选育、评价提供理论依据。
1 材料与方法
1.1 试验时间、地点
试验于2011年3月至8月在陕西杨凌官村苹果产业技术体系示范苗圃的遮雨棚中进行(N 34°18′,E 108°04′,海拔543 m),属暖温带季风半湿润气候区。
1.2 试材选取及栽植
2011年3月初,选取1年生对干旱敏感的平邑甜茶[Malus hupehensis(Pamp)Rehd.]和抗旱的楸子[Malus prunifolia(Willd)Borkh.]。栽种于规格为45 cm×30 cm的塑料生长桶中,每桶定植1株。供试土壤为遮雨棚附近村庄的0—20 cm耕层壤土。土壤用50%多菌灵可湿性粉剂按照1∶1000配制来进行消毒。土与基质按1∶1的比例混匀(田间持水量为28.4%)。每桶装营养土15 kg。为增加桶内的通气性,在每个塑料桶底部打3个小孔(1 cm×1 cm)。为进行水分控制防止土壤水分通过表面蒸发,在桶上部包裹45 cm×40 cm的白色塑料袋,桶的外部包有反光膜,防止土壤温度过高。用称重法补充土壤水分含量。
1.3 试验设计
水分处理在7月上旬进行,8月初进行试验,土壤水分设2个水平:即适宜水分(Control,灌水区间为田间持水量的70%—75%);重度干旱(Treatment,灌水区间为田间持水量的40%—45%),2个砧木,共4个处理,每个处理7个重复,随机排列。
1.4 试验分析
1.4.1 导水率、比导水率
用美国Dynamax公司生产的高压流速仪(high pressure flow meter,HPFM)进行田间原位测定。HPFM测定时压力比率每秒达3—7 kPa,对植物组织进行注射持续增压到大约500 kPa时,根据去汽水流速和压力随时间的变化关系,反应植物内部阻力和导水率随时间的变化关系,其曲线斜率表示导水率,即流速与压力之间的比值。在测定根系导水率时,将平邑甜茶和楸子沿地面以上5 cm左右用刀片切割,切割点以下测定根系导水率(K soil-stem)。根系叶比导率为根系导水率与叶面积的比值(Klroot),根系茎比导率为根系导水率与茎部横截面积的比值(Ksroot)。
1.4.2 氯化汞(MC)及 β-巯基乙醇(β-ME)处理
分别选取平邑甜茶和楸子及其水分处理的苗子,将根系做如下处理:(1)50 μmol/L MC处理根系20 min;(2)100 μmol/L MC 处理根系 20 min;(3)500 μmol/L β-ME 处理幼苗根系 20 min;(4)1000 μmol/L β-ME处理幼苗根系20 min;(5)先用(1)处理,再分别用(3)或(4)进行恢复性处理根系20 min;(6)先用(2)处理,再分别用(3)或(4)进行恢复性处理根系20 min。
1.4.3 PV曲线的测定
于8月初将供试苗木截取10 cm长的带叶主枝,立即用万分之一电子天平称鲜重。然后将枝条插入盛有清水的烧杯中,置于黑暗条件下,饱和吸水24 h,迅速称其饱和鲜重并立即装入美国PMS公司生产的MODEL-1000压力室,用Hammel[11-12]法进行PV曲线的绘制。由于PV曲线重复性好[13-15],每个处理只选择1—2个枝条进行测定。计算初始质壁分离膨压为0时的渗透势(ψstlp)、饱和含水时的渗透势(ψssat)、初始质壁分离膨压为0时的相对水含量(RWCtlp)和相对渗透水含量(ROWCtlp)、组织细胞总体弹性模量(ε′)、束缚水含量(Va)、膨压随叶水势下降而减少的直线方程斜率b值等水分参数。应用反隶属函数方法分析各项水分参数,对植物保持膨压的能力进行综合评价。采用反隶属函数值公式为:

先分别计算各项水分参数隶属函数值,最后取其平均值(Δ值),Δ值越大,综合表现出植物保持膨压的能力越强,其对不良环境的适应性越强[16]。
1.4.4 叶面积和气体交换的测定
用美国LICOR公司生产的Li-3000叶面积仪和英国PP-systems公司生产的Ciras-2便携式光合仪分别进行叶面积和气体交换的测定。
1.4.5 数据分析
采用SPSS17.0统计分析软件对所得数据进行处理,首先对不同处理间进行方差分析,若差异显著,再进一步进行LSD多重比较。采用SigmaPlot10.0进行作图。
2 结果及分析
2.1 水分亏缺下平邑甜茶和楸子根系水力结构的变化
在水分亏缺时平邑甜茶和楸子的根系导水率、根系叶比导水率和根系茎比导水率如表1所示:重度干旱可以导致根系导水率下降,水分处理之间差异显著,其中平邑甜茶和楸子在重度胁迫下根系导水率分别减少为适宜水分条件下的50%和57%。适宜水分条件下平邑甜茶根系导水率大于楸子根系导水率,但是在重度干旱条件下,平邑甜茶根系导水率与楸子相比反而出现变小。重度干旱可以导致根系叶比导水率下降,水分处理之间差异显著,其中平邑甜茶和楸子在重度胁迫下根系叶比导水率分别减少为适宜水分条件下的78%和80%。适宜水分和重度干旱条件下,平邑甜茶根系叶比导水率小于楸子根系叶比导水率,平邑甜茶根系叶比导水率分别为楸子根系叶比导水率的95%和92%。重度干旱可以导致根系茎比导水率下降,水分处理之间差异明显,其中平邑甜茶和楸子在重度胁迫下根系茎比导水率分别减少为适宜水分条件下的60%和50%。适宜水分和重度干旱条件下平邑甜茶根系茎比导水率小于楸子根系茎比导水率,平邑甜茶根系茎比导水率分别为楸子根系茎比导水率的52%和62%。
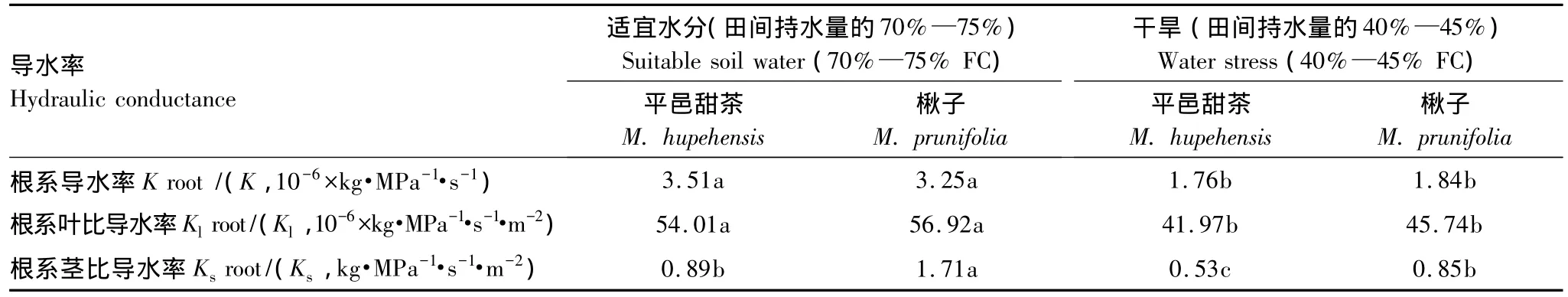
表1 水分亏缺对平邑甜茶和楸子水力结构的影响Table 1 Effect of water deficit on hydraulic architecture of Malus hupehensis and Malus prunifolia
2.2 水通道蛋白抑制剂(MC)和去抑制剂(β-ME)处理下的平邑甜茶和楸子根导水率的变化
表2可以看出:适宜水分时,经过50和100 μmol/L MC处理后,平邑甜茶的根系导水率与对照相比下降了49%和55%,楸子的根系导水率与对照相比下降了26%和41%;随后通过500和1000 μmol/Lβ-ME处理,平邑甜茶的根系导水率与抑制处理相比恢复了6%—32%,楸子的根系导水率与抑制处理相比恢复了11%—31%。严重干旱时,经过50和100 μmol/L MC处理后,平邑甜茶的根系导水率与对照相比下降了16%和26%,楸子的根系导水率与对照相比下降了16%和30%;随后通过500和1000 μmol/Lβ-ME处理,平邑甜茶的根系导水率与抑制处理相比恢复了6%—30%,楸子的根系导水率与抑制处理相比恢复了9%—38%。可以得知,MC浓度越高,水通道蛋白受抑制越多,根系导水率下降也越多;β-ME浓度越高,根系导水率恢复越多,但不会完全恢复。在干旱过程中,胁迫可能会引起了水通道蛋白活性下降,导致了根系导水率的下降。

表2 水通道蛋白抑制剂和去抑制剂对平邑甜茶和楸子根系导水率的影响Table 2 Effect of inhibitor and exhibitor of Aquaporins on hydraulic conductance of Malus hupehensis and Malus prunifolia
2.3 水分亏缺对平邑甜茶和楸子气体交换参数的影响
图1表明,在严重干旱下,平邑甜茶和楸子的净光合速率、蒸腾速率、气孔导度与对照相比均明显下降,胞间CO2浓度与对照相比出现下降。其中平邑甜茶的净光合速率、蒸腾速率、气孔导度、胞间CO2浓度与对照相比分别下降了71%、82%、94%、41%;楸子的净光合速率、蒸腾速率、气孔导度、胞间CO2浓度与对照相比分别下降了66%、80%、85%、54%。在严重干旱下,平邑甜茶和楸子的净光合速率和胞间CO2浓度均出现下降,可以表明净光合速率的下降是由气孔限制引起的[17]。
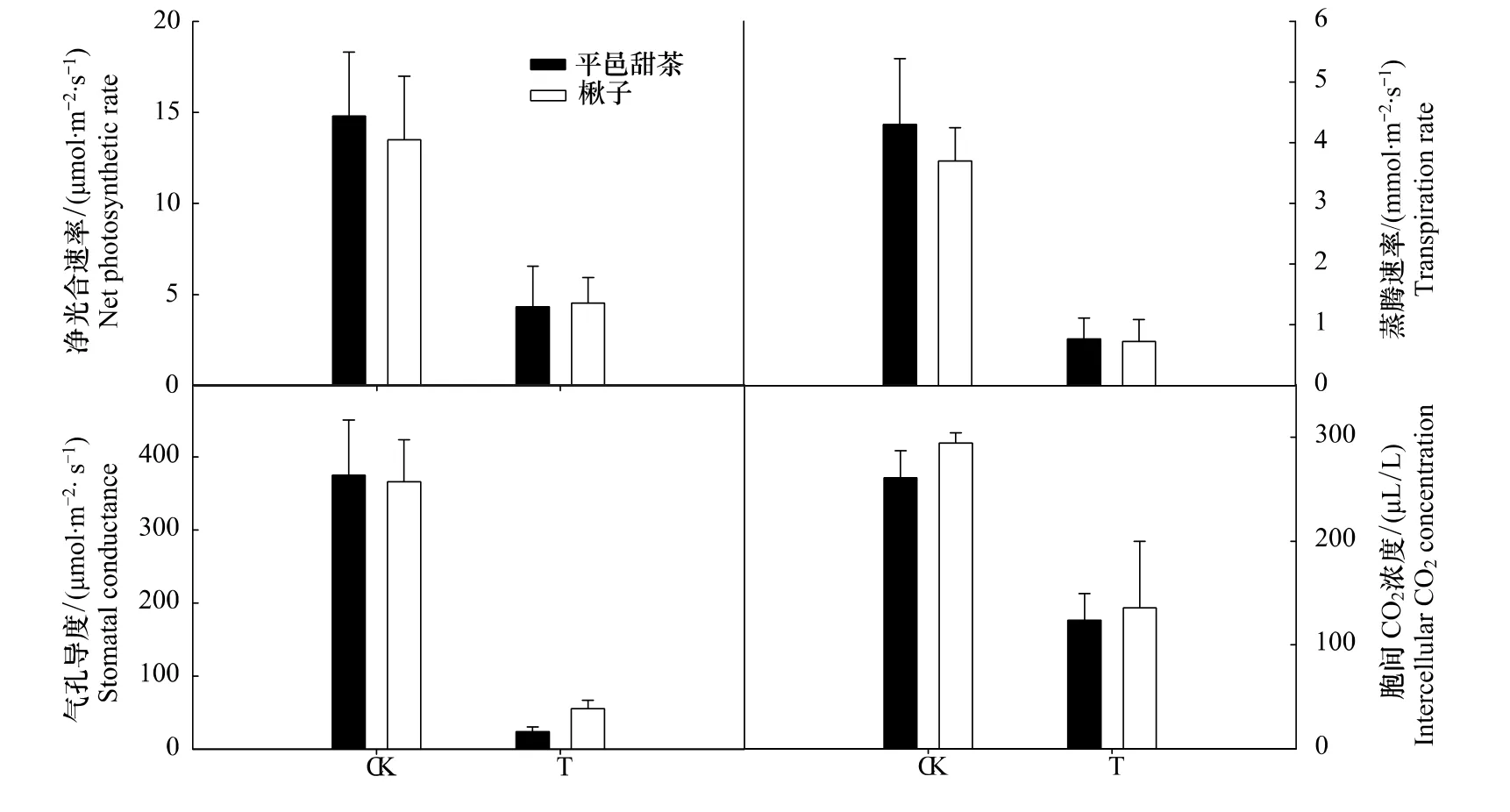
图1 水分亏缺对平邑甜茶和楸子气体交换参数的影响Fig.1 Effect of water deficit on leaf gas exchange of Malus hupehensis and Malus prunifolia
2.4 水分亏缺下平邑甜茶和楸子PV曲线水分参数及其抗旱性比较
表3表明,当重度干旱时,平邑甜茶和楸子的ψstlp都出现了下降,与对照相比分别下降了27%和13%,说明干旱胁迫下植物维持膨压的能力得到了加强。重度干旱下平邑甜茶和楸子的ψssat与对照相比分别下降了18%和10%,在重度干旱时楸子ψssat变化较小,其保持最大膨压的能力基本未受到干旱的影响。干旱引起了平邑甜茶和楸子细胞内渗透调节物质的增加,致使ψssat在严重干旱胁迫时出现降低。重度干旱下平邑甜茶和楸子的RWCtlp与对照相比分别下降了16%和16%,平邑甜茶和楸子的ROWCtlp与对照相比分别下降了8%和20%。在重度干旱时,平邑甜茶和楸子的Va都略有增加,增幅分别为7%和1%。重度干旱下平邑甜茶和楸子的ε′与对照相比分别下降了6%和20%,表明出现植物水分胁迫时,细胞弹性得到了增强。对照和重度干旱下平邑甜茶和楸子b值变化不明显。对平邑甜茶和楸子膨压保持能力综合分析所得到的Δ值比较发现,对照和重度干旱胁迫下楸子的Δ值是平邑甜茶的6.14倍和2.45倍。
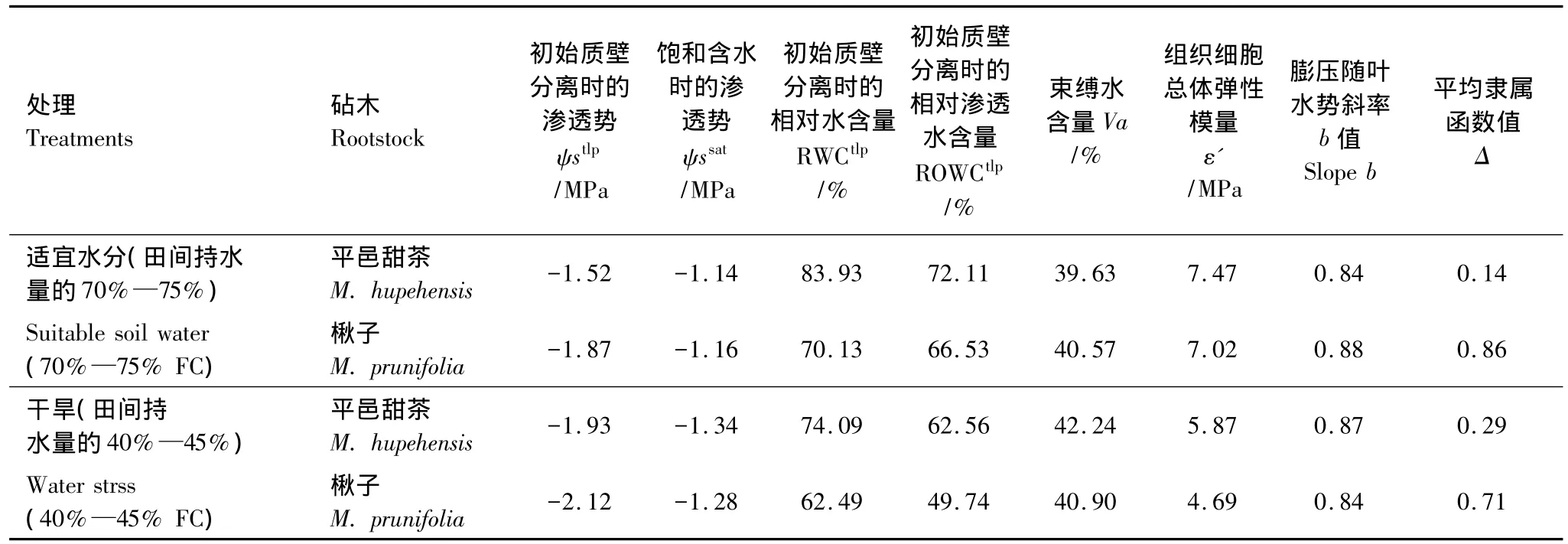
表3 平邑甜茶和楸子水分亏缺下的水分参数Table 3 Water parameters of Malus hupehensis and Malus prunifolia under water deficit
3 讨论
导水率表示离体茎段水流量与水流通过该茎段时压力梯度的比值,导水率越大,导水能力越强。比导率反应树木器官输水系统效率。在植物茎部横截面积或叶面积一定的情况下,比导率越大,单位有效面积输水能力越强[18]。随着水分胁迫的加重,平邑甜茶和楸子的根系导水率、根系叶比导水率、根系茎比导水率出现减少。干旱胁迫可以降低植株的水力结构特征,但是楸子与平邑甜茶相比在根系茎比导水率和根系叶比导水率上出现了增加,从而在一定程度上,保证了植株的生长发育、抵御了不良环境。本试验研究发现干旱胁迫会导致平邑甜茶和楸子的根系导水率、根系叶比导水率、根系茎比导水率出现减少。但是楸子的根系茎比导水率和根系叶比导水率与平邑甜茶相比出现了增加,使楸子在单位叶面积和单位茎截面积的水分运输效率得到增加,增加了植株的抗逆性,说明植物会随着胁迫的来临,优化水力结构特征从而改变自身供水策略。
Stedule[19]指出,胁迫会导致植物根系导水率的降低,Togenetti[20]等人对水分处理后的阿勒颇松幼苗研究发现,经过严重干旱处理后,其导水率普遍低于正常灌溉的苗木,并且其木质部出现栓塞化。植物体受到干旱胁迫时能够做出多种应激反应,在水力结构方面是其木质部水势下降,导管内张力增加,木质部导水率下降等。根系可以通过土壤周围水分状况来调节自身吸收能力,通过合成ABA致使气孔关闭,同时木质部产生气穴并引起栓塞,使植物体内导水能力减弱,从而限制水分散失,达到保水的目的[21]。汞离子可以与水通道蛋白上面的半胱氨酸特异形结合来抑制水通道蛋白的活性,β-ME可以局部解除汞离子等抑制剂对水通道蛋白的作用,来恢复根系细胞到细胞的水分传递,从而恢复根系导水率[22-25],这可能与水通道蛋白活性恢复有关[26]。Lovisolo研究发现耐旱的葡萄品种具有更高的细胞-细胞之间共质体的水分运输,这表明耐旱品种可能具有较多的水孔蛋白数量[27]。适宜水分时,经过MC处理后,平邑甜茶导水率较楸子具有更大的变化幅度,但是在严重干旱时,经过MC和β-ME处理后楸子导水率较平邑甜茶具有更大的变化幅度,这说明严重干旱时,楸子这个耐旱品种与平邑甜茶相比可能具有更大的水孔蛋白表达量来抵御干旱胁迫。通过对平邑甜茶和楸子水通道蛋白抑制剂和去抑制剂处理可以发现,平邑甜茶和楸子在适宜水分条件下进行100 μmol/L氯化汞处理下的导水率与严重干旱胁迫下的导水率在同一显著水平上,这说明水分胁迫时平邑甜茶和楸子根系导水率的降低的原因之一,可能是因为水通道蛋白受到了干旱的抑制,致使水通道蛋白活性出现降低。进一步可以通过干旱胁迫下水通道蛋白的基因表达量分析和在氯化汞抑制剂下根系导水率差异与最大导水率的比值来初步估算不同砧木类型水通道蛋白的表达量。在平邑甜茶和楸子严重干旱时,其净光合速率、蒸腾速率、气孔导度、胞间CO2浓度均出现了下降。水分胁迫时,光合作用受到的影响,常常与导水率的降低伴随着出现[28]。
植物自身随着胁迫的来临,其自身能够进行适应性的调整。ψstlp、ψssat、RWCtlp、ROWCtlp、Va、b等PV曲线水分参数与植物细胞维持膨压的能力有关,ε′值越大表明细胞壁弹性越小。当组织含水量下降时,高弹性组织比低弹性组织在保持较大膨压上更有优势[29]。PV曲线水分参数的变化,体现了植物对环境的积极响应[15]。对平邑甜茶和楸子PV曲线水分参数研究发现,在严重干旱的情况下平邑甜茶和楸子的PV曲线水分参数与适宜条件下相比较出现了一些适应性的变化。楸子的ψstlp、ψssat、RWCtlp、ROWCtlp、ε′值与平邑甜茶相比较均处于较低水平,Va值处在较高水平,同时对PV曲线水分参数进行反隶属函数方法综合分析得出楸子的Δ值大于平邑甜茶。楸子保持膨压的能力更强,具有更好的细胞壁弹性,其对不良环境的适应性强。在重度干旱时平邑甜茶和楸子b值变化不明显。Δ值越大,表现出植物保持膨压的能力越强,其对不良环境的适应性越明显。在适宜水分和重度干旱条件下,楸子的Δ值大于平邑甜茶的Δ值,表明楸子在保持较大膨压方面比平邑甜茶更占优势。但在是适宜水分和严重干旱条件下,平邑甜茶和楸子之间b值差异不明显。PV曲线水分参数能够随着植物所处的环境,做出相应的调整。对于PV曲线水分参数研究发现,楸子在膨压保持方面与平邑甜茶相比,其抗旱性优于平邑甜茶。
[1] Passioura J B.Water transport in and to roots.Annual Review of Plant Physiology and Plant Molecular Biology,1988,39:245-265.
[2] Shen Y F,Wang B L,Qu D,Chen R F.Effects of phosphorus on root hydraulic conductance of corn under water stress.Journal of Northwest Sci-Tech University of Agriculture and Forestry,2002,30(5):11-13.
[3] Huang J Y,Zhang S X,Feng H J.Relationships between xylem embolism and nitrogen fertilization in four woody plants.Journal of Northwest Forestry University,2005,20(3):36-39.
[4] Hernándeza E I,Vilagrosa A,Luis V C,Llorca M,Chirino E,Vallejo V R.Root hydraulic conductance,gas exchange and leaf water potential in seedlings of Pistacia lentiscus L.and Quercus suber L.grown under different fertilization and light regimes.Environmental and Experimental Botany,2009,67(1):269-276.
[5] Morales D,Rodríguez P,Dell′Amico J,Nicolás E,Torrecillas A,Sánchez-Blanco M J.High-temperature preconditioning and thermal shock imposition affects water relations,gas exchange and root hydraulic conductivity in tomato.Biologia Plantarum,2003,47(2):203-208.
[6] Atkinson C J,Else M A,Taylor L,Dover C J.Root and stem hydraulic conductivity as determinants of growth potential in grafted trees of apple(Malus pumila Mill.).Journal of Experimental Botany,2003,54(385):1221-1229.
[7] Clearwater M J,Lowe R G,Hofstee B J,Barclay C,Mandemaker A J,Blattmann P.Hydraulic conductance and rootstock effects in grafted vines of kiwifruit.Journal of Experimental Botany,2004,55(401):1371-1382.
[8] North G B,Martre P,Nobel P S.Aquaporins account for variations in hydraulic conductance for metabolically active root regions of Agave deserti in wet,dry,and rewetted soil.Plant Cell Environ,2004,27(2):219-228.
[9] Han G,Li Y J,Sun D X,Zhao Z H.The response of pressure-volume curve water parameters of four desert shurb seedlings to drought stress.Acta Botanica Boreali-Occidentalia Sinica,2008,28(7):1422-1428.
[10] An F,C J,Jiang Z M,Zhang Y Y,Lan Y G,Zhang S H X.Refilling of embolism in the xylem of eight tree species and its relationship with Pressure-Volume parameters.Journal of Northwest A and F University:Natural Science Edition,2006,34(1):38-43.
[11] Tyree M T,Hammel H T.The measurement of the turgor pressure and the water relations of plants by pressure bomb technique.Journal of Experimental Botany,1972,23(1):267-282.
[12] Wang W L.The applications of pressure chamber in the study of water situation in plant.Plant Physiology Communications,1984,(3):52-57.
[13] Yang M R.Pressure volume curve water parameters and leaf water potentials of three shrubs and its significance in afforestation.Inner Mongolia Forestry Science and Technology,1992,(3):26-30.
[14] Dong X J.Experimental measurement of the water relations parameters of nine shrubs ecological interpretations.Acta Botanica Sinica,1998,140(7):657-664.
[15] Sun Z H,Wang Q C.The drought resistance of four broad leaved species in the north of China with PV technique.Scientia Silvae Sinicae,2003,39(2):33-38.
[16] Yang M S,Pei B H,Yu D M.Influence of water stress on the abilities to maintain turgor and adjust osmosis in seedlings of hybrid clones of Populus tomentosa.Acta Ecologica Sinica,1997,17(4):364-370.
[17] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis.Annual Review of Plant Physiology,1982,33(1):317-345.
[18] Li J Y,Zhai H B.Hydraulic architecture and drought resistance of woody plants.Chinese Journal of Applied Ecology,2000,11(2):301-305.
[19] Steudle E.Water transport across roots.Plant Soil,1994,167(1):79-90.
[20] Tognetti R,Michelozzi M,Giovannelli A.Geographical variation in water relations,hudraulic architecture and terpene composition of Aleppo pine seedlings from Italian provenances.Tree Physiology,1997,17(4):241-250.
[21] Davies W J,Zhang J.Root signals and the regulation of growth and development of plants in drying soil.Annual Review of Plant Physiology and Plant Molecular Biology,1991,42:55-76.
[22] Zhang W H,Tyerman S D.Inhibition of water channels by HgCl2in intact wheat root cells.Plant Physiology,1999,120(3):849-858.
[23] Martre P,North G B,Nobel P S.Hydraulic conductance and mercury-sensitive water transport for roots of Opuntia acanthocarpa in relation to soil drying and rewetting.Plant Physiology,2001,126(1):352-362.
[24] Wan X C,Zwiazek J J.Mercuric chloride effects on root water transport in aspen seedlings.Plant Physiology,1999,121(3):939-946.
[25] Maurel C,Verdoucq L,Luu D T,Santoni V.Plant aquaporins:membrane channels with multiple integrated functions.Annual Review of Plant Biology,2008,59(1):595-624.
[26] Chrispeels M J,Agre P.Aquaporins:water-channel proteins of plant and a mal cells.Trends in Biochemical Sciences,1994,19(10):421-425.
[27] Lovisolo C,Tramontini S,Flexas J,Schubert A.Mercurial inhibition of root hydraulic conductance in Vitis spp.rootstocks under water stress.Environmental and Experimental Botany,2008,63(1/3):178-182.
[28] Nicolás E,Torrecillas A,Amico J D,Alarcón J J.Sap flow,gas exchange,and hydraulic conductance of young apricot trees growing under a shading net and different water supplies.Journal of Plant Physiology,2005,162(4):439-447.
[29] Bowman W D,Roberts S W.Seasonal changes in tissue elasticity in chaparral shrubs.Plant Physiology,1985,65(3):233-236.
参考文献:
[2] 沈玉芳,王保莉,曲东,陈荣府.水分胁迫下磷营养对玉米苗期根系导水率的影响.西北农林科技大学学报:自然科学版,2002,30(5):11-13.
[3] 黄菊莹,张硕新,冯慧娟.4个树种木质部栓塞与N素营养关系的研究.西北林学院学报,2005,20(3):36-39.
[9] 韩刚,李彦瑾,孙德祥,赵忠.4种沙生灌木幼苗PV曲线水分参数对干旱胁迫的响应.西北植物学报,2008,28(7):1422-1428.
[10] 安锋,蔡靖,姜在民,张远迎,兰国玉,张硕新.八种木本植物木质部栓塞恢复特性及其与PV曲线水分参数的关系.西北农林科技大学学报:自然科学版,2006,34(1):38-43.
[12] 王万里.压力室(PRESSURE CHAMBER)在植物水分状况研究中的应用.植物生理学通讯,1984,(3):52-57.
[13] 杨茂仁.小叶锦鸡儿等三种灌木PV曲线水分参数和叶水势及其在造林中的意义.内蒙古林业科技,1992,(3):26-30.
[14] 董学军.九种沙生灌木水分关系参数的实验测定及生态意义.植物学报,1998,140(7):657-664.
[15] 孙志虎,王庆成.应用PV技术对北方4种阔叶树抗旱性的研究.林业科学,2003,39(2):33-38.
[16] 杨敏生,裴宝华,于冬梅.水分胁迫对毛白杨杂种无性系苗木维持膨压和渗透调节能力的影响.生态学报,1997,17(4):364-370.
[18] 李吉跃,翟洪波.木本植物水力结构与抗旱性.应用生态学报,2000,11(2):301-305.

