三种根系分泌脂肪酸对花生生长和土壤酶活性的影响
刘 苹,赵海军,仲子文,孙 明,庞亚群,马 征,万书波,*
(1.山东省农业科学院农业资源与环境研究所,济南 250100;2.农业部黄淮海平原农业环境重点实验室,济南 250100;3.山东省农业科学院,济南 250100;4.山东省农业面源污染防控重点实验,济南 250100;5.黑龙江省肇源县农业技术推广中心,肇源 166500)
在农业生产中,同一种作物在同一地块连续种植多年,通常会导致作物产量和品质下降,这种现象称为连作障碍[1]。Rice 1984年将化感作用定义为一种植物(包括微生物)通过向环境释放化学物质的方法,对其他植物的生长产生促进或抑制作用[2]。自毒作用是一种特殊的化感作用,即植物释放的化学物质对自身种子的萌发及植株生长产生抑制作用的现象[3]。近年来越来越多的研究表明,作物根系分泌物的自毒作用与作物的连作障碍有着密切的关系[4-6]。田间条件下,化感物质或自毒物质产生毒性作用的前提条件是要积累到一定的含量水平,且与目标植物直接接触[7]。化感物质或自毒物质在土壤中的存在形式和状态受土壤微生物和土壤条件的影响很大[8-10]。然而,大部分化感作用的生物评价试验是在人工生长介质如琼脂、石英砂、蛭石中进行的,必然导致试验结果与田间实际情况差距较大[11]。因此,如Inderjit的建议,有必要对分离鉴定出的化感物质进入到土壤后的作用进行研究[12]。
植物的化感作用是释放的所有化感物质综合作用的结果。Einhellig认为几乎所有植物的化感作用是至少两种或两种以上物质相互作用的结果[13]。而且,大田土壤中除了植物释放的化感物质外还包括多种物质(有毒或无毒),这些物质很可能会与化感物质发生相互作用。Blum的研究表明,随着添加到土壤中的酚酸类物质种类的增多,单种酚酸类物质对黄瓜生长产生抑制作用的含量降低,向土壤中添加其他有机物质(葡萄糖、蛋氨酸等)也降低了单种酚酸物质产生抑制作用的含量[14]。由于化感物质可能存在相互作用,因此有必要对其进入到土壤后的综合作用进行研究。
花生是一种重要的油料经济作物。花生连作后长势变差,产量和品质降低。山东省每年大约有连作田23.33万—26.67万hm2,由连作而造成的减产在15万t以上[15]。因此,揭示花生连作障碍的成因非常重要。早期研究表明,花生连作障碍与土壤的微生物区系、酶活性、物理和化学性质等的变化相关[6]。前期研究发现花生根系分泌物的自毒作用与花生连作障碍有着密切关系,鉴定出了包括脂肪酸类物质在内的6种主要成分[16],其中,豆蔻酸、软脂酸和硬脂酸的含量相对较高,并且发现连作花生土壤中脂肪酸类物质含量有累积的趋势。脂肪酸类化感物质是目前研究较多、活性较强的一类物质,很多植物的根系分泌物中均检测到脂肪酸及其衍生物,如:小麦、玉米、大豆、水稻、茄子的根系分泌物中均分离鉴定出该类物质。豆蔻酸是茄子根系分泌物中特征性的化感物质[17],豆蔻酸、软脂酸和硬脂酸等多种脂肪酸对藻类的生长均具有一定的抑制作用[18]。在本研究中,以田间土壤为介质,采用盆栽试验的方法重点研究了花生根系分泌物中3种长链脂肪酸,即:豆蔻酸、软脂酸和硬脂酸的混合物,对花生植株生长、产量和土壤酶活性的影响。旨在探讨花生连作后土壤中脂肪酸类物质的累积与花生连作障碍间的关系,为花生连作障碍机理的研究提供一定的理论依据。
1 材料与方法
1.1 试验设计
从田间收集未种植过花生的土壤,过2 mm筛混匀,土壤为棕壤,pH值约为6.6,有机质含量为1.32%,碱解氮、速效磷、速效钾的含量分别为71.5、9.73和234.88 mg/kg。将5 kg过筛土壤装于准备好的108个花盆中(25×30 cm)。根据豆蔻酸、软脂酸和硬脂酸在花生根系分泌物中的相对含量,将豆蔻酸、软脂酸和硬脂酸(上海国药集团公司出品,分析纯)按照质量比1.6∶16.6∶12均匀混合成3份,每份的质量分别为10.8、21.6 g和32.4 g,先用10 ml乙醇溶解再用蒸馏水稀释至27 L。用稀释后的溶液处理盆中的土壤,每盆浇灌1 L,使脂肪酸的初始含量达到80 mg/kg土、160 mg/kg土和240 mg/kg土,对照用蒸馏水处理,每个处理设27个平行。处理1d后每盆种下3棵大小一致的两叶期花生幼苗。试验在自然气候条件下进行,试验期间根据干旱程度适量补充等量水分。本试验分别在2010年和2011年的6—8月份进行,供试花生品种为花育16号,取两年试验的平均值进行计算分析。
1.2 花生农艺性状的测定
处理30d和60d之后,当花生处于苗期和花期时,每个处理随机取样9盆,分别对花生的生长和生理指标进行测定。测定指标有:苗高、茎叶鲜重、根系鲜重、总生物量、叶片叶绿素含量和根系活力,每盆中3株幼苗的平均值作为1个重复。用SPAD叶绿素仪(SPAD-502,日本)测定主茎第3片展开叶的叶绿素含量[19],注意确保SPAD仪的传感器完全覆盖住叶片。测定完根部鲜重之后,立即用TTC法测定根系活力[20]。处理3个月之后,当花生进入结荚期时测定每个处理余下的9个花盆中花生荚果的鲜重。
1.3 土壤酶活性的测定
当花生植株处于苗期和花期时,在测定花生生长和生理指标之前,先采集根系附近(离主根2—4cm)土壤样品,每盆随机取3钻(内径2.5cm),采样深度0—15 cm,充分混匀后装在密封塑料袋中。立即将采集的土样于室温下风干并过1 mm筛。采用水杨酸比色法测定蔗糖酶活性,苯酚钠比色法测定脲酶活性,二钠苯基磷酸盐比色法测定磷酸酶活性[21]。
1.4 数据分析
采用统计软件SPSS(13.0)进行处理间各指标的差异显著性检验,显著性水平为P<0.05,LSD法进行多重比较。
2 结果与分析
2.1 脂肪酸对花生植株生长的影响
当土壤中脂肪酸含量相对较低时(初始含量80 mg/kg土),对花生植株的生长有一定的促进作用(图1),但与对照的差别没有达到显著水平(P>0.05)。随着土壤中脂肪酸含量的增加,对花生植株的生长转变为抑制作用,并且含量越高抑制作用越强(图1)。当土壤中初始脂肪酸含量为160 mg/kg土时,苗期根系鲜重被显著抑制(P<0.05),花期时茎叶鲜重、根系鲜重和总生物量均显著低于对照(P<0.01)。当土壤中初始脂肪酸含量为240 mg/kg土时,苗期和花期时花生植株的株高、茎叶鲜重、根系鲜重、总生物量均显著低于对照处理(P<0.01),其中在花期时各指标比对照分别降低14.4%,22.0%,30.9%,和23.7%。
2.2 脂肪酸对花生植株生理指标的影响
当土壤中脂肪酸初始含量为80 mg/kg土时,花生叶片的叶绿素含量、根系活力比对照处理增加,其中叶绿素含量在苗期和花期与对照的差别均达到了极显著水平(P<0.001)(图2)。和对花生生长的抑制作用规律相似,当土壤中脂肪酸初始含量为160和240 mg/kg土时,在苗期和花期均显著抑制了叶片叶绿素含量和根系活力(P<0.001)(图2)。在最高添加量处理下,叶绿素含量、根系活力在苗期时比对照分别减少21.0%和31.4%,在花期时比对照分别减少22.7% 和33.3%。

图1 3种脂肪酸对花生植株生长的影响Fig.1 Effects of three fatty acids on peanut plants growth
2.3 脂肪酸对花生产量的影响
当土壤中脂肪酸含量相对较低时(初始含量80mg/kg土),对花生的产量有一定的促进作用(图3),但与对照的差别没有达到显著水平(P=0.14)。当土壤中脂肪酸初始含量为160和240 mg/kg土时,花生荚果的产量显著降低,比对照分别减少15.4%(P=0.021)和22.4%(P=0.005)。
2.4 脂肪酸对土壤酶活性的影响
当土壤中脂肪酸含量相对较低时(初始含量80mg/kg土),蔗糖酶、脲酶和磷酸酶的活性增强,但只有磷酸酶的活性在花期时与对照处理的差别达到了显著水平(P=0.016)(图4)。当土壤中脂肪酸含量较高时(初始含量160和240 mg/kg土),蔗糖酶、脲酶和磷酸酶的活性降低,其中,脲酶的活性在苗期时显著低于对照(P=0.032)。花期时,3种酶的活性均显著降低(P<0.001),在最高添加量处理下,蔗糖酶、脲酶和磷酸酶的活性在花期时比对照分别减少25.3%、25.4% 和26.1%。
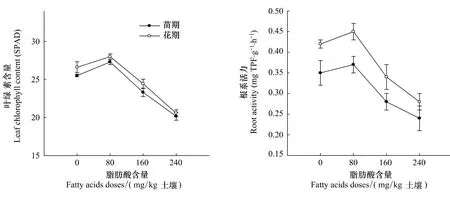
图2 3种脂肪酸对花生植株生理指标的影响Fig.2 Effects of three fatty acids on peanut plants physiological indices

图3 3种脂肪酸对花生产量的影响Fig.3 Effects of three fatty acids on peanut production
3 讨论
3.1 3种脂肪酸对花生植株生长的影响及作用机理
当土壤中豆蔻酸、软脂酸和硬脂酸的含量较低时,对花生植株的生长和产量有微弱的促进作用,可能是脂肪酸的添加量适宜,为土壤中的微生物提供了碳源,提高了根际土壤的有效养分含量,促进了花生植株的养分吸收,从而促进了生长[22]。当土壤中脂肪酸含量较高时,抑制了花生植株的生长和产量。以往研究表明,化感物质主要是通过影响细胞膜透性、酶活性、离子吸收、光合作用等途径对植物的生长产生影响[23-25]。本研究中发现,土壤中脂肪酸含量较高时显著抑制了花生植株叶片的叶绿素含量和根系活力,叶绿素在植物的光合作用中起着重要作用,叶绿素含量的降低意味着对光合作用强度的减弱,根系活力的降低又会影响到植株对养分的吸收能力[26-27]。光合产物和养分吸收的减少有可能是导致花生植株生长和产量降低的主要原因之一。
3.2 3种脂肪酸对土壤酶活性的影响及与花生生长的关系
化感物质对土壤酶活性的研究还较少[28-29]。土壤酶活性通常可以反映由于农业管理措施的改变引起的土壤性质的变化。蔗糖酶是土壤碳循环过程中的一种重要的酶,蔗糖酶活性提高,土壤中可溶性养分的含量将增加[30]。脲酶与土壤氮循环关系密切,参与将有机氮转变为无机氮的反应过程,为植物的生长提供可利用氮[31]。磷酸酶有助于将土壤中的有机磷转变为无机磷[32]。本研究发现,当土壤中脂肪酸含量较低时,对蔗糖酶、脲酶和磷酸酶的活性有一定的促进作用,酶活性的提高有利于根际土壤有效养分含量的增加,从而促进花生植株的生长发育。而当土壤中脂肪酸含量较高时显著抑制了这3种酶的活性,根际土壤有效养分含量减少,从而间接地抑制花生植株的生长发育。
土壤酶主要来源于土壤微生物和植物根系的分泌物。添加的脂肪酸能影响土壤酶的活性可能与以下原因有关:第一,当脂肪酸进入到土壤中后,会影响土壤微生物的种类和数量[33]。第二,影响到植物根系的生长和分泌,土壤中脂肪酸含量的不同可能导致根系分泌物主要成分的改变[4]。第三,土壤酶的活性与土壤pH值有关,而脂肪酸含量的高低会影响到土壤pH值[34]。最后,脂肪酸可能会直接影响土壤酶的活性,影响的大小取决于脂肪酸的种类和含量。
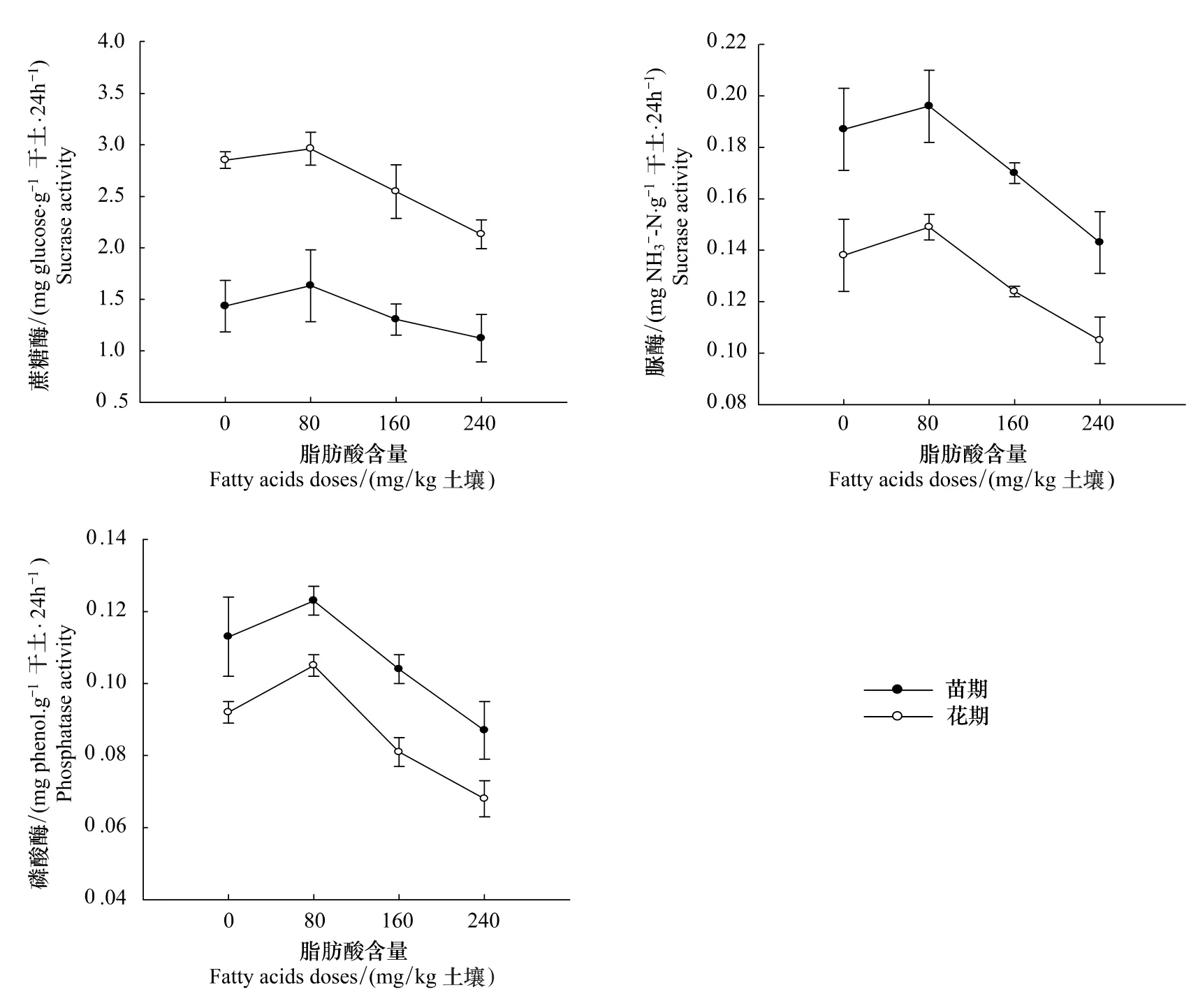
图4 3种脂肪酸对土壤酶活性的影响Fig.4 Effects of three fatty acids on soil enzymes activities
3.3 3种脂肪酸与花生连作障碍的关系
酚酸类物质是常见的植物化感物质,李培栋等的研究表明,南方红壤区花生的连作障碍与土壤中的对羟基苯甲酸、香豆酸和香草酸这3种酚酸类化感物质的累积有密切关系[35]。然而,近来许多研究表明脂肪类物质也是一类重要的化感物质。芋头根系分泌的脂肪酸类物质如己二酸在和芳香酸类物质的协同作用下可以抑制芋头植株的生长[4]。He等的研究表明脂肪酸类物质和酚酸类物质均与西洋参的自毒作用有密切关系[36]。本研究中证实了土壤中3种长链脂肪酸豆蔻酸、软脂酸和硬脂酸积累后会抑制花生植株的生长和产量,花生连作土壤中豆蔻酸、软脂酸和硬脂酸的累积与花生的连作障碍有着密切关系。通过生物或物理措施调控土壤中脂肪酸的含量将有助于缓解花生的连作障碍问题。花生连作土壤中脂肪酸的致毒临界含量、作用机理等问题有待于进一步研究。
致谢:本研究得到了中国科学院沈阳应用生态研究所韩兴国研究员的指导与帮助,特此致谢。
[1] Wu F Z,Zhao F Y.Study on root exudates and continues cropping obstacle.Journal of Northeast Agricultural University,2003,34(1):114-118.
[2] Rice E L.Allelopathy.2nd ed.New York:Academy Press Inc,1984:151-187.
[3] Putnam A R.Allelopathic research in agriculture:Past highlights and potential//Thompson A C,ed.The Chemistry of Allelopathy.Washington DC:American Chemical Society,1985.
[4] Asao T,Hasegawa K,Sueda Y,Tomita K,Taniguchi K,Hosoki T,Pramanik M H R,Matsui Y.Autotoxicity of root exudates from taro.Scientia Horticulturae,2003,97(3/4):389-396.
[5] Liu S H,Liu S Q,Zhang Z K,Wei H,Huang Z J,Zhang Y.Inhibition effect of garlic root exudates on the Genus Allium.Scientia Agricultura Sinica,2011,44(12):2625-2632.
[6] Wang X X,Zhang T L,Dai C C.Advance in mechanism and countermeasures of peanut succession monocropping obstacles.Soils,2010,42(4):505-512.
[7] Choesin D N,Boerner R E J.Allyl isothiocyanate release and the allelopathic potential of Brassica napus(Brassicaceae).American Journal of Botany,1991,78(8):1083-1090.
[8] Cheng H H.Characterization of the mechanisms of allelopathy:modeling and experimental approaches//Inderjit I,Dakshini K M M,Einhellig F A,eds.Allelopathy:Organisms,Processes and Applications.ACS Symposium Series 582.Washington DC:American Chemical Society,1985:132-141.
[9] Inderjit I,Kaur S,Dakshini K M M.Determination of allelopathic potential of a weed Pluchea lanceolata through a multi-faceted approach.Canadian Journal of Botany,1996,74(9):1445-1450.
[10] Inderjit I.Soils:environmental effect on allelochemical activity.Agronomy Journal,2001,93(1):79-84.
[11] Romeo J T.Raising the beam:moving beyond phytotoxicity.Journal of Chemical Ecology,2000,26(9):2011-2014.
[12] Inderjit I.Soil microorganisms:an important determinant of allelopathic activity.Plant and Soil,2005,274(1/2):227-236.
[13] Einhellig F A.Allelopathy:current status and future goal//Inderjit,Dakshini K M M,Einhellig F A,eds.Allelopathy:Organisms,Processes and Applications.ACS Symposium Series 582.Washington DC:American Chemical Society,1995:1-24.
[14] Blum U.Allelopathic interactions involving phenolic acids.Journal of Chemical Ecology,1996,28(3):259-267.
[15] Liu P,Wan S B,Jiang L H,Wang C B,Liu Z H,Zhao H J,Yu S F,Yang L.Autotoxic potential of root exudates of peanut(Arachis hypogaea L.).Allelopathy Journal,2010,26(2):197-206.
[16] Liu P,Jiang L H,Wan S B,Wei J L,Yu S F,Yang L,Wang M.Studies on allelopathy of peanut root exudates on root rot fungi and N-fixing Bacteria.Journal of Agricultural Science and Technology,2009,11(4):107-111.
[17] Zhou B L,Wu J X,Yin Y L,Han L,Sun C Q.Effects of tetradecanoic acid on growth and activities of leaf defense enzymes of eggplant seedlings.Acta Agriculturae Boreali-occidentalis Sinica,2011,20(4):120-123.
[18] Gao Y N,Liu B Y,Ge F J,Liang W,Xu D,Zhang L P,Wu Z B.Isolation and identification of allelopathic fatty acids exuded from three submerged hydrocharitaceae species.Acta Hydrobiologica Sinica,2011,35(1):170-174.
[19] Songsri P,Jogloy S,Holbrook C C,Kesmala T,Vorasoot N,Akkasaeng C,Patanothai A.Association of root,specific leaf area and SPAD chlorophyll meter reading to water use efficiency of peanut under different available soil water.Agricultural Water Management,2009,96(5):790-798.
[20] Li H S,Sun Q,Zhao S J.Principles and Techniques of Plant Physiological Biochemical Experiment.Beijing:Higher Education Press,2003:119-120.
[21] Guan S Y.Soil Enzymes and Their Research Methodology.Beijing:Agriculture Press,1986:274-312.
[22] Qu X H,Wang J G.Effect of amendments with different phenolic acids on soil microbial biomass,activity and community diversity.Applied Soil Ecology,2008,39(2):172-179.
[23] Baziramakenga R,Leroux G D,Simard R R.Effects of benzoic and cinnamic acids on membrane permeability of soybean roots.Journal of Chemical Ecology,1995,21(9):1271-1285.
[24] Qin Y M,Nie L W,Huang Y Q,Wang G,Liu X,Zhou K.Detection of Paeonia ostii autotoxins and their mechanism.Acta Ecologica Sinica,2009,29(3):1153-1161.
[25] Zeng R S,Luo S M,Shi Y H,Shi Y H,Shi M B,Tu C Y.Physiological and biochemical mechanism of allelopathy of secalonic acid F on higher plants.Agronomy Journal,2001,93(1):72-79.
[26] Shibata M,Mikota T,Yoshimura A,Iwata N,Tsuyama M,Kobayashi Y.Chlorophyll formation and photosynthetic activity in rice mutants with alterations in hydrogenation of the chlorophyll alcohol side chain.Plant Science,2004,166(3):593-600.
[27] Yang C M,Yang L Z,Yang Y X,Ouyang Z.Rice root growth and nutrient uptake as influenced by organic manure in continuously and alternately flooded paddy soils.Agricultural Water Management,2004,70(1):67-81.
[28] Gopal M,Gupta A,Arunachalam V,Magu S P.Impact of azadirachtin,an insecticidal allelochemical from neem on soil microflora,enzyme and respiratory activities.Bioresource Technology,2007,98(16):3154-3158.
[29] Gu Y,Wang P,Kong C H.Urease,invertase,dehydrogenase and polyphenoloxidase activities in paddy soil influenced by allelopathic rice variety.European Journal of Soil Biology,2009,45(5/6):436-441.
[30] Zhang F P,Li C F,Tong L G,Yue L X,Li P,Ciren Y J,Cao C G.Response of microbial characteristics to heavy metal pollution of mining soils in central Tibet,China.Applied Soil Ecology,2010,45(3):144-151.
[31] Bandick A K,Dick R P.Field management effects on soil enzyme activities.Soil Biology and Biochemistry,1999,31(11):1471-1479.
[32] Amador J A,Glucksman A M,Lyons J B,Görres J H.Spatial distribution of soil phosphatase activity within a riparian forest.Soil Science,1997,162(11):808-825.
[33] Kong C H,Wang P,Zhao H,Xu X H,Zhu Y D.Impact of allelochemical exuded from allelopathic rice on soil microbial community.Soil Biology and Biochemistry,2008,40(7):1862-1869.
[34] Yao H Y,Bowman D,Rufty T,Shi W.Interactions between N fertilization,grass clipping addition and pH in turf ecosystems:Implications for soil enzyme activities and organic matter decomposition.Soil Biology and Biochemistry,2009,41(7):1425-1432.
[35] Li P D,Wang X X,Li Y L,Wang H W,Liang F Y,Dai C C.The contents of phenolic acids in continuous cropping peanut and their allelopathy.Acta Ecologica Sinica,2010,30(8):2128-2134.
[36] He C N,Gao W W,Yang J X,Bi W,Zhang X S,Zhao Y J.Identification of autotoxic compounds from fibrous roots of Panax quinquefolium L.Plant and Soil,2009,318(1/2):63-72.
参考文献:
[1] 吴凤芝,赵凤艳.根系分泌物与连作障碍.东北农业大学学报,2003,34(1):114-118.
[5] 刘素慧,刘世琦,张自坤,尉辉,黄治军,张宇.大蒜根系分泌物对同属作物的抑制作用.中国农业科学,2011,44(12):2625-2632.
[6] 王兴祥,张桃林,戴传超.连作花生土壤障碍原因及消除技术研究进展.土壤,2010,42(4):505-512.
[16] 刘苹,江丽华,万书波,魏建林,于淑芳,杨力,王梅.花生根系分泌物对根腐镰刀菌和固氮菌的化感作用研究.中国农业科技导报,2009,11(4):107-111.
[17] 周宝利,武建霞,尹玉玲,韩琳,孙传奇.豆蔻酸对茄子幼苗生长和叶片防御酶活性的影响.西北农业学报,2011,20(4):120-123.
[18] 高云霓,刘碧云,葛芳杰,梁威,徐栋,张丽萍,吴振斌.三种水鳖科沉水植物释放的脂肪酸类化感物质的分离与鉴定.水生生物学报,2011,35(1):170-174.
[20] 李合生,孙群,赵世杰.植物生理生化实验原理和技术.北京:高等教育出版社,2003:119-120.
[21] 关松荫.土壤酶及其研究法.北京:农业出版社,1986:274-312.
[24] 覃逸明,聂刘旺,黄雨清,王千,刘欣,周科.凤丹(Paeonia ostii T.)自毒物质的检测及其作用机制.生态学报,2009,29(3):1153-1161.
[35] 李培栋,王兴祥,李奕林,王宏伟,梁飞燕,戴传超.连作花生土壤中酚酸类物质的检测及其对花生的化感作用.生态学报,2010,30(8):2128-2134.

