转ZjAPX基因拟南芥对NaCl、干旱胁迫的耐性研究
郭慧娜 孟玉平 郝子琪 李倩 曹秋芬,3
(1.山西大学生物工程学院,太原 030031;2.山西省农业科学院生物技术研究中心,太原 030031;3.农业部黄土高原作物基因资源与种质创制重点实验室,太原 030031)
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)是植物体内酶促抗氧化系统中ASA-GSH氧化还原途径的重要组分,是清除H2O2的关键酶,对H2O2有较高的亲和力,在还原底物抗坏血酸的存在下将H2O2还原为H2O。大量的研究表明,APX 的表达受各种环境胁迫因子,如干旱、高盐、除草剂、低温、病原菌侵染的诱导。马长乐等[1]研究表明,当碱蓬受到NaCl胁迫时,其SsAPX的表达量增高。在烟草叶绿体中,过量表达拟南芥APX基因能够清除活性氧,提高转基因株系耐盐能力[2]。木本植物中白桦抗坏血酸过氧化物酶(APX)基因已经被克隆,研究表明NaCl胁迫诱导了白桦叶片中APX的表达[3];木本果树中葡萄的APX[4]和苹果的APX基因也已被克隆[5],李颖等[6]利用农杆菌介导已经将苹果的APX基因转入“嘎啦”组培苗。
枣树抗旱、耐盐碱、耐瘠薄,这些特性与其体内的抗氧化系统有密切关系,我们从枣树结果枝cDNA文库中筛选出一个抗坏血酸过氧化物酶基因,命名为ZjAPX,在DDBJ/EMBL/GenBank的注册号为AB608053,并对ZjAPX进行了原核表达蛋白的研究[7]和cDNA序列生物信息学分析及完整开放阅读框植物表达载体PEZR(K)-LNY-ZjAPX的构建[8]。本研究通过冻融法将已构建的植物表达载体转入农杆菌菌株LBA4404,并借助农杆菌遗传转化获得转ZjAPX拟南芥,通过对转基因拟南芥进行NaCl、干旱胁迫,观察植株的表型变化、检测其体内ZjAPX的表达,探讨ZjAPX在改善植物抗旱耐盐性方面的生物学作用,旨在为利用生物工程手段提高植物抗旱、耐盐性提供基因资源。
1 材料与方法
1.1 材料
试验所用重组植物表达载体PEZR(K)-LNY由山西省农业科学院生物技术研究中心植物细胞及胚胎学研究室保存,前期研究中已经将ZjAPX成功连接到PEZR(K)-LNY载体上,构建了PEZR(K)-LNY-ZjAPX[8],该载体携带筛选标记基因NPT-Ⅱ和黄色荧光蛋白报告基因YFP。野生型拟南芥株系(Arabidopsis thaliana Columbia)和根癌农杆菌(Agrobacterium tumefaciens)LBA4404菌株由该研究室保存。
卡那霉素(Kanamycin,Kan)购自上海生工生物工程服务有限公司;NaCl、YEB、1/2MS培养基中所用试剂均购自天津天大化工;拟南芥的培养基质购自山西省农业科学院园艺作物研究所;饱和酚、DEPC、RNA和DNA提取过程中所用到的试剂均购自上海生工生物工程有限公司。DL2000 Marker购自北京全式金生物技术有限公司;反转录试剂盒(PrimeScript®RT Master Mix),荧光定量PCR试剂盒(PrimeScriptTMRT reagent Kit),DNaseⅠ,荧光定量过程中所用的PCR管均购自大连TaKaRa(宝生物)工程有限公司。用于PCR鉴定和荧光定量的引物由上海生工生物技术服务有限公司合成;荧光定量PCR仪为Applied Biosystems 的7300 Real Time PCR System。
1.2 方法
1.2.1 拟南芥的培养 将拟南芥种子消毒后,播于1/2MS固体培养基上,封口。春化2 d后,将其置于21℃,16 h/8 h光周期条件下进行培养。当拟南芥长出两片真叶时,移栽到营养基质中继续培养。
1.2.2 农杆菌工程菌PEZR(K)-LNY-ZjAPX-L的构建及转化拟南芥 通过冻融法将构建成功的重组质粒PEZR(K)-LNY-ZjAPX转入农杆菌LBA4404,挑取阳性菌落进行PCR鉴定转化子,将阳性菌株送华大基因公司测序。
1.2.3 转基因植株的筛选 将T0代种子消毒后,播于含有卡那霉素的1/2MS抗性平板上筛选,筛选出的抗性植株分株系收获种子,记为T1代。同样,将T1代种子抗性筛选,收获T2种子。将T2代种子消毒后播于含有卡那霉素的1/2MS固体培养基上,在平板上生长全为绿苗的为纯合的转基因植株。
1.2.4 转基因植株的分子鉴定 采用CTAB法提取T2代转基因拟南芥的基因组DNA,通过蛋白核酸检测仪检测其浓度和纯度;以提取的基因组DNA为模板进行PCR检测,PCR反应体系总体积为20 μL,其 中:10×PCR Buffer 2 μL,dNTPs 0.2 μL,Taq聚合酶0.1 μL,上下游引物各1 μL(20 pmol/μL),用灭菌无离子水补足20 μL。
APX1正向引物:5'-TGAATTCAGATGGGGAAGTGCTAC-3';APX2反向引物:5'-ATCCCGGGTAGCATCAGCAAATC-3'。
PCR反应条件为:95℃预变性5 min;94℃变性1 min,54℃退火1 min,72℃延伸2 min,共30个循环;最后72℃延伸5 min。
1.2.5 转基因植株T2代种子的NaCl胁迫处理 种子胁迫培养基为:1/2MS培养基中分别加不同浓度的NaCl,即100、200、300和500 mmol/L,以不加NaCl的1/2MS培养基为对照。
将PCR鉴定为转基因株系的拟南芥T2代的种子消毒后,每一个株系在每一个浓度的培养基上均播种约20颗种子,同时每个培养皿中播野生型拟南芥种子作对照,观察种子萌发及植株生长状况。
1.2.6 转基因T2代植株的NaCl和干旱处理 将正常生长3周左右的转基因拟南芥植株分别进行干旱(不浇水)和浇400 mmol/L NaCl处理,以正常浇水为对照,10 d后调查植株生长情况,并分别取样冷冻于液氮后保存在-80℃超低温冰箱中,备用。
1.2.7 NaCl和干旱胁迫下转基因拟南芥中ZjAPX基因的表达 用CTAB法[9]提取上述处理样品的RNA,用DNaseⅠ除去DNA。用蛋白核酸分光光度计检测其A260/280在1.8-2.0之间,凝胶电泳发现28S和18S的rRNA条带完整,28S条带的亮度为18S亮度的2倍,表明总RNA有较好的完整性和纯度,能满足反转录的要求。反转录成cDNA。反转录体系:5×Prime Script Buffer 4 μL、Total RNA 1 μg、总体积15 μL。反应条件:37℃ 15 min,85℃ 5 s。用Realtime PCR的方法分析基因的转录表达情况。本研究采用Real-time PCR相对定量法,分析转基因植株不同胁迫条件下ZjAPX mRNA的相对表达量。ZjAPX的上游引物为:5'-TCGATATCGCTGTCAGACTAC-3';下游引物:5'-TTGTCCTCTCTTCCTGGATG-3';可扩增出145 bp的片段。以拟南芥Actin(At3g18780)基因作内参,其上游引物:5'-ACCTCATGAAGATCCTTACAG-3';下游引物:5'-GATGGAAGAGCTGGTCTTTG-3';可扩增出146 bp的片段定量PCR反应体系总体积为20 μL,含上、下游引物各0.4 μL(20 pmol/μL),cDNA 1 μL(100 ng),SYBR Premix EX TaqTMⅡ10 μL,ROX Reference Dye 0.4 μL,ddH2O 7.8 μL。反应条件为:95℃预变性30 s,95℃变性5 s,60℃延伸31 s,40个循环。基因相对定量表达分析采用2-ΔΔCt法,ΔΔCt = 转基因[Ct(ZjAPX)-Ct(Actin)]-野 生 型[Ct(ZjAPX)-Ct(Actin)],每个样品重复3次。
对于天文摄影师来说,自然少不了大大小小的器材,这些都能整齐地收纳到一个体积小巧的背包中。Alyn目前使用的是索尼A7 III微单相机,作为静态照片拍摄的主力,但镜头的选择更为重要。他需要广角镜头,也需要光圈尽可能大,这样就可以在不使用过高ISO的前提下,让更多的光线进入相机。
2 结果
2.1 农杆菌工程菌株的构建
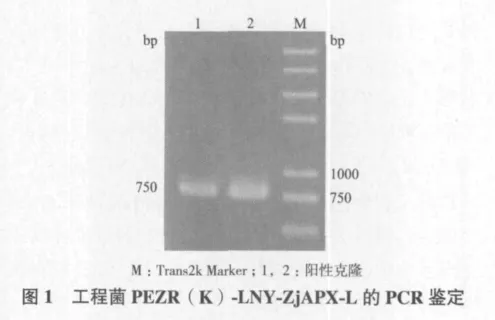
将构建好的植物表达载体PEZR(K)-LNY-ZjAPX转入农杆菌LBA4404,涂布于含有卡那霉素的YEB固体培养基上,28℃过夜培养,挑选生长良好的单菌落,进行PCR检测,产生一条大小约为750 bp的特异条带(图1),两个菌株测序表明,重组载体上的序列与原克隆序列完全相同,证明含PEZR(K)-LNY-ZjAPX的农杆菌工程菌构建成功。
2.2 转基因植株的筛选
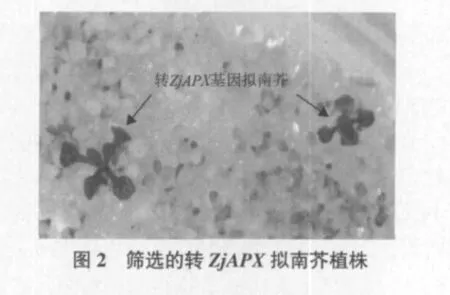
将T0代种子播在含有卡那霉素的1/2MS培养基上筛选,未转化的拟南芥种子长出两片子叶后黄化死亡,只有转基因拟南芥种子能够继续正常生长,如图2所示。经过抗性筛选共获得24个转基因株系,24个株系整体生长状况良好,没有发现异常形态及性状。
2.3 转基因植株的PCR检测
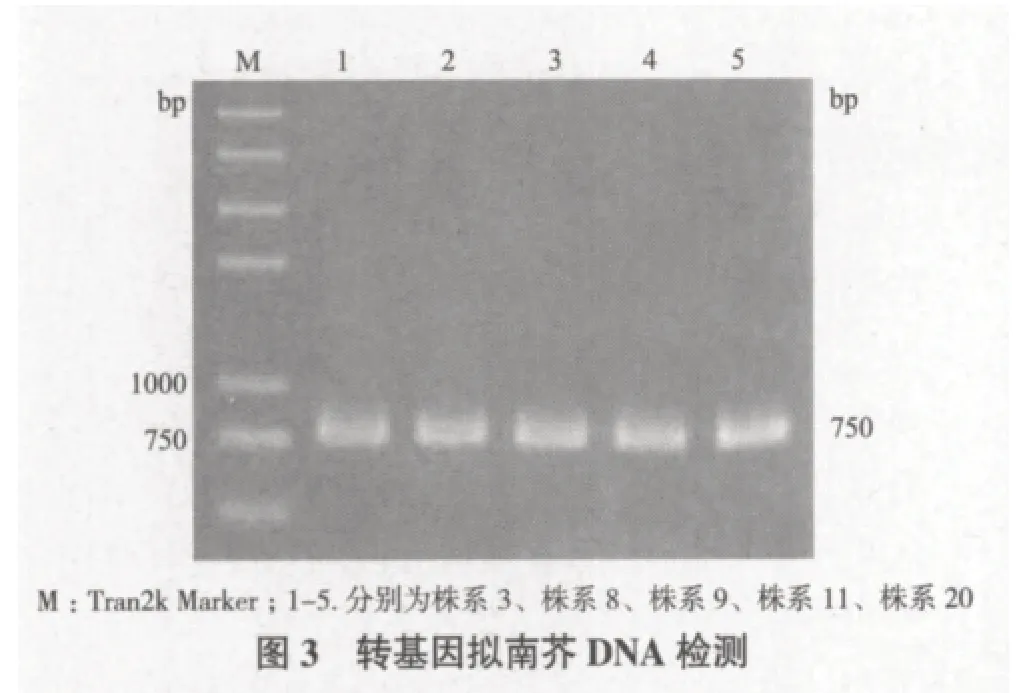
将筛选获得的24个T0转基因株系继续分别用含有卡那霉素的1/2MS培养基筛选至获得T2代种子,播种其中的5个株系3、8、9、11、20进行PCR鉴定证明,5个株系均扩增出了750 bp的条带(图3),表明5个株系均为转ZjAPX基因植株。
2.4 转基因株系种子对NaCl的耐性
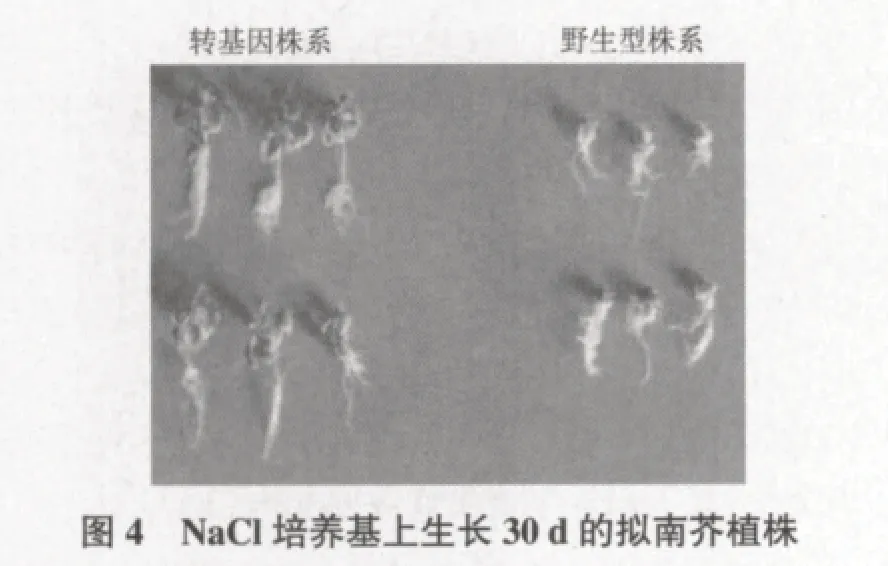
播种后第7天,300 mmol/L和500 mmol/L NaCl培养基上种子没有发芽长出子叶,而0 mmol/L NaCl和100 mmol/L NaCl的培养基上子叶展开,10 d长出两片真叶,但含100 mmol/L NaCl培养基上的幼苗叶子卷曲;15 d转基因拟南芥的幼苗的长势明显好于野生拟南芥;30 d野生型植株幼苗根系短小、叶片发黄接近死亡,而转基因株系幼苗的根系和叶片明显优于野生型植株,如图4所示。
2.5 转基因株系的耐NaCl、耐旱性
对转基因植株进行NaCl和干旱胁迫处理15 d后观察,与正常浇水的对照相比NaCl处理的植株均表现叶片变黄,但转基因株系比野生型植株更健壮、叶片大、叶色稍绿。干旱处理的转基因株系均正常生长,株系3和株系11叶片表现为深绿色,株系8叶色正常并已经抽苔,株系9长势稍差,而此时野生型植株已干枯死亡。
2.6 NaCl和干旱胁迫下转基因植株中ZjAPX基因的表达
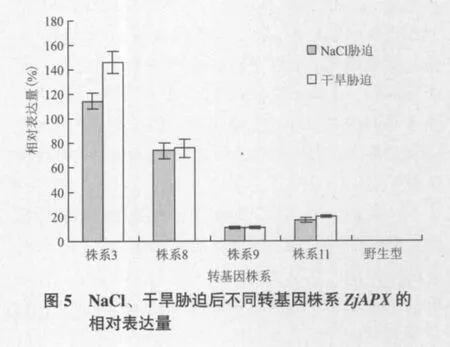
荧光定量PCR分析结果表明,NaCl和干旱胁迫10 d的转基因株系的ZjAPX表达量均显著高于野生型株系,如图5所示。其中以株系3表达量最高,相对表达量分别为114%和146%,其次株系8分别为73%和76%,株系11分别为17%和20%,株系9均为11%;NaCl胁迫条件下野生型植株ZjAPX表达量很低为0.1%几乎为0,而干旱胁迫10 d采样时野生型植株已经死亡。这一结果与上述2.5中的外部形态观察结果基本一致,株系3在胁迫条件下生长最好,ZjAPX的相对表达量也最高;株系9在胁迫条件下生长最弱,ZjAPX的相对表达量也最低;证明转ZjAPX植株的耐NaCl和耐干旱性与ZjAPX的高表达呈正相关,ZjAPX的高表达提高了植株耐NaCl和耐干旱的能力。
3 讨论
植物在受到盐、干旱等逆境胁迫时会产生大量的活性氧(ROS),ROS的种类包括过氧化氢(H2O2)、羟自由基(OH-)、超氧阴离子(O2-)。当ROS代谢平衡遭到破坏、产生的量超出植物体本身的清除能力时,过剩的H2O2会生成破坏力更强的HO-,从而导致膜脂的过氧化,破坏生物膜的结构与功能,蛋白质和DNA等生物大分子受到伤害,细胞物质交换平衡遭到破坏,生理生化代谢出现紊乱,使植物生长受到抑制[10]。因此,能否及时清除过量积累的活性氧,缓解胁迫对植物细胞造成的伤害,在一定程度上反映了植物耐盐、耐旱等抗逆性的强弱。研究表明,在高等植物中,抗坏血酸(Ascorbic acid,ASA)-谷胱甘肽(Glutathione,GSH)循环是植物叶绿体和胞质中清除H2O2的主要系统,而APX是这个系统的关键酶[11],因此APX的表达量高低直接影响植物在逆境中的生存能力。
对APX的研究发现,在干旱、臭氧、乙烯、除草剂、冷热等逆境条件,以及病原体侵染以及果实成熟过程中,均能引起APX的mRNA 水平及其活性的增加[12]。本研究证明在NaCl胁迫条件下,转ZjAPX拟南芥的种子萌发和萌发后幼苗的生长、根系明显优于野生型植株,说明转ZjAPX改善了拟南芥种子及幼苗对NaCl的耐性。在NaCl和干旱胁迫条件下,转ZjAPX拟南芥植株的生长势均明显优于野生型植株,荧光定量PCR分析也证明ZjAPX基因在mRNA水平的表达量明显高于野生型植株;同时研究还表明转基因株系之间抗胁迫能力存在差异,株系3、8、11生长势优于株系9,ZjAPX基因表达量也表现出明显的不同,依次为株系3、8、11、9。这一结果说明ZjAPX基因在植物体内高表达量清除了活性氧,提高了植株对NaCl和干旱胁迫的抗性;由于不同株系中导入的基因拷贝数、基因整合的位置存在差异,因而株系之间对NaCl和干旱的耐性也表现不同。
Gueta-Dahan等[13]对耐盐和盐敏感的柑橘中抗氧化酶的活性发现,超氧化物歧化酶、谷胱甘肽还原酶等的活性在两者之间差别不大,而耐盐柑橘中的APX活性大大高于盐敏感柑橘;Tsugane等[14]也发现与野生型拟南芥相比,在盐胁迫条件下能进行光合自养的拟南芥隐性突变体中APX的活性显著增强,而其他几种抗氧化物酶的活性差别不大,因此认为APX是决定耐盐与否的关键酶。本研究结果也证明了这一点。
增强植物抗逆性的重要途径之一是提高植物体内活性氧清除酶类的活性及抗氧化代谢水平。利用基因工程手段将一些具有抗逆功能的转录因子导入植株中,是目前普遍使用的提高植物抗逆性的策略。
4 结论
本研究利用农杆菌介导法将ZjAPX基因转入到模式植物拟南芥,转ZjAPX拟南芥T2株系的种子萌发和植株生长均较野生型株系耐盐、耐旱,荧光定量PCR检测转基因植株在干旱和盐胁迫处理10 d后目的基因ZjAPX的表达量显著高于野生拟南芥,证明转ZjAPX能够提高植物的耐盐和耐旱性。
[1] 马长乐, 王萍萍, 曹子谊, 等.盐地碱蓬(Suaede sdlsa)APX基因的克隆及盐胁迫下的表达[J].植物生理与分子生物学学报, 2002, 28(4):261-266.
[2] Badawi GH, Kawano N, Yamauchi Y, et al. Overexpression of arscorbate peroxidase in tobacco chloroplasts enhances the tolerance to salt stress and water deficit[J]. Physiol Plant, 2004, 121(2):231-238.
[3] 王超, 杨传平, 王玉成.白桦抗坏血酸过氧化物酶(APX)基因克隆及表达分析[J].东北林业大学学报, 2009, 37(3):70-81.
[4] 林玲.中国华东葡萄抗坏血酸过氧化物酶基因的原核表达抗体制备[D].杨凌:西北农林科技大学, 2006.
[5] 栗霞.苹果抗坏血酸过氧化物酶基因的克隆及其植物表达载体的构建[D].杨凌:西北农林科技大学, 2007.
[6] 李颖, 马锋旺.抗坏血酸过氧化物酶基因转化苹果的研究[J].西北农业学报, 2010, 19(1):140-163.
[7] 张晓娟, 郝子琪, 杨大威, 等.枣树ZjAPX基因的原核表达[J].山西农业科学, 2012, 40(3):189-192.
[8] 郝子琪, 许洪仙, 孟玉平, 等.枣树抗坏血酸过氧化物酶基因ZjAPX生物信息学分析及植物表达载体的构建[J].山西农业科学, 2011, 39(5):400-403.
[9] 曹秋芬, 孟玉平, 孙毅.苹果属植物总RNA有效、快速提取方法简介[J].农业生物技术学报, 2003, 11(4):428-429.
[10] 王聪, 朱月林, 杨立飞, 陈磊. NaCl胁迫对菜用大豆抗坏血酸-谷胱甘肽循环的影响[J].植物营养与肥料学报, 2010, 16(5):1209-1216.
[11] 李惠华, 赖钟雄. 植物抗坏血酸过氧化物酶研究进展[J].亚热带植物科学, 2006, 35(2):66-69.
[12] Schöner S, Krause GH. Protective systems against active oxygen species in spinach:response to cold acclimation in excess light[J]. Planta, 1990, 180:383-389.
[13] Gueta-Dahan Y, Yaniv Z, Zilinskas BA, Ben-Hayyim G. Salt and oxidative stress:similar and specific responses and t heir relation to salt tolerance in citrus[J]. Planta, 1997, 203:460-469.
[14] Tsugane K, Kobayashi K, Niwam Y, et al. A recessive Arabidopsis mutant that grows photoautotrophically under salt stress shows enhanced active oxygen detoxification[J]. Plant Cell, 1999, 11(7):1195-1206.

