血管紧张素Ⅱ通过上调白细胞介素-8受体表达增加单核细胞黏附*
谢启应,钟巧青,谢秀梅,杨天伦,陈美芳
血管紧张素Ⅱ通过上调白细胞介素-8受体表达增加单核细胞黏附*
谢启应,钟巧青△,谢秀梅,杨天伦,陈美芳
目的:探讨血管紧张素II (Ang II)对单核细胞黏附的影响及机制研究。
方法: Ang II (10-6M) 培养人单核细胞株4 h或24 h,并加入氯沙坦 (1, 3, 10 μM)或抗氧化剂吡咯烷二硫代氨基甲酸盐(PDTC,10 μM),检测单核细胞内活性氧 (ROS)水平、单核内皮细胞黏附、上清液中白细胞介素-8 (IL-8)、肿瘤坏死因子α (TNF-α)水平、单核细胞的白细胞介素-8受体(CXCR2 )mRNA表达以及核转录因子κB (NF-κB)和活化蛋白(AP-1) 的活性。
结果: Ang II (10-6M)孵育单核细胞后显著增加细胞内ROS水平、上清液中白细胞介素-8和肿瘤坏死因子α水平,单核细胞内核转录因子κB和AP-1的活性以及上调CXCR2 mRNA表达,促进单核细胞黏附到内皮细胞。预先给予氯沙坦呈浓度依赖性的抑制Ang II诱导的上述反应,抗氧化剂PDTC同样抑制Ang II诱导的氧化应激和单核细胞黏附。
结论:Ang II通过上调CXCR2表达,增加单核细胞黏附,活化单核细胞促进动脉粥样硬化的发生,这一过程涉及ROS-NF-κB/AP-1通路。
血管紧张素II;单核细胞;白细胞介素-8;趋化因子受体
(Chinese Circulation Journal, 2014, 29: 367.)
单核细胞黏附到受损的内皮细胞继而进入血管内膜下组织是动脉粥样硬化早期发病的关键环节。研究显示白细胞介素-8(IL-8)属于趋化因子(chemokine)CXC家族,其对单核细胞稳定地黏附到内皮细胞起到重要作用。有研究报道不稳定性心绞痛患者的白细胞介素-8水平明显升高[1];敲除白细胞介素-8的受体(CXCR2)后,斑块病变和单核巨噬细胞的聚集均明显减轻[2]。血管紧张素II(Ang II)是一种重要的致炎因子,它可诱导单核细胞增殖、游走,并促使单核细胞向巨噬细胞转化。早期研究报道Ang II可上调CXC趋化因子表达,而使用CXCR2拮抗剂SB-517785-M几乎可完全逆转这一效应[3]。然而有关Ang II对单核细胞趋化因子的影响的相关研究报道少见,本实验拟观察Ang II对单核细胞黏附的影响及可能的分子机制。
1 材料与方法
材料:人单核细胞株(THP-1,ATCC)购自湘雅医学院细胞培养中心。人脐静脉血内皮细胞株(HUVEC-12,ATCC,CRL-2480)购自北京协和医学院肿瘤研究所。Ang II、胰酶、抗氧化剂吡咯烷二硫代氨基甲酸盐(PDTC)购自Sigma公司(圣路易斯,美国);氯沙坦由美国默沙东公司馈赠;RPMI 1640培养基、DMEM系Gibco产品(加利福尼亚,美国);小牛血清购自杭州四季青;肿瘤坏死因子α(TNF-α)、白细胞介素8试剂盒购自上海森雄生物有限公司;RT试剂盒购自Fermentas(安大略省柏林顿,加拿大);引物由上海生工技术有限公司合成。[γ-32P] ATP由北京福瑞生物工程公司提供;活性氧检测试剂盒、BCA蛋白浓度测定试剂盒购自江苏碧云天生物技术研究所,总RNA抽提试剂TRIzol、核转录因子κB (NF-κB)和活化蛋白(AP-1)探针,凝胶迁移系统购自Promega公司(麦迪逊,美国)。
人单核细胞的培养和处理:取THP-1细胞株,解冻复苏后加入含15%小牛血清的RPMI 1640培养基制成细胞悬液,接种于培养瓶中置于5%CO2培养箱中培养(37℃)。1%血清处理24 h后将细胞密度调整为1×106个/ml接种于6孔培养板中,进行不同处理。空白对照组:用含1%小牛血清的培养液继续孵育4 h或24 h;Ang II组:用含10-6M的Ang II的培养液孵育细胞4 h或24 h;氯沙坦(1, 3, 10 μM)组:1, 3, 10 μM的氯沙坦孵育1 h后加入10-6M的Ang II继续培养4 h或24 h;PDTC组:加入终浓度为10 μM的PDTC孵育1.5 h后加入10-6M的Ang II继续培养4 h或24 h。
细胞内活性氧水平检测[4]:将THP-1细胞接种于24孔板(104个/m l),孵育24~48 h待细胞融合经1%血清处理后加入不同干预因素,然后进行实验。在相应的时间点,弃去培养液,室温下D-Hank’s液漂洗3次,加入10 μM H2DCF-DA荧光探针,37℃避光孵育20 min,D-Hank’s漂洗3次后加入1 m l 无血清的培养液,30 min后用荧光分光光度计测定荧光强度,激发波长为488 nm,发射波长为535 nm。
细胞黏附实验 将THP-1细胞进行处理后加入6孔板未处理的人脐静脉内皮细胞(HUVEC)中(每孔1 ml),37℃振荡孵育30 min,用Hanks平衡液小心冲洗掉未粘附的单核细胞。用3%的多聚甲醛每孔200 μl固定,然后在倒置高倍显微镜下每孔随机选择6个视野(hpf)计数黏附的单核细胞数目。
白细胞介素-8、肿瘤坏死因子α含量的测定:严格按照试剂盒的要求[5],采用酶联免疫吸附法(ELISA)测定白细胞介素-8、肿瘤坏死因子α,在含有抗体包被的96孔板,分别加入标准品和样品各100 μl,37℃孵育 2 h,洗板 5 次,每孔加入 100 μl酶标二抗,37℃温育1 h,洗板5次,加入底物100 μl,37℃闭光孵育15 min,每孔加入终止液1滴,用酶标仪在490 nm处测定吸光值,计算出白细胞介素-8的浓度。或用酶标仪在450 nm处测定吸光值,计算出肿瘤坏死因子α的浓度。
CXCR2 mRNA表达:采用Trizol法提取总RNA,取2 μg总RNA进行逆转录后取2 μl行多聚酶链反应(PCR)反应。CXCR2上游引物:5’-CGGAATTCAA ATGGAAGATTTTAACATGGAG-3’。下游引物:5’-CC GCTCGAGTTAGAGAGTAGTGGAAGTGTG-3’,扩增片段长度为417 bp。PCR反应体系20 μl,反应条件为94°C变性60 s,58°C退火60 s,72°C延伸60 s,38个循环。β-肌动蛋白(β-actin)上游引物:5’-CTGTCCCTGTATGCCTCTG-3’,下游引物:5’-ATGTCACGCACGATTTCC-3’,扩增片段长度为218 bp。PCR反应体系20 μl,反应条件为94℃变性45 s,58℃退火45 s,72℃延伸60 s,28个循环。得到的多聚酶链反应产物2%的琼脂糖电泳并用成像系统扫描摄片。
电泳迁移率改变检测法(EMSA)分析核转录因子κB、AP-1活性 严格按照Promega公司提供的试剂盒说明书进行操作[6]。提取核蛋白用BCA法[7]检测提取液中核蛋白浓度。核转录因子κB同序寡核苷酸探针序列为3’-TCA ACT CCC CTG AAA GGG TCC G-5’;5’-AGT TGA GGG GAC TTT CCC AGG C-3’。AP-1探针序列为5'-CGC TTG ATG AGT CAG CCG GAA-3',3'- AAC TAC TCA GTC GGC CTT TGC-5'。采用T4寡核苷酸激酶法以[γ-32P] ATP (10 μCi/μl)进行末端同位素标记,游离探针用G-25层析法除去。蛋白 -DNA 结合反应在总容量 10 μl含有 8~10 μg核抽提物,4% glycerol,1 mM MgCl2,0.5 mM依地酸,0.5 mM DTT,50 mM NaCl,10 mM Tris-HCl pH 7.5 和 1 μg poly(di-dc)的液体中于室温下反应10 min。然后加入50 000~200 000 cpm标记探针入反应液中室温下继续孵育20 m in。在4%非变性聚丙烯酰胺电泳30 m in左右(电压350 V,电泳缓冲液为0.5×TBE) 后干胶,置-70 ℃放射自显影24 h。
统计学分析 用one-way ANOVA进行统计学处理,所有数据均以均数±标准差表示,双侧P<0.05认为差异有统计学意义。
2 结果
2.1 血管紧张素II对单核细胞黏附的影响(表1)
表1 血管紧张素II对单核细胞黏附的影响(n =4,±s)
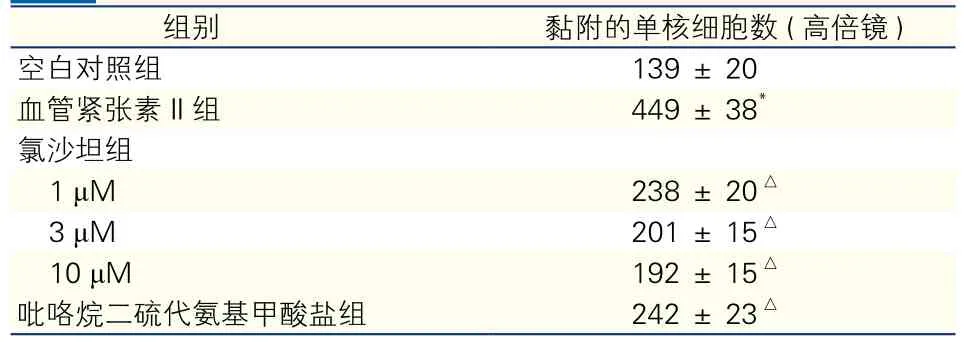
表1 血管紧张素II对单核细胞黏附的影响(n =4,±s)
注:与空白对照组相比*P<0.01;与血管紧张素Ⅱ组比△P<0.01
组别 黏附的单核细胞数 (高倍镜)空白对照组 139 ± 20血管紧张素Ⅱ组 449 ± 38*氯沙坦组1 μM 238 ± 20△3 μM 201 ± 15△10 μM 192 ± 15△吡咯烷二硫代氨基甲酸盐组 242 ± 23△
Ang II培养单核细胞24 h ,Ang II组与空白对照组比,显著增加黏附到内皮细胞上的单核细胞数(P<0.01),与 Ang II组比较氯沙坦(1,3,10 μM)组、PDTC组可明显减少黏附到内皮细胞上的单核细胞数(P<0.01),差异均有统计学意义。
2.2 血管紧张素II对单核细胞CXCR2 mRNA表达的影响
Ang II刺激单核细胞4 h, Ang II组可上调CXCR2 mRNA表达(P<0.01),氯沙坦(1,3,10 μM)组和PDTC组均可下调Ang II 诱导的CXCR2 mRNA表达(P<0.01)。图1
2.3 血管紧张素II对单核细胞培养上清液中白细胞介素-8、肿瘤坏死因子α水平的影响
Ang II培养单核细胞24 h ,Ang II组上清液中白细胞介素-8和肿瘤坏死因子α的含量与空白对照组比显著升高,差异均有统计学意义(P<0.01);氯沙坦(1, 3, 10 μM)组和PDTC组白细胞介素-8(图2A)、肿瘤坏死因子α(图2B)水平与Ang II组比含量降低,差异均有统计学意义(P<0.05, P<0.01)。
2.4 血管紧张素II对细胞内活性氧(ROS)水平的影响
Ang II培养单核细胞4 h,Ang II组较空白对照组显著增加细胞内ROS生成,差异有统计学意义(P<0.01)。氯沙坦(1, 3, 10 μM)组和PDTC组ROS水平与Ang II组比显著降低(P<0.01),差异均有统计学意义(图2C)。
2.5 血管紧张素II对单核细胞核转录因子κB和活化蛋白-1活性的影响
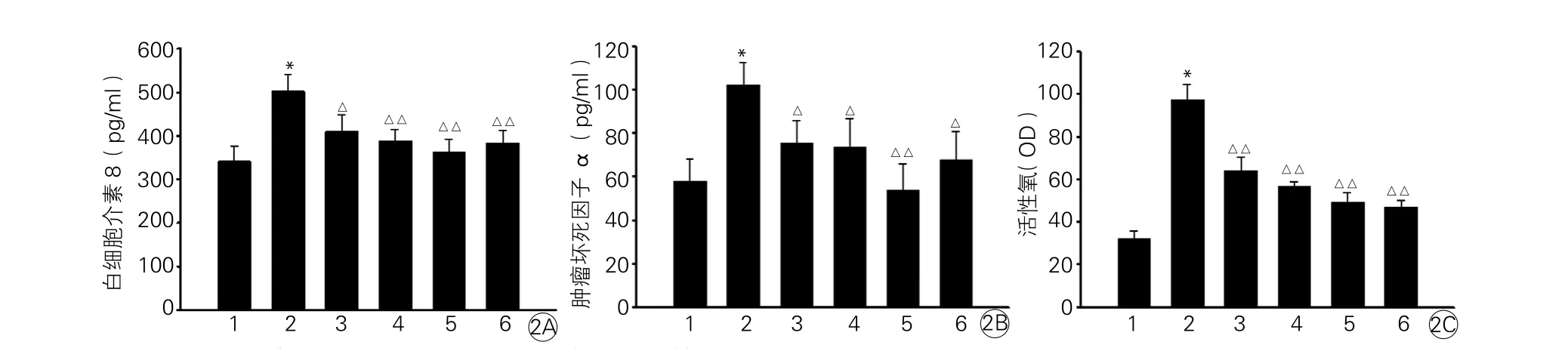
图2 血管紧张素Ⅱ对上清液中白细胞介素-8(2A)、肿瘤坏死因子(2B)及细胞内活性氧(2C)生成的影响(n=6)
电泳迁移率改变检测法(EMSA)结果所示,阴性对照组(没有加任何核蛋白)没有任何信号条带显影。与对照组相比,Ang II培养单核细胞4 h明显增加核转录因子κB(图3A)和AP-1(图3B)的活性。氯沙坦(1, 3, 10 μM)组、PDTC组核转录因子κB和AP-1活性较Ang II组明显降低。
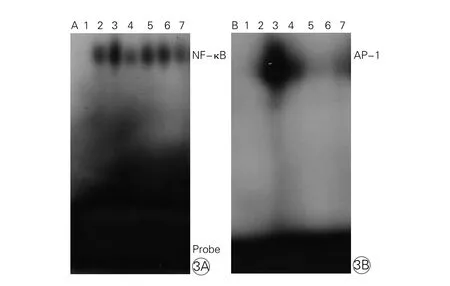
图3 电泳迁移率改变检测法分析血管紧张素Ⅱ对单核细胞核转录因子κB(图3A)和活化蛋白(图3B)活性的影响(n=3)
3 讨论
大量研究显示Ang II通过诱导氧化应激,促进炎症介质和趋化因子的释放,促进单核细胞活化,参与动脉粥样硬化的发生和发展。有研究报道,Ang II能增加还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶活性或表达促进ROS形成,增加斑块的不稳定性,促进动脉粥样硬化的进展[8]。国内有研究报道Ang II可呈时间和浓度依赖性的增加内皮细胞超氧阴离子的生成,缬沙坦可阻断Ang II的这一作用[9],说明氧化应激在Ang II诱导的炎症反应过程中起着非常重要的作用。
单核细胞迁移黏附到血管内皮的过程中趋化因子起了至关重要的作用。研究显示,白细胞介素-8可趋化新鲜分离的外周血单核细胞,促进单核细胞在流动的条件下稳定地黏附于血管内皮。CXCR2受体属于G蛋白偶联受体,与白细胞介素-8结合可帮助单核细胞稳定黏附到内皮细胞。研究报道,冠心病患者外周血CXCR2表达上调[10];在动脉粥样硬化进展期的粥样斑块巨噬细胞富集区CXCR2明显表达,敲除CXCR2受体后,斑块病变和单核巨噬细胞的聚集均明显减轻[2]。在佛波醇诱导的人单核细胞株细胞,氯沙坦可抑制Ang II诱导的细胞外基质金属蛋白酶诱导因子表达上调[11]。在体研究报道,大鼠腹腔注射Ang II可显著增加CXC趋化因子的水平,上调CXCR2的mRNA表达,增加中性粒细胞和单核细胞募集,而给予CXCR2阻断剂SB517785-M可抑制这一过程[12]。本实验结果显示Ang II能显著增加单核细胞内ROS生成,增加下游炎症因子白细胞介素-8、肿瘤坏死因子α,上调趋化因子受体CXCR2诱导单核细胞黏附,预先给予氯沙坦或PDTC可阻断Ang II的作用,提示Ang II通过其受体诱导的氧化应激介导了单核细胞黏附,这一过程与激活IL-8/CXCR2系统有关。
到目前为止,Ang II诱导趋化因子和炎症因子表达的信号传导途径尚不明确。然而,有越来越多的证据支持核转录因子κB和AP-1可能协同参与这一过程。研究报道各种炎症刺激包括Ang II、脂多糖、促炎细胞因子、氧自由基、病毒等都能活化AP-1;Ang II通过活化核转录因子κB通路,从而诱导大量炎症基因如白细胞介素-8、肿瘤坏死因子α、肿瘤坏死因子β的转录[13]。Schmeisser等[14]报道Ang II增加单核细胞白细胞介素-8的表达,氯沙坦可通过降低核转录因子κB活性阻断Ang II 的作用。本研究发现Ang II通过诱导氧化应激,激活核转录因子κB和AP-1,诱导单核细胞黏附,而氯沙坦或抗氧化剂PDTC可抑制这一过程,提示Ang II通过激活ROS-NF-κB/AP-1信号通路上调白细胞介素8/CXCR2表达,诱导单核细胞黏附。氯沙坦通过其抗氧化和抗炎症特性抑制Ang II所致的单核细胞活化,这也可能是氯沙坦新的抗动脉粥样硬化的新机制之一,值得进一步深入探讨。
[1] Jha HC, Srivastava P, Sarkar R, et al. Association of plasma circulatory markers, Chlamydia pneumoniae, and high sensitive C-reactive protein in coronary artery disease patients of India. Mediators Inflamm, 2009,2009: 561532.
[2] Boisvert WA, Curtiss LK, Terkeltaub RA. Interleukin-8 and its receptor CXCR2 in atherosclerosis. Immunol Res, 2000, 21: 129-137.[3] Nabah YN, Mateo T, Estelles R, et al. Angiotensin II induces neutrophil accumulation in vivo through generation and release of CXC chemokines. Circulation, 2004, 110: 3581-3586.
[4] Jia SJ, Jiang DJ, Hu CP, et al. Lysophosphatidylcholine-induced elevation of asymmetric dimethylarginine level by the NADPH oxidase pathway in endothelial cells. Vascul Pharmacol, 2006, 44: 143-148.
[5] Chen MF, X ie XM, Yang TL, et a l. Ro le o f asymm etric dimethylarginine in inflammatory reactions by angiotensin II. J Vasc Res, 2007, 44: 391-402.
[6] Kiemer AK, Vollmar AM. Autocrine regulation of inducible nitricoxide synthase in macrophages by atrial natriuretic peptide. J Biol Chem, 1998, 273: 13444-13451.
[7] Chen YR, Nie SD, Shan W, et al. Decrease in endogenous CGRP release in nitroglycerin tolerance: role of ALDH-2. Eur J Pharmacol,2007, 571: 44-50.
[8] Luchtefeld M, Grote K, Grothusen C, et al. Angiotensin II induces MMP-2 in a p47 phox-dependent manner. Biochem Biophys Res Commun, 2005, 28: 183-188.
[9] 叶国红, 韩莲花, 李红霞, 等. 探讨血管紧张素Ⅱ对人脐静脉内皮细胞产生超氧阴离子和1型纤溶酶原激活物抑制剂的作用机制.中国循环杂志, 2012, 27: 141-144.
[10] Leonard DA, Merhige ME, Williams BA, et al. Elevated expression of the interleukin-8 receptors CXCR1 and CXCR2 in peripheral blood cells in obstructive coronary artery disease. Coron Artery Dis, 2011,22: 491-496.
[11] 叶金善, 杨丽霞, 郭瑞威, 等. 血管紧张素Ⅱ对巨噬细胞的细胞外基质金属蛋白酶诱导因子表达的影响. 中国循环杂志, 2010, 25:58-61.
[12] Abu Nabah YN, Losada M, Estellés R, et al. CXCR2 blockade impairs angiotensin II-induced CC chemokine synthesis and mononuclear leukocyte infiltration. Arterioscler Thromb Vasc Biol, 2007, 27: 2370-2376.
[13] Tsuchiya K, Yoshimoto T, Hirono Y, et al. Angiotensin II induces monocyte chemoattractant protein-1 expression via a nuclear factorkappaB-dependent pathway in rat preadipocytes. Am J Physiol Endocrinol Metab, 2006, 291: E771-778.
[14] Schmeisser A, Soehnlein O, Illmer T, et al. ACE inhibition lowers angiotensin II-induced chemokine exp ression by reduction of NF-kappaB activity and AT1 receptor expression. Biochem Biophys Res Commun, 2004, 325: 532-540.
(编辑:常文静)
Angiotensin Ⅱ Increasing the Monocyte Adhesion Via Up-regulating IL-8 Receptor CXCR2 Expression
XIE Qi-ying, ZHONG Qiao-qing, XIE Xiu-mei, YANG Tian-lun, CHEN Mei-fang.
Department of Geriatric Medicine, Xiangya Hospital, Central South University, Changsha (410008), Hunan, China
CHEN Mei-fang, Email: meifang121@sohu.com
Objective: To explore the effect of angiotensin II (Ang II) increasing the monocyte adhesion w ith the possible molecular mechanism.
Methods: The experimental human monocytoid cells (THP-1) were cultured in 4 groups, each group contained 1×106cells. ① Blank control group, the cells were cultured for 4h or 24 h. ② Ang II treated group, the cells were cultured w ith Ang II (10-6M) for 4h or 24 h. ③Losartan treated group, the cells were cultured w ith losartan (1, 3, 10)μM for 1 hour and followed-by Ang II (10-6M) for 4h or 24 h. ④ PDTC group, cells were cultured w ith the anti oxidative agent PDTC 10 μM for 1.5 h and followed by Ang II (10-6M) for 4h or 24 h. The intracellular reactive oxygen species(ROS), the levels of interleukin-8 (IL-8), tumor necrosis factor (TNF-α) in the medium and the adhesion of monocyte to endothelial cells were exam ined. The expression of CXCR2 mRNA, nuclear factor kappaB (NF-κB) activity and activated protein (AP-1) were determ ined and compared among different groups.
Results: Compared w ith Blank control group, the Ang II treated group had signifi cantly elevated intracellular ROS,IL-8 and TNF-α, more monocyte adhesion to endothelial cells, higher expression of CXCR2 mRNA, increased activity of NF-κB and AP-1. The above Ang II induced up-regulations were inhibited by losartan in a dose-dependent manner. PDTC may also inhibit the Ang II induced oxidative stress and monocyte adhesion.
Conclusion: Ang II activates monocyte for developing atherosclerosis via up-regulating IL-8 receptor CXCR2 expression, which m ight be involved in ROS-NF-κB/AP-1 pathway.
Angiotensin II; Monocyte; Interleukin-8; Chemokine receptor
省科技厅课题(编号:2008FJ4183);湖南省卫生厅课题(编号:B2010-013)
410008 湖南省长沙市,中南大学湘雅医院 老干科(谢启应、谢秀梅、杨天伦、陈美芳);4230003 湖南省,郴州市第一人民医院心内科(钟巧青)
谢启应 副教授 博士 主要从事心脏电生理研究 Email: eagledoctor@163.com△钟巧青为并列第一作者 通讯作者:陈美芳Email: meifang121@sohu.com
R54
A
1000-3614(2014)05-0367-05
10.3969/j.issn.1000-3614.2014.05.013
2013-09-13)

