高活性甲壳素脱乙酰基酶产生菌种筛选
活 泼,梅 瑜,饶桂维,王 楠,李成平,林荣业
(1.浙江树人大学生物与环境工程学院,浙江杭州 310015;2.浙江金壳生物化学有限公司,浙江台州 317602)
高活性甲壳素脱乙酰基酶产生菌种筛选
活 泼1,梅 瑜1,饶桂维1,王 楠1,李成平1,林荣业2
(1.浙江树人大学生物与环境工程学院,浙江杭州 310015;2.浙江金壳生物化学有限公司,浙江台州 317602)
从新疆极端气候土壤样品中筛选到一组高产脱乙酰基酶活性的嗜热芽孢杆菌ctn C8-1,、ctn C8-1、ctn×5-3、ctn×10、ctn C8-3-2a。试验结果表明,其中菌株C8-3-2a的产酶活性最高,可在50℃以上的高温下生长;在甲壳素平板中培养48 h后,其透明圈与菌落直径比高。以甲壳素为主要碳源发酵96 h后,甲壳素全部降解成可溶性的低聚物。发酵液经微孔过滤除去菌体细胞后,以甲壳素为底物,37℃作用120 h后,甲壳素完全降解,并生成较多的乙酸,说明有较高的甲壳素降解酶和甲壳素脱乙酰基酶活性。
嗜热芽孢杆菌;甲壳素脱乙酰基酶;甲壳素降解酶
甲壳素(chitin)是仅次于纤维素的第2大类天然高分子化合物,广泛存在于虾、蟹等甲壳类水产动物中。浙江省是海洋大省,水产业在经济发展中占有重要地位,每年海水养殖的虾蟹类产量超过6万t,远洋捕捞的虾蟹类超过80万t。甲壳素是水产加工中产量较大的副产物,每年的产量约5万t以上。甲壳素的加工主要是通过甲壳素脱乙酰基生产壳聚糖,然后水解壳聚糖得到各类甲壳素低聚糖。目前甲壳素脱乙酰基过程中主要采用高温强碱脱去乙酰基生产壳聚糖,然后壳聚糖再用强酸水解成各类低聚糖,这种方法存在耗能大、产物纯化难、产品脱乙酰度不均一等缺点,同时带来严重的环境污染问题。如以酶法进行生物转化甲壳素制备壳寡糖等甲壳素衍生物则能耗低,基本无污染,可以达到清洁生产。因此得到高活性胞外甲壳素脱乙酰基酶及降解酶的微生物是开发甲壳素资源一个亟待解决的课题。本研究从新疆极端气候地区土壤中分离得到一组嗜热芽孢杆菌能产生高活性的胞外甲壳素脱乙酰基酶和甲壳素降解酶,在脱乙酰基的同时高效降解甲壳素,同一株微生物在其生长过程中既能合成高活性的胞外脱乙酰酶,又能合成高活性的甲壳素降解酶,在国内外均未见有相关报道[1-5]。
1 材料与方法
1.1 样品
土壤样品采集于新疆极端气候地区。甲壳素样品源于鱿鱼壳,将其粉碎过60目筛备用。
1.2 培养基
1.2.1 平板培养基
以甲壳素为主要碳源,每100 m L培养基添加酵母提取物,KH2PO4,MgSO4,CaCl2,NaCl和NH4Cl分别为0.14,0.5,0.4,0.05,0.2和0.5 g,琼脂2 g,水100 m L,调节pH值至7.0~7.2。
1.2.2 液体培养基
平板培养基不加琼脂,其他同。
1.3 酶活性测定
甲克素降解酶采用DNS方法。甲壳素脱乙酰酶催化脱去一个乙酰基,产生一分子乙酸。试验通过测定反应液中乙酸浓度的变化,测定甲壳素脱乙酰基酶的活性。
酶活单位定义(U)。在最适条件下,1 min催化产生相当于1μmol的乙酸所需的酶量。
测定方法。称取粉碎过60目筛的甲壳素100 mg,置于30 m L三角瓶中,121℃灭菌后,加入过滤除菌的发酵液10 m L,在37℃摇床71 r·min-1反应168 h,取样检测反应液乙酸含量。
2 结果与分析
2.1 甲壳素脱乙酰基酶菌种
采用双层平板法筛选,取土样1 g梯度稀释后涂布平板,置于46℃培养箱中培养96 h,挑去透明圈较大的单菌落,进一步培养研究。试验由土壤样品中筛选获得5株产酶活性较高的菌种,ctn C8-1,、ctn C8-1、ctn×5-3、ctn×10、ctn C8-3-2a,其中以ctn C8-3-2a为最好(图1)。
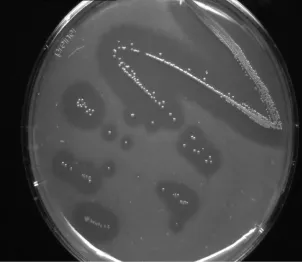
图1 菌种ctn C8-3-2a
经初步的生化特性及形态学鉴定结果表明,分泌甲壳素脱乙酰酶的ctn C8-1,、ctn C8-1、ctn×5-3、ctn×10、ctn C8-3-2a菌株为革兰氏阳性菌,好氧,短杆状,芽孢柱形中生,孢囊不膨大,菌落乳白色,半透明,表面光滑,边缘整齐,大小为1~2 mm。生长温度范围40~57℃,最适生长温度46℃,生长pH值6~10,最适pH值7~8。可利用甲壳素作为唯一碳源,根据以上特征与《伯杰氏系统细菌手册》对照,初步表明这5个菌株为芽孢杆菌属成员。
2.2 液体培养基
由图2可以看出,ctn C8-3-2a菌种的降解效果较其他菌种为好。
2.3 菌株甲壳素脱乙酰氨基酶活性
由图3可见,居中的瓶中甲壳素基本被降解,效果显著。
从图4可以看出,随着反应时间的增长,菌株C8-3-2a的反应液中的乙酸含量不断增加,菌株ctn×5-3虽也有相同趋势,但不及C8-3-2a在较短的时间内达到较高乙酸含量。结合图3可见,C8-3-2a降解甲壳素的能力比其他菌株要高,说明C8-3-2a具有较高的甲壳素降解酶和脱乙酰氨基酶活性,故选择菌株C8-3-2a做进一步研究。
2.4 脱乙酰氨基酶

图2 ctn C8-1,、ctn C8-1、ctn×5-3、ctn×10、ctn C8-3-2a对甲壳素的降解影响

图3 菌株发酵液过滤除菌后酶液降解甲壳素情况

图4 菌株酶液反应后乙酸含量的测定结果
将培养基中的甲壳素以葡萄糖替代进行发酵试验,结果(图5)发现,菌株可利用葡萄糖生长良好,但不产生脱乙酰氨基酶。由此可见,甲壳素是这些菌株产生脱乙酰氨基酶的必须的诱导因子,所以这些菌株产生的脱乙酰氨基酶为诱导酶。
3 小结和讨论

图5 培养基中葡萄糖替代甲壳素的发酵酶液乙酸含量检测
甲壳素脱乙酰酶来源广泛,包括一些真菌、植物病原体和昆虫等,目前产甲壳素脱乙酰酶的菌种筛选主要为真菌类,如来自真菌的多种脱乙酰酶已被纯化,少量编码基因被克隆,包括鲁氏毛霉、菜豆炭疽病菌、布拉克须霉、裂褶菇、白粉病菌、构巢曲霉、蓝色犁头霉和酿酒酵母。其中以构巢曲霉和蓝色犁头霉的脱乙酰基酶活性较高,来自细菌的脱乙酰酶报道很少。本研究从新疆极端气候地区土壤中分离得到这些嗜热芽孢杆菌(野生菌),能合成高活性的胞外脱乙酰酶,同时具有甲壳素降解能力。其中菌株C8-3-2a的产酶活性高,初步的研究结果表明,其可在50℃以上的高温下生长,在甲壳素平板中,培养48 h后,其透明圈与菌落直径比高。以甲壳素为主要碳源发酵96 h后,甲壳素全部降解成可溶性的低聚物。发酵液经微孔过滤除去菌体细胞后,以甲壳素为底物,37℃作用120 h后,甲壳素完全降解,并生成较多的乙酸,这说明有较高的甲壳素降解酶和甲壳素脱乙酰基酶活性。这些试验结果说明,菌株C8-3-2a既分泌甲壳素脱乙酰基酶又分泌甲壳素降解酶,且活性较高。同一株微生物在其生长过程中既能合成高活性的胞外脱乙酰酶又能合成高活性的甲壳素降解酶,在国内外均未见有相关报道。因此,有必要对该菌进行进一步甲壳素生物转化的研究,以期应用于甲壳素衍生物的工业化生产[6-15]。
[1] 蒋挺大.甲壳素[M].北京:化学工业出版社, 2003:1-55.
[2] 代养勇,曹健,王中太.甲壳素传统法与微波法制备壳聚糖的比较[J].食品工业科技,2006,27(6):54-57.
[3] Souza R F,Gomes R C,Coelho R R R,et al.Purification and characterization of an endochitinase produced by Colletrichum gloeosporioides[J].FEMS M icrobiology Letters,2002,222(1):45-50.
[4] M ing M,Kuroiwa T,Ichikawa S,et al.Production of chitosan oligosaccharides by chitosanase directly immobilized on an agar gel-coated multidisk impeller[J].Biochemical Engineering Journal,2006,28(3):289-294.
[5] Heredia A,Aguilar-Franco M,Magaαa C.Structure and interactions of calcite spherulites withα-chitin in the brown shrimp(Penaeus aztecus)shell[J].Materials Science and Engineering:C,2007,27(1):8-13.
[6] Jeraj N,Kuni˘c B,Lenasi H.Purification and molecular characterization of chitin deacetylase from Rhizopus nigricans[J].Enzyme and Microbial Technology,2006,39(6):1294-1299.
[7] Cai J,Yang J,Du Y.Enzymatic preparation of chitosan from the waste Aspergillus niger mycelium of citric acid production plant[J].Carbohydrate Polymers,2006,64:151-157.
[8] Dahiya N,Tewari R,Hoondal G S.Biotechnological aspects of chitinolytic enzymes:a review[J].Appllied M icrobioogy and Biotechnology,2006,71(6):773-782.
[9] Fukamizo T,Brzezinski R.Chitosanase from Streptomyces sp. strain N174:a comparative review of its structure and function[M].Biochemistry and Cell Biology,1997,75(6):687-696.
[10] Shresthaa B,Blondeaub K,Stevens W,et al.Hegaratb Expression of chitin deacetylase from Colletotrichum lindemuthianum in Pichia pastoris:pu rification and characterization[J].Protein Expression and Purification, 2004,38(2):196-204.
[11] Kim SK,Rajapakse N.Enzymatic production and biological activities of chitosan oligosaccharides(COS):A review[J]. Carbohydrate Polymers,2005,62(4):357-368.
[12] 蒋霞云,周培根,李燕.几种霉菌产甲壳素脱乙酰酶活力比较及部分酶学性质[J].上海水产大学学报,2006,15(2):211-215.
[13] 蔡俊,杜予民,杨建红,等.甲壳素脱乙酰酶产生菌的筛选及产酶条件[J].武汉大学学报:理学版,2005,51(4):485-488.
[14] Aye K N,Karuppuswamy R,Ahamed T,et al.Peripheral enzymatic deacetylation of chitin and reprecipitated chitin particles[J].Bioresource Technology,2006,97(4):577-582.
[15] Cai J,Yang J,Du Y,et al.Purification and characterization of chitin deacetylase from Scopulariopsis breυicaulis[J]. Carbohydrate Polymers,2006,65(2):211-217.
(责任编辑:张瑞麟)
TS 254.9
B
0528-9017(2014)03-0390-03
文献著录格式:活泼,梅瑜,饶桂维,等.高活性甲壳素脱乙酰基酶产生菌种筛选[J].浙江农业科学,2014(3):390-392.
2013-10-12
浙江省玉环县科技局科技计划项目(201113)
活 泼(1962-),女,新疆伊犁人,研究员,博士,主要从事食品生物技术研究工作。E-mail:xka-8@163.com。
李成平。E-mail:hzlicp@163.com。

