Fe3+对小球藻的生长及油脂含量的影响
孙远 刘文彬 周铁柱 谢通慧 梁斌 张永奎
(四川大学化学工程学院制药与生物工程系,成都 610065)
Fe3+对小球藻的生长及油脂含量的影响
孙远 刘文彬 周铁柱 谢通慧 梁斌 张永奎
(四川大学化学工程学院制药与生物工程系,成都 610065)
传统化石能源储量日益减少,生物柴油因其环保可再生性成为优质的石化柴油替代品。利用小球藻生产生物柴油速度快、油脂含量高,受到了广泛关注。为进一步提高小球藻生产生物柴油效率,分别探究了Fe3+的浓度及添加时间对自养和异养小球藻生长及产油的影响,获得最优Fe3+培养条件为:自养小球藻延滞期添加10-3g/L Fe3+,生物量及油脂含量达2.80 g/L及30.90%;异养小球藻指数期添加10-5g/L Fe3+,生物量及油脂含量达3.30 g/L及29.05%。经脂肪酸分析,以上条件获得的微藻油脂均可作为生物柴油生产原料。
小球藻 Fe3+自养 异养 生长 油脂
传统化石能源储量的日益减少,温室气体排放的加剧及油价的飙升使得全球对寻找可再生燃料的关注度越来越高[1]。生物柴油可减少57%-86%的温室气体排放,被广泛研究及开发。至今,生物柴油的原料主要来自油料作物(如大豆、玉米、麻疯树等)、动物脂肪和餐饮废油[2],由这些原料生产的生物柴油成本较高,且远远不能满足运输所需。微藻作为高光合生物有其特殊的原料成本优势,以微藻作为载体生产的可再生生物柴油可以满足全球需求[3]。微藻发酵具有生长速度快、油脂含量高、不与粮争田、环保等优点[5]。并且,微藻生物燃料无毒,可生物降解[6]。
微藻细胞可进行自养和异养生长,自养微藻利用CO2进行光合作用,可在一定程度减少温室气体的排放,利于环境保护。但自养微藻产量较低[7],对光照及空气含量具有依赖性。异养微藻可同时实现高细胞浓度及油脂含量[8],并且不依赖于光照和空气。但其昂贵的原料成本制约着异养微藻生产商业化[9]。在自然条件下微藻中的油脂含量,一般是生物量的14%-30%(W/W)[9,11]。
大量研究表明,众多无机元素,如氮、磷、钾、镁、钙、硫、铁、铜、锰及锌等都对微藻生长有
着一定的影响。此外,氯、钼等微量元素对微藻的生命活动也起着重要作用,常常被包括在藻类的微量元素配方之中。经过12年的现场试验研究,Behrenfeld等[12]发现在高氮低叶绿素及贫营养水域中,铁对浮游植物的生长与油脂积累起到了关键作用。很多科学家也对其机理做了研究,但遗憾的是至今科学界还没有得出一个公认的结果,但普遍认为可能是铁离子在脂质积累过程中调节了某些与脂质合成相关的酶的表达,主要是Fe3+能影响细胞色素氧化酶的铁卟啉的合成。因此,本研究主要进行Fe3+对小球藻自养和异养生长及产油影响的分析,获得利于小球藻自养和异养生长及产油的最优Fe3+浓度及添加时间,旨在为进一步提高小球藻生产生物柴油效率奠定基础。
1 材料与方法
1.1 材料
1.1.1 试样藻种 本课题组前期从水样中筛选获得的普通小球藻(Chlorella vulgaris)[4]。
1.1.2 培养基 种子液培养在添加了10 g/L葡萄糖的SE培养基中,其组成如下:0.75 g/L NaNO3,0.025 g/L CaCl2·2H2O,0.075 g/L MgSO4·7H2O,0.075 g/L K2HPO4·3H2O,0.175 g/L KH2PO4,0.025 g/L NaCl,0.005 g/L FeCl3·6H2O,1 mL/L Fe-EDTA,1 mL/L A5,40 mL/L Soil extract。发酵培养基为改良的SE培养基,根据试验设计含有不同铁离子浓度(Fe-EDTA)。自养培养基中不含有葡萄糖,异养培养基中含有10 g/L葡萄糖,接种量均有10%(V/V)。
1.1.3 培养条件 取新鲜培养基装入100 mL/250 mL三角瓶中,高压灭菌后(115℃,30 min),接入种子液,转速180 r/min,温度28℃。
1.2 方法
1.2.1 生长情况测定
1.2.1.1 光密度法 利用紫外/可见分光光度计测定680 nm处藻液的吸光度值(OD值),蒸馏水作参比。根据藻液的OD680值监测微藻细胞的生长状况。
1.2.1.2 细胞干重法 发酵结束后,取一定体积藻液将藻液于4 800 r/min下离心10 min,水洗3次,去除上清液。烘干下层藻体至恒重,获得微藻细胞的生物量(g/L)。
1.2.2 油脂含量及脂肪酸含量测定 发酵结束后,对干藻粉进行传统的氯仿-甲醇提取[13],细胞内部油脂被提取出来,从而获得小球藻油脂产量(g/L)。并根据下列公式计算得到小球藻油脂含量:
油脂含量(%)=油脂产量(g/L)/生物量(g/L)
提出的微藻油脂甲酯化后进行气质联用(GC/MS-QP2010,Shimadzu,Japan)分析其脂肪酸成分[4,13]。
1.2.3 统计学分析 所有试验设有3个平行样,计算平均值后绘制曲线进行分析,误差通过平行样与平均值的偏差获得。试验结果进行Origin 8的ANOVA显著分析。
2 结果
2.1 Fe3+对小球藻自养生长及产油的影响
2.1.1 Fe3+浓度对小球藻自养生长及产油的影响为探究Fe3+对小球藻自养培养条件下的生长及产油的影响情况,小球藻在含有10-1、10-3、10-5和10-7g/L Fe3+的SE培养基中的自养生长被监测,结果(图1)显示,低浓度的Fe3+(10-3、10-5和10-7g/L)有利于小球藻的生长,并且Fe3+对小球藻生长的促进作用在此浓度范围内(10-7-10-3g/L)随浓度的增加而增强。当Fe3+浓度达到10-3g/L时,对小球藻生长的促进作用不再增强,反而出现抑制作用,小球藻在10-3g/L Fe3+培养条件下的生长甚至低于培养基中无Fe3+的情况。
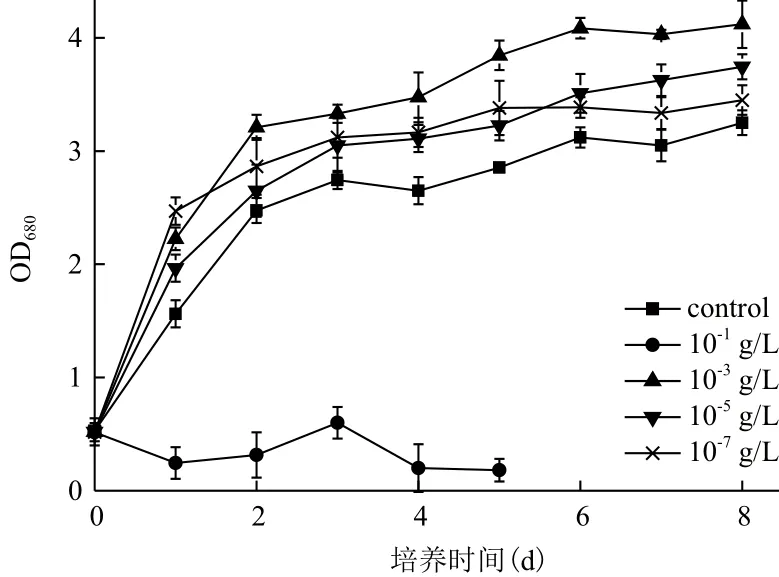
图1 Fe3+浓度对小球藻自养生长的影响
发酵结束后,比较不同Fe3+浓度培养条件下小球藻的生长及油脂含量可知,微藻细胞密度、生物量及油脂含量均在10-3g/L Fe3+培养条件下取得最大
值(表1)。此培养条件下,小球藻生物量达到2.80 g/L,约为不含Fe3+培养条件下小球藻生物量的1.04倍。关于小球藻的油脂含量,在10-3g/L Fe3+自养培养条件下高达30.90%,较不含Fe3+培养条件下其油脂含量提高了42.66%。Fe3+浓度不同,小球藻油脂含量出现了显著的区别,而且Fe3+对小球藻油脂含量的增强幅度大于Fe3+对小球藻生物量的增加幅度,说明Fe3+对小球藻的油脂积累有较大的影响作用。
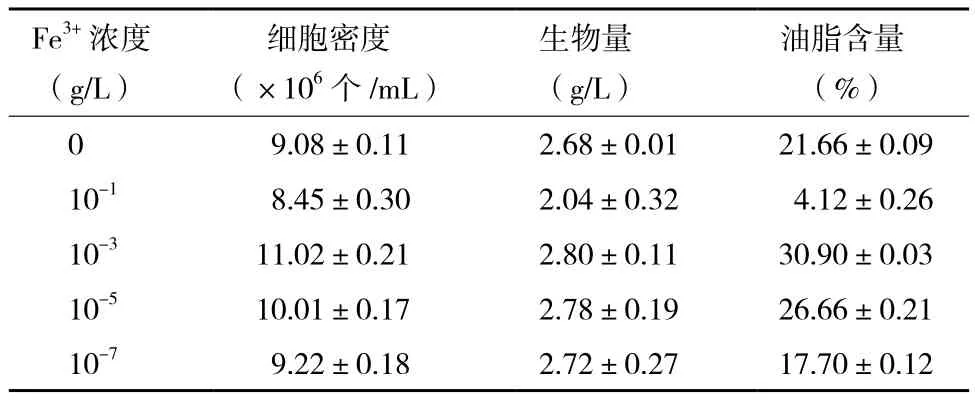
表1 不同Fe3+浓度培养条件下自养小球藻的细胞密度、生物量及油脂含量
2.1.2 Fe3+的添加时间对小球藻自养生长及产油的影响 根据上述试验结果,选定10-3g/L作为Fe3+的添加浓度,分别在小球藻的延滞期、对数期及稳定期时添加Fe3+,对小球藻的生长及产油情况进行监测,结果(图2,表2)显示。延滞期添加Fe3+后的第1天,小球藻快速生长,相对于稳定期添加Fe3+小球藻的生长具有一定程度的提高(34%)。进入第2天后,小球藻的生长显著加快,进入稳定期后其细胞密度约高于指数期及稳定期时添加Fe3+获得细胞密度的1.5倍(图2)。
发酵结束后,对比Fe3+不同添加时间获得的小球藻的生物量及油脂含量可知,延滞期添加Fe3+,小球藻的生物量及油脂含量均高于其他两个时期添加Fe3+获得的生物量及油脂含量。
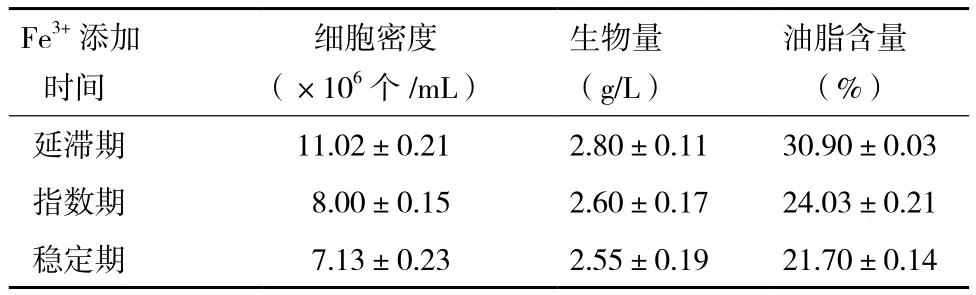
表2 不同时间添加Fe3+对自养小球藻细胞密度、生物量和油脂含量的影响
2.2 Fe3+对小球藻异养生长及产油的影响
2.2.1 Fe3+浓度对小球藻异养生长及产油的影响如图3所示,培养基中Fe3+浓度不同,小球藻的生长差异较大。较高浓度的Fe3+不利于小球藻的生长,10-1和10-3g/L Fe3+条件下小球藻的生长状况甚至低于不添加Fe3+时小球藻的生长。而低浓度的Fe3+(10-5和10-7g/L)有利于小球藻的生长。发酵结束后,根据小球藻的生物量及油脂含量(表3)得出,低浓度Fe3+条件下(10-5和10-7g/L)小球藻的生长大大优于高浓度Fe3+条件下(10-1和10-3g/L)小球藻的生长,前者约为后者的2.8倍。小球藻油脂含量在10-1g/L Fe3+的培养条件下最低,其他Fe3+浓度条件下小球藻的油脂含量差异不大。结合小球藻的异养生长,则10-5g/L Fe3+培养条件较优。
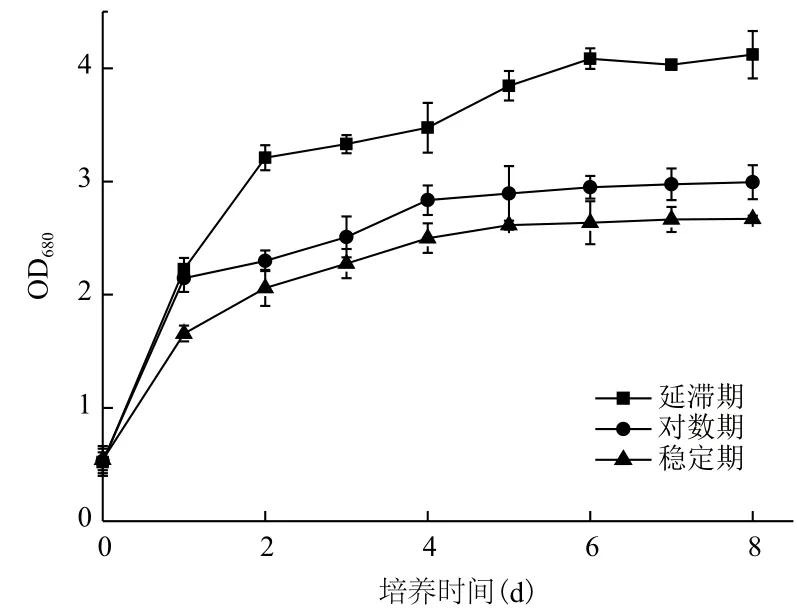
图2 Fe3+添加时间对小球藻自养生长的影响
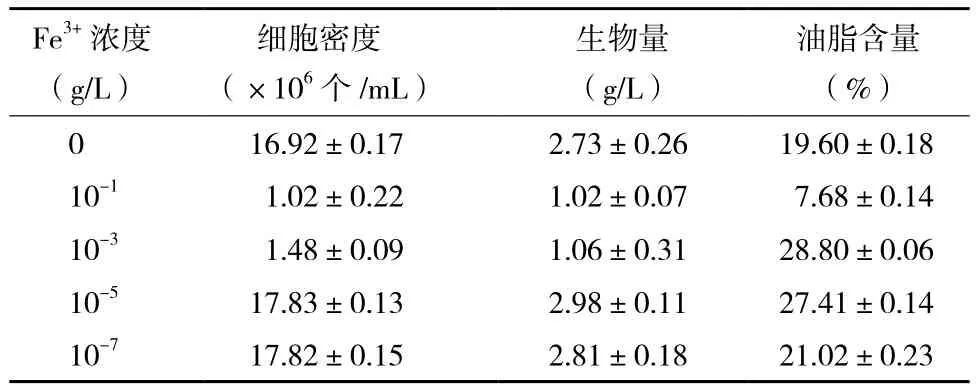
表3 不同Fe3+浓度培养条件下异养小球藻的细胞密度、生物量和油脂含量
2.2.2 Fe3+的添加时间对小球藻异养生长及产油的影响 分别对进入延滞期、对数期及稳定期的小球藻培养基中添加10-5g/L Fe3+,小球藻的生长及产油情况如图4和表4所示。延滞期及对数期添加Fe3+,小球藻的生长约为稳定期添加Fe3+时小球藻生长的2倍。这表明,小球藻生长的前期对Fe3+的促进作用较敏感,待到小球藻生长至稳定期后,利用Fe3+来促进小球藻的生长则较为困难。对比延滞期与对
数期添加Fe3+时小球藻的油脂含量,对数期添加Fe3+获得的小球藻的油脂含量略有优势,达到了生物量的29.05%,约为延滞期添加Fe3+获得的小球藻的油脂含量的1.06倍。综合考虑小球藻的异养生长及产油,Fe3+的最佳浓度及添加时间分别为10-5g/L和指数期。
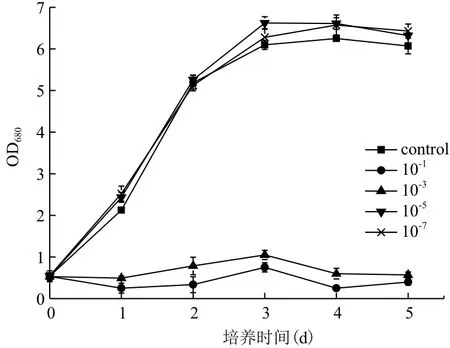
图3 不同Fe3+浓度对小球藻异养生长的影响

表4 不同时间添加Fe3+对异养小球藻细胞密度、生物量和油脂含量的影响
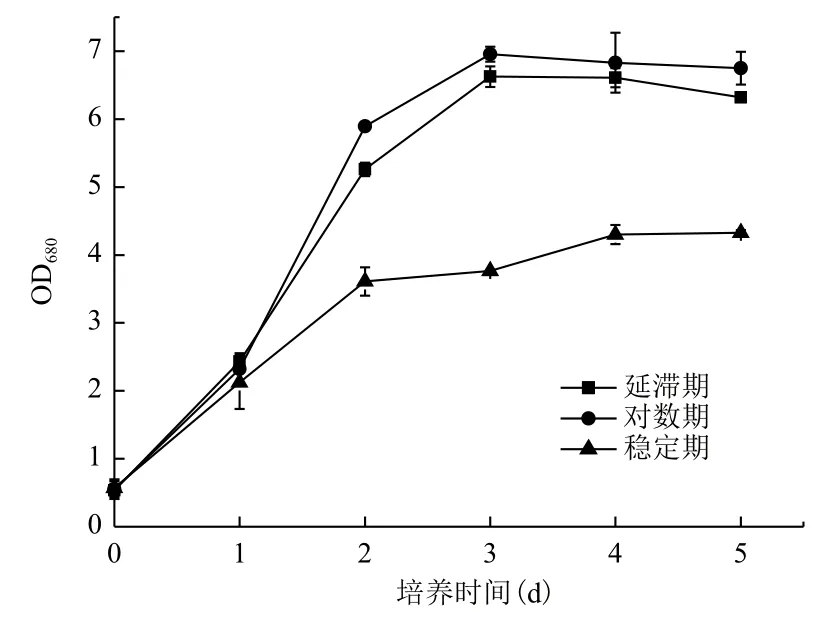
图4 Fe3+添加时间对小球藻异养生长的影响
2.3 脂肪酸组成
分别对自养小球藻在延滞期添加10-3g/L Fe3+培养条件下获得的油脂及异养小球藻在指数期添加10-5g/L Fe3+培养条件下获得的油脂进行脂肪酸组成测定,结果如图5所示。自养及异养小球藻脂肪酸组成主要为C16和C18类脂肪酸。本试验中,自养及异养条件下C18:1占总脂肪酸的比例相当,异养条件下C16:1含量较自养条件下C16:1含量多。根据经验公式计算[14],得到自养及异养条件下生长的小球藻生产出的油脂十六烷值分别为68.29和63.41。根据Pétursson[15]的研究,计算得到自养及异养条件下小球藻油脂的碘值分别为54.59 I2/ 100 g和71.78 I2/ 100 g。
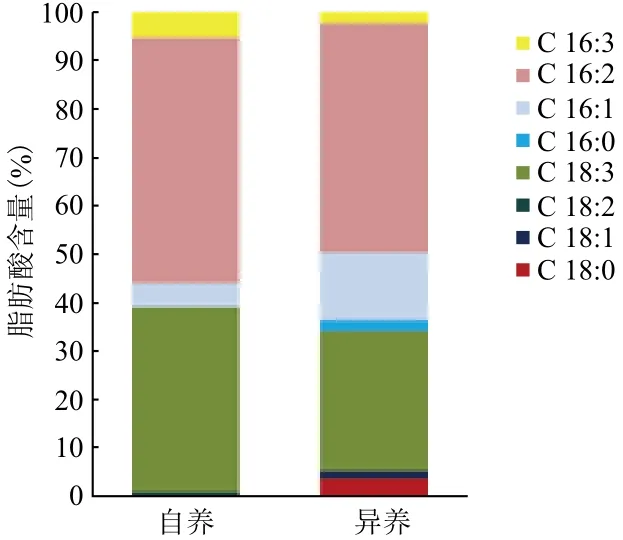
图5 自养及异养培养条件下小球藻脂肪酸的主要成分
3 讨论
小球藻自养生长时,Fe3+可以促进了与微藻生长繁殖有关的基因表达,从而提高微藻的细胞密度及生物量[16]。因此,当培养基中添加了Fe3+后,小球藻的生长优于其在不含Fe3+的培养环境下的生长。此外,Fe3+对小球藻的油脂合成途径中某些关键基因的表达也具有影响,如Fe3+可以影响rbcL、accD和PAP1等基因的表达,从而诱导小球藻的油脂生成[12,17]。因此,小球藻在含有Fe3+的培养环境中生长,有利于其油脂积累。Liu等[18]以小球藻为研究对象,也发现了同样的结果。但是,并非Fe3+在加入培养基以后,便立即对小球藻的生长发挥促进作用。而是在Fe3+加入培养基中一定时间后,其促进作用才得到充分发挥。因此,在小球藻生长的稳定期添加Fe3+,有利于Fe3+更好地发挥其对小球藻生长的促进作用。Fe3+对小球藻油脂积累的作用类似于其对小球藻生长的促进作用。在小球藻生长的稳定期向培养基中添加Fe3+,则有较为充裕的时间使Fe3+对小球藻的油脂合成途径中关键基因的表达发生作用,从而生成更多的油脂。综合以上因素,利于自养小球藻生长及产油的最佳Fe3+条件为:在小球藻生长的延滞期添加10-3g/L Fe3+。
小球藻异养生长时,Fe3+对小球藻发生促进作用具有一定的浓度限制,并非Fe3+浓度越高对小球藻生长的促进作用越好。如本实验的结果,培养基中Fe3+浓度为10-5g/L和10-7g/L时,小球藻的生长优于高浓度Fe3+培养条件下小球藻的生长。并且,当小球藻生长至稳定期时利用Fe3+来促进小球藻的生长较为困难,可能由于此时小球藻的生长已达到一定水平,细胞的活跃程度不高,对Fe3+的敏感度不高,使得Fe3+无法较好地发挥其促进作用,因此得到小球藻的生物量及油脂产量较低。综合考虑得到利于异养小球藻生长及产油的最佳Fe3+条件为:在小球藻生长的指数期添加10-5g/L Fe3+。
自养及异养小球藻油脂的主要成分为C16和C18类脂肪酸,此类脂肪酸是生物柴油生产利用的主要脂肪酸,与贾彬等[19]报道的结果一致。其中,十八碳三烯酸(C18:3)为细胞结构的主要构成成分[20]。C18:1和C16:1两类脂肪酸有利于生物柴油的氧化稳定性及寒冷环境下的性能稳定性[21]。考虑生物柴油的品质,试验获得油脂十六烷值及碘值均符合欧洲的EN 14214标准。由此可知,实验获得的微藻油脂可以作为优质的原料用于生物柴油生产。
4 结论
探究了Fe3+对小球藻生长及产油的影响,获得利于自养和异养小球藻生长及产油的最佳Fe3+浓度及添加时间分别为:延滞期添加10-3g/L Fe3+和指数期添加10-5g/L Fe3+。最优Fe3+培养条件下,获得的自养及异养小球藻的生物量分别为2.80 g/L和3.30 g/L,油脂含量分别为30.90%和29.05%。经过对微藻油脂的脂肪酸组成分析,得出自养及异养小球藻在最优Fe3+培养条件下生产的油脂均可作为生物柴油的生产原料。
[1] Aubert S, Gout E, Bligny R, et al. Multiple effects of glycerol on plant cell metabolism. Phosphorus-31 nuclear magnetic resonance studies[J]. Int J Biol Chem, 1994, 269(34):21420-21427.
[2] Lin J, Shen H, Tan H, et al. Lipid production by Lipomyces starkeyi cells in glucose solution without auxiliary nutrients[J]. J Biotechnol, 2011, 152(4):184-188.
[3] 宋东辉, 侯李君, 施定基. 生物柴油原料资源高油脂微藻的开发利用[J]. 生物工程学报, 2008, 24(3):341-348.
[4] Chisti Y. Biodiesel from microalgae[J]. Biotechnol Adv, 2007, 25(3):294-306.
[5] Xie T, Sun Y, Du K, et al. Optimization of heterotrophic cultivation of Chlorella sp. for oil production[J]. Bioresour Technol, 2012, 118:235-242.
[6] McPhee WA, Boucher M, Stuart J, et al. Demonstration of a liquid-tin anode solid-oxide fuel cell(LTA-SOFC)operating from biodiesel fuel[J]. Energy Fuels, 2009, 23(10):5036-5041.
[7] 缪晓玲, 吴庆余. 微藻生物质可再生能源的开发利用[J]. 可再生能源, 2003, 3(109):13-16.
[8] Qiao H, Wang G. Effect of carbon source on growth and lipid accumulation in Chlorella sorokiniana GXNN01[J]. Chin J Oceanol Limnol, 2009, 27:762-768.
[9] Hoque ME, Singh A, Chuan YL. Biodiesel from low cost feedstocks:The effects of process parameters on the biodiesel yield[J]. Biomass Bioenergy, 2011, 35(4):1582-1587.
[10] Spolaore P, Joannis-Cassan C, Duran E, et al. Commercial applications of microalgae[J]. J Biosci Bioeng, 2006, 101(2):87-96.
[11] 蒋汉明, 高坤山. 氮源及其浓度对三角褐指藻生长和脂肪酸组成的影响[J]. 水生生物学报, 2004, 28(5):545-551.
[12] Behrenfeld MJ, Worthington K, Sherrell RM, et al. Controls on tropical Pacific Ocean productivity revealed through nutrient stress diagnostics[J]. Nature, 2006, 442(7106):1025-1028.
[13] Wang W, Zhou W, Liu J, et al. Biodiesel production from hydrolysate of Cyperus esculentus waste by Chlorella vulgaris[J]. Bioresour Technol, 2013, 136:24-29.
[14] 陈林, 王忠, 李铭迪, 等. 生物柴油组分与十六烷值关系研究[J]. 中国油脂, 2012, 37(1):53-56.
[15] Pétursson S. Clarification and expansion of formulas in AOCS recommended practice Cd 1c-85 for the calculation of lodine value from FA composition[J]. J Am Oil Chem Soc, 2002, 79(7):737-738.
[16] 陈莉, 梁文艳, 王金丽, 等. 铁对铜绿微囊藻生长活性及产毒的影响[J]. 安全与环境学报, 2009, 9(4):21-24.
[17] Michel KP, Pistorius EK. Adaptation of the photosynthetic electron transport chain in cyanobacteria to iron deficiency:the function of IdiA and IsiA[J]. Physiol Plant, 2004, 120(1):36-50.
[18] Liu Z, Wang G, Zhou B. Effect of iron on growth and lipid accumulation in Chlorella vulgaris[J]. Bioresour Technol, 2008, 99(11):4717-4722.
[19] 贾彬, 王亚南, 何蔚红, 等. 生物柴油新原料——微生物油脂[J]. 生物技术通报, 2014(1):19-26.
[20] Garcí MC, Sevilla JF, Fernández FA, et al. Mixotrophic growth of Phaeodactylum tricornutum on glycerol:growth rate and fatty acid profile[J]. J Appl Phycol, 2000, 12(3-5):239-248.
[21] Pinzi S, Garcia I, Lopez-Gimenez F, et al. The ideal vegetable oilbased biodiesel composition:a review of social, economical and technical implications[J]. Energy Fuels, 2009, 23(5):2325-2341.
(责任编辑 李楠)
Effects of Fe3+on the Growth and Oil Content of Chlorella vulgaris for Biodiesel Production
Sun Yuan Liu Wenbin Zhou Tiezhu Xie Tonghui Liang Bin Zhang Yongkui
(Department of Pharmaceutical & Biological Engineering,School of Chemical Engineering,Sichuan University,Chengdu 610065)
Biodiesel is a clean renewable energy as the high quality substitute for traditional diesel. Chlorella vulgaris, used for biodiesel production, has been gaining the attention of the society because of its fast growth and high oil content. Iron ion could improve the growth and oil content of C. vulgaris. Effects of the concentration of Fe3+and the time to add Fe3+on the growth and oil content of autotrophic and heterotrophic C. vulgaris were explored in this study. The best conditions of Fe3+were as follow:(1)10-3g/L Fe3+added in the lag phase of autotrophic C. vulgaris, biomass of 2.80 g/L and oil content of 30.90% were obtained, (2)10-5g/L Fe3+added in the exponential phase of heterotrophic C. vulgaris, biomass of 3.30 g/L and oil content of 29.05% were obtained. And the oil produced by C. vulgaris under autotrophic and heterotrophic conditions was an ideal feedstock for biodiesel production.
Chlorella vulgaris Fe3+Autotrophy Heterotrophy Growth Oil content
2014-02-10
四川大学青年教师科研启动基金项目(2014SC011058)
孙远,女,硕士研究生,硕士,研究方向:微生物发酵;E-mail:suny88@163.com
张永奎,博士,教授,博士生导师,研究方向:应用微生物;E-mail:zhangyongkui@scu.edu.cn

