流式细胞仪分析癌细胞对肥大细胞募集的影响*
林珏龙,刘 柳,沈志忠,陈春桂,金玲爽,吴淑献,朴仲贤,方泽曼
(汕头大学医学院 a.中心实验室;b.第一附属医院,广东 汕头515041)
食管鳞状细胞癌是一种最常见的且预后不良的消化道恶性肿瘤。研究显示多数人类肿瘤中,肿瘤的预后与肥大细胞的密度相关,并大量的研究已在探讨这个问题。在脊椎动物免疫细胞演变过程中,肥大细胞(mast cell,MC)是初期的免疫细胞并能演变成多功能细胞[1]。MC是IgE依赖过敏疾病的引发者,在先天和适应性免疫反应、感染及炎症性自身免疫性疾病中发挥着重要的作用[2-4]。MC不仅在过敏反应和自身免疫中被广泛地研究,且越来越被认为是人类恶性肿瘤中肿瘤基质微环境的关键组件[5-8]。研究表明:MC参与初期的肿瘤的炎症反应,促进或延缓肿瘤生长取决于癌症的类型[9-11]。MC在组织定位、应答与其分化成不同的表型一样,通常取决于最终到达组织所在地的化学环境[12,13]。MC表型的“异质性”或“可塑性”由其受体和颗粒成分的差异表达体现出来。在啮齿动物,大致分为连接组织类型(也称浆膜)和粘膜类型MC,其特异的组织化学染色差异主要表现为MC颗粒中蛋白聚糖核心的粘多糖成分[14]。人类MC是根据其特征酶:类胰蛋白酶和类糜蛋白酶颗粒的表达差异分型。一种类型为MCT型,只包含类胰蛋白酶,是呼吸道和肠道粘膜的主要亚型。MCTC型同时包含类胰蛋白酶和类糜蛋白酶,主要在皮肤、滑膜、结膜、淋巴结、心肌以及胃和小肠黏膜下层分布。第三个类型是表达类糜蛋白酶的MCC型,在胃粘膜组织,小肠和结肠发现[15,16]。基于MC的特征酶在进化中的保守特性,哺乳动物中MC的类胰蛋白酶和类糜蛋白酶具有一定的同源性[17,18]。小鼠的MC蛋白酶(mouse mast cell protease,mMCP)分为:肥大细胞类胰蛋白酶(mMCP-6)和类糜蛋白酶(mMCP-4)[19]。此外,因生物体内MC的迁移或分布于不同的组织的过程十分复杂,肿瘤细胞在培养液环境或免疫缺陷的动物体内的实验不能完全复制生物体内环境,因此,我们利用食管癌细胞株EC109植入小鼠腹腔后,用鼠抗人类胰蛋白酶和类糜蛋白酶抗体(因MC特征酶的同源性),检测鼠肥大细胞在腹腔募集及其形成的肿瘤细胞周边的微环境,了解不同MC亚型的变化对食管癌细胞周边的微环境的影响。
1 材料
1.1 实验动物
SPF级昆明(KM)小鼠,雌雄不限,体重18~22 g,来源于汕头大学医学院实验动物中心[SCXK(粤)2007-0017],实验在实验动物中心屏障动物实验设施内进行[SYXK(粤)2007-0097],动物饲养管理严格按照中华人民共和国科技部实验动物管理规范。
1.2 主要试剂
小鼠抗人肥大细胞的类胰蛋白酶的单克隆抗体(IgG1)和类糜蛋白酶的单克隆抗体(IgM)由原汕头大学医学院变态反应学和炎症学研究所提供。抗IgM抗体-PE标记[大鼠抗小鼠IgG1-PE(藻红素,phycoerythrin,PE,美国SBA公司)],类胰蛋白酶抗体直接荧光PE Cy5标记(由晶美公司技术部标记)。同型对照:小鼠IgG1同型物PE Cy5(晶美公司),大鼠IgG1同型物PE(美国SBA公司)。磷酸缓冲液(phosphate buffer salt,PBS,0.1 mol/mL,pH 7.2~7.4,美国Invitrogen公司),0.2%Triton X-100,胰酶(trypsin,华美公司)。人食管癌EC109细胞株(由汕头大学医学院生物化学研究室惠赠)。
2 方法
2.1 动物模型
KM小鼠进入SPF环境饲养一周后,对小鼠进行注射诱导。将小鼠分成5组,每组3只小鼠,分别向其中4组小鼠腹腔注射:食管癌细胞(106/mL,0.4 mL);食 管 癌 细 胞(106/mL,0.4 mL)和 胰 酶(0.005 mg/只);食管癌细胞(106/mL,0.4 mL)和As2O3(0.00594 mg/只);食 管 癌 细 胞(106/mL,0.4 mL)、As2O3(0.00594 mg/只)和胰 酶(0.005 mg/只)。第5组不作处理,作为对照。
2.2 腹腔液的细胞提取
对小鼠进行注射诱导24 h后,提取小鼠的腹腔液。先将小鼠颈椎脱臼处死,向腹腔内注射1~2 mL的生理盐水,打开腹腔,吸取腹腔液于离心管中,生理盐水洗涤2次,细胞以70%的乙醇固定,制成细胞悬液。
2.3 肠组织切片的制备及染色
取小鼠肠组织,经石蜡包埋、切片、脱蜡,用甲苯胺蓝染色法对组织中的肥大细胞进行染色,95%乙醇镜下分色,光镜下观察小鼠肠组织MC经不同刺激物的作用后在肠壁移动的状况。
2.4 细胞的荧光标记
MC特征性蛋白酶免疫荧光的标记:分别取已固定的细胞悬液(鼠腹腔液的细胞,106/mL)各0.2 mL,置于不同的离心管中,0.1 moL/L PBS洗涤1-2次,0.2%Triton X-100处理10 min,PBS洗涤1-2次。类糜蛋白酶抗体(IgM,0.2μg/μL,1∶100稀释)标记,置于4℃冰箱中过夜。PBS洗涤1次,分别加入抗IgM抗体-PE及抗类胰蛋白酶抗体PE-Cy5(IgG,0.33μg/μL,1∶100稀释),室温暗置2 h或4℃过夜,制成0.5 mL细胞悬液。流式测试的对照组:取细胞悬液0.2 mL,PBS洗涤1次。0.2%Triton X-100处理10 min,PBS洗涤1次。分别加入以上两种抗体对应荧光的同型物。
2.5 流式细胞仪检测
使用FACSCalibur流式细胞仪(BD.Co.USA)检测鼠腹腔细胞的细胞悬液样品。以亚离子激光488 nm激发,当悬浮细胞逐个地通过检测区时光学系统检测荧光信号,以MC抗体对应的同型物为对照组,根据MC特征性蛋白酶免疫荧光标记对细胞内类胰蛋白酶-PE Cy5及类糜蛋白酶-PE进行双参数分析。每组样品进行3次实验,每次获10 000个细胞的实验数据。
2.6 统计分析
以SSPS 13.0软件对实验数据进行T检验。
3 结果
3.1 组织化学观察MC在肠壁中的迁移
以碱性染料甲苯胺蓝染色,肥大细胞内的颗粒被染成紫红色。光镜下MC主要存在于小肠黏膜、黏膜下层、肌层和浆膜,在小肠绒毛上皮细胞间可见较多的MC存在[20]。本研究观察各实验组,①在未受到诱导时,MC主要分布于小肠绒毛上皮细胞间(图1a,箭头所示),平滑肌层与粘膜下层较薄,MC分布较少。②食管癌EC109细胞株及其一系列诱导试剂植入小鼠腹腔后,通过肠组织切片观察在小鼠肠壁面向腹腔的平滑肌层与粘膜下层有大量MC的分布(图1b至e,箭头所示)。从各图比较可见:将胰酶和/或As2O3植入腹腔均能刺激鼠肠壁的平滑肌层与粘膜下层增厚,组织细胞间隙的增大可能有利于MC在此迁移及迁入腹腔。因此,食管癌EC109细胞株及其一系列诱导植入后,小鼠腹腔环境的改变影响到MC迁入腹腔。

图1 a:无癌细胞或诱导剂处理;b:食管癌细胞;c:食管癌细胞和胰酶;d:食管癌细胞和As2O3;e:食管癌细胞、As2 O3和胰酶。肥大细胞如箭头所示(TB X 400)Fig.1 a:No cancer cell or inducers inducing;b:Esophageal carcinoma cells;c:Esophageal carcinoma cells and Tyrisin;d:Esophageal carcinoma cells and As2 O3;e:Esophageal carcinoma cells,As2 O3 and Tyrisin.Arrow shows the mast cell(TB X 400)
3.2 流式细胞仪对小鼠腹腔液的MC亚型确定
以激光波长488 nm激发,对荧光标记的MC特征蛋白酶抗体的细胞样品进行鉴定,经类胰蛋白酶-PE Cy5及类糜蛋白酶-PE双参数分析。在双通道检测点图中,X轴显示类糜蛋白酶PE-Cy5(发射荧光波长667 nm)阳性;Y轴标为类胰蛋白酶PE(发射波长578 nm)阳性。见图2,R1区域的细胞群:为类胰蛋白酶阳性的MCT型肥大细胞群;R2区域的细胞群:是类胰蛋白酶和类糜蛋白酶阳性的MCTC型肥大细胞群;R3区域的细胞群:为类糜蛋白酶阳性的MCC型肥大细胞群。因此,可将小鼠腹腔液中MC分型确定为类似人类的T型,TC型及C型三个亚型。
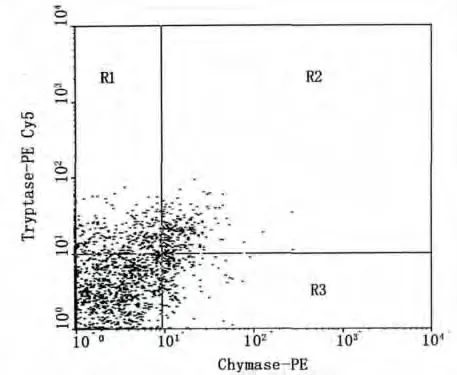
图2 R1区域:类胰蛋白酶阳性的MCT型;R2区域:类胰蛋白酶和类糜蛋白酶阳性的MCTC型;R3区域:类糜蛋白酶阳性的MCC型Fig.2 R1 region:MCT subtype of tryptase positive;R2 region:MCTC subtype of tryptase and chymase positive;R3 region:MCC subtype of chymase positive
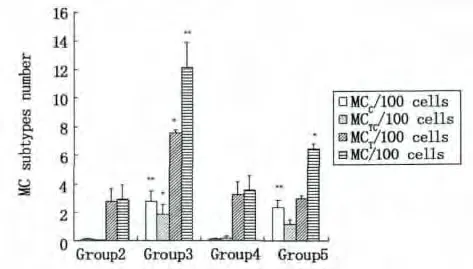
图3 * MCT型,组3与组2,4和5比较,#P<0.05。* MCTC型,组3与组2,4比较,#P<0.05。**MCC型,组3或5与组2,4比较,#P<0.01。**总MC,组3与组2,4,5比较,#P<0.01;*组5与组2,4,3比较,#P<0.05Fig.3 * MCT subtype,Group 3 compared with group 2,4 and 5,#P<0.05.* MCTC subtype,Group 3 compared with group 2 and 4,#P<0.05.**MCC subtype,Group 3 or 5 compared with group 2 and 4,#P<0.01.**Total MC,Group 3 compared with group 2,4 and 5,#P<0.01,* Group 5 compared with group 2,4 and 3,#P<0.05
3.3 不同的诱导对肥大细胞募集的影响
不同的诱导影响肥大细胞三种亚型在鼠腹腔细胞中的比率,见图3。组1腹腔未植入癌细胞,腹腔液中为鼠的腹腔细胞;组2至5植入癌细胞和/或诱导试剂,腹腔液主要含有鼠腹腔细胞和癌细胞。组2至5的细胞成分较一致,可进行组间鼠腹腔微环境MC亚型变化的比较:①组3,胰酶可诱导MC在鼠腹腔细胞中的百分率增加;②组2与组4比较,As2O3无明显诱导MC迁入腹腔;③组3与 组5,胰酶诱导MCC型迁入腹腔的百分率增加。不同的诱导促使鼠腹腔细胞中肥大细胞三种亚型占总MC的百分率变化,见图4。①组1,在小鼠未受到诱导时,主要是MCT型迁入鼠腹腔;②组3和 组5,胰酶诱导MCC型迁入鼠腹腔比率增加,MCT型迁入比率减弱;③组2和 组4,植入EC109细胞后,MCT型迁入比率增加;④As2O3对各亚型的迁入影响不明显。因此,小鼠腹腔植入癌细胞和/或诱导试剂处理后,鼠腹腔液的微环境发生变化。食管癌EC109细胞可诱导MCT型迁入鼠腹腔比率增加(图4,组2和4);胰酶诱导腹腔中三种MC亚型迁入比率增加(图3,组3)。
4 讨论
肥大细胞在1878年由Ehrlich等第一次描述,像所有造血系细胞一样来源于骨髓造血干细胞。其前体通过血循环到达目标组织而分化[21,22],成熟的肥大细胞分布于多种组织,以皮肤,呼吸道和消化道较多[23]。过去的一个多世纪,对MC功能的研究不仅确定了其在过敏和炎症反应中组织重塑、伤口愈合、关节炎、过敏和哮喘[24-26]方面的贡献,而且证实它参与了肿瘤生长的进程。许多实体肿瘤的研究发现:MC渗透到肿瘤和健康组织之间,在肿瘤的生长中,MC对血管生成、组织重构和免疫调制等起关键的角色。虽然MC和肿瘤进展之间的相互关系及作用机制尚不清楚,但对肿瘤相关MC的研究表明这些细胞参与肿瘤进展,通过中介产物促进局部的血管生成[27-29]。近年的研究表明,MC可能作为一种癌症治疗中新的治疗目标,抑制MC的功能可能会导致肿瘤回归[30,31]。生物体为应对机体内或外的一系列刺激,体内MC可大量地招募到不同的组织。在这些诱导研究中,来源于肿瘤细胞诱导的鼠模型的实验数据显示了生物体内肿瘤进程中MC的功能,补充了人类患者的相关研究。本研究实验中,利用食管癌EC109细胞和/或诱导试剂植入小鼠腹腔,观测鼠肠组织形态及腹腔液中MC的变化。从组织化学图像观察:食管癌EC109细胞植入鼠腹腔对肠组织形态无明显的影响;胰酶的植入可诱导肠组织的平滑肌层及粘膜下层增厚及MC增多;As2O3诱导肠组织的平滑肌层及粘膜下层增厚。由此可能影响MC的迁移,改变小鼠腹腔内的微环境。
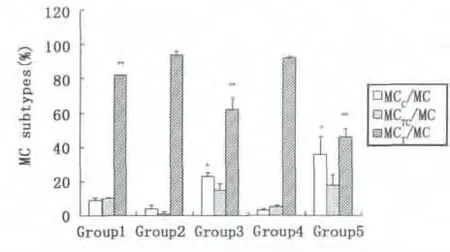
Fig.4 MCC subtype,Group 3 compared with group 2 and 4,#P<0.01;with group 1 and 5,#P<0.05;Group 5 compared with group 1,2 and 4,#P<0.01.MCT subtype,Group 1 compared with group 3 and 5,#P<0.01;with group 2 and 4,#P<0.05;Group 3 compared with group1,2,4 and 5,#P<0.01;Group 5 compared with group1,2,3 and 4,#P<0.01图4 * MCC型,3组与2,4组比较,#P<0.01,与1,5组比较,#P<0.05;5组与1,2,4组比较,#P<0.01。**MCT型,1组与3,5组比较,#P<0.01,与2,4组比较,#P<0.05;3组与1,2,4,5组比较,#P<0.01;5组与1,2,3,4组比较,#P<0.01
因肥大细胞的特征酶在进化中的保守特性,哺乳动物MC的类胰蛋白酶和类糜蛋白酶具有同源性[17,18]。研究发现在某些方面,人MCTC对应啮齿动物的浆膜肥大细胞,而MCT近似粘膜肥大细胞[14]。小鼠肥大细胞的蛋白酶mMCP-6和7(又称类胰蛋白酶)和mMCP-4和5(即类糜蛋白酶)[19],在肿瘤进展中,mMCP的表达不断发生改变[32]。由此,本研究为探讨鼠腹腔植入食管癌EC109细胞和/或诱导试剂,癌细胞迁入后腹腔微环境的变化。使用荧光标记的类胰蛋白酶和类糜蛋白酶抗体对鼠腹腔内环境的MC亚型进行鉴别,确认了鼠腹腔内环境应对癌细胞和/或诱导发生了改变:①未诱导组鼠腹腔MC以T型迁入为主,与人MCT型为肠道粘膜的主要迁移亚型相似[14];②食管癌EC109细胞诱导MCT型迁入鼠腹腔比率增加;③胰酶诱导MCC迁入鼠腹腔比率增加,MCT迁入比率减弱;④As2O3对MC各亚型迁入腹腔的影响不明显。因此,可以通过类胰蛋白酶和类糜蛋白酶亚型的差异表达,确定不同诱导物对腹腔微环境变化的影响。从以往大量的研究证明了MC亚型的组织适应性[33,34],在实体肿瘤中MC渗透肿瘤和健康组织之间,MC的数量在恶性肿瘤显著增加[35];对肿瘤微环境内的MC亚型的鉴定可用于描述炎性细胞的渗透,并在肿瘤的发展中不断地改变[30]。由此,我们可以确认:在未受胰酶的刺激下,食管癌EC109细胞可诱导MCT型迁入鼠腹腔,改变癌细胞周边的微环境。
肥大细胞对肿瘤生长的影响可以分为直接作用于肿瘤细胞,如MC介导细胞毒性;或间接影响,如MC调控血管生成、组织周边环境的改造和免疫细胞的募集[29,36]。有研究显示鼠MC类胰蛋白酶mMCP-6和7可引起中性粒细胞和嗜酸性粒细胞侵入炎症部位[37],嗜酸性粒细胞能启动毒杀肿瘤细胞[38]。这些类胰蛋白酶也可能参与细胞外基质成分的降解,对新血管形成和肿瘤进展至关重要[39,40]。因此,类胰蛋白酶变化可能会影响到肿瘤进展过程。本研究结果显示:食管癌EC109细胞诱导MCT(含类胰蛋白酶)型向鼠腹腔迁移的比率增加,与胰酶诱导MCC型向鼠腹腔迁移不同,呈现出肥大细胞表型在不同组织及不同诱导的“异质性”,改变了癌细胞周边的微环境,有可能诱导其它炎性细胞向鼠腹腔迁移--介导细胞毒杀作用(有待进一步研究),进而影响食管癌细胞的生长。
[1] CRIVELLATO E,RIBATTI D.The mast cell:an evolutionary perspective[J].Biol Rev Camb Philos Soc,2010,85(2):347-360.
[2] METZM,SIEBENHAAR F,MAURER M.Mast cell functions in the innate skin immune system[J].Immunobiology,2008,213(3-4):251-260.
[3] GALLI SJ,MAURER M,LANTZCS.Mast cells as sentinels of innate immunity[J].Curr Opin Immunol,1999,11(1):53-59.
[4] ABRAHAM SN,ST JOHN A L.Mast cell-orchestrated immunity to pathogens[J].Nat Rev Immunol,2010,10(6):440-452.
[5] ALI G,BOLDRINI L,LUCCHI M,et al.Tryptase mast cells in malignant pleural mesothelioma as an independent favorable prognostic factor[J].J Thorac Oncol,2009,4(3):348-354.
[6] DABIRI S,HUNTSMAN D,MAKRETSOV N,et al.The presence of stromal mast cells identifies a subset of invasive breast cancers with a favorable prognosis[J].Mod Pathol,2004,17(6):690-695.
[7] HEDSTROM G,BERGLUND M,MOLIN D,et al.Mast cell infiltration is a favourable prognostic factor in diffuse large B-cell lymphoma[J].Br JHaematol,2007,138(1):68-71.
[8] RIBATTI D,ENNASM G,VACCA A,et al.Tumor vascularity and tryptase-positive mast cells correlate with a poor prognosis in melanoma[J].Eur JClin Invest,2003,33(5):420-425.
[9] GALINSKY D S,NECHUSHTAN H.Mast cells and cancer-no longer just basic science[J].Crit Rev Oncol Hematol,2008,68(2):115-130.
[10] RIBATTI D,CRIVELLATO E.Mast cells,angiogenesis,and tumour growth[J].Biochim Biophys Acta,2012,1822(1):2-8.
[11] SAITO H.Role of mast cell proteases in tissue remodeling[J].Chem Immunol Allergy,2005,87:80-84.
[12] MOON T C,ST LAURENT C D,MORRIS K E,et al.Advances in mast cell biology:new understanding of heterogeneity and function[J].Mucosal Immunol,2010,3(2):111-128.
[13] COLLINGTON S J,WILLIAMS T J,WELLER C L.Mechanisms underlying the localisation of mast cells in tissues[J].Trends Immunol,2011,32(10):478-485.
[14] GILFILLAN A M,BEAVEN M A.Regulation of mast cell responses in health and disease[J].Crit Rev Immunol,2011,31(6):475-529.
[15] HEIB V,BECKER M,TAUBE C,et al.Advances in the understanding of mast cell function[J].Br J Haematol,2008,142(5):683-694.
[16] WEIDNER N,AUSTEN K F.Ultrastructural and immunohistochemical characterization of normal mast cells at multiple body sites[J].J Invest Dermatol,1991,96(3 Suppl):26S-30S;discussion 30S-31S,60S-65S.
[17] REIMER JM,SAMOLLOWPB,HELLMANL.High degree of conservation of the multigene tryptase locus over the past 150-200 million years of mammalian evolution[J].Immunogenetics,2010,62(6):369-82.
[18] REIMER J M,ENOKSSON M,SAMOLLOW P B,et al.Extended substrate specificity of opossum chymase--implications for the origin of mast cell chymases[J].Mol Immunol,2008,45(7):2116-2125.
[19] LUNDERIUSC,XIANG Z,NILSSON G,et al.Murine mast cell lines as indicators of early events in mast cell and basophil development[J].Eur J Immunol,2000,30(12):3396-3402.
[20] 刘柳,朴仲贤,沈志忠,等.食管癌细胞诱导肥大细胞迁移的小鼠模型[J].中国实验动物学报,2012,20(5):62-68.LIU Liu,PIAO Zhongxian,SHEN Zhizhong,et al.Esophageal cancer EC109 cells induces mast cell migration in a mouse model[J].Acta Laboratorium Animalis Scientia Sinica,2012,20(5):62-68.
[21] CHEN C C,GRIMBALDESTON M A,TSAI M,et al.Identification of mast cell progenitors in adult mice[J].Proc Natl Acad Sci U SA,2005,102(32):11408-11413.
[22] GALLISJ.New insights into“the riddle of the mast cells”:microenvironmental regulation of mast cell development and phenotypic heterogeneity[J].Lab Invest,1990,62(1):5-33.
[23] GRIMBALDESTON M A,METZ M,YU M,et al.Effector and potential immunoregulatory roles of mast cells in IgE-associated acquired immune responses[J].Curr Opin Immunol,2006,18(6):751-760.
[24] HEBDA PA,COLLINSM A,THARPM D.Mast cell and myofibroblast in wound healing[J].Dermatol Clin,1993,11(4):685-696.
[25] NIGROVIC P A,LEE D M.Mast cells in inflammatory arthritis[J].Arthritis Res Ther,2005,7(1):1-11.
[26] BOYCE J A.The role of mast cells in asthma[J].Prostaglandins Leukot Essent Fatty Acids,2003,69(2-3):195-205.
[27] TOMITA M,MATSUZAKI Y,ONITSUKA T.Effect of mast cells on tumor angiogenesis in lung cancer[J].Ann Thorac Surg,2000,69(6):1686-1690.
[28] RIBATTI D,VACCA A,MARZULLO A,et al.Angiogenesis and mast cell density with tryptase activity increase simultaneously with pathological progression in B-cell non-Hodgkin’s lymphomas[J].Int J Cancer,2000,85(2):171-175.
[29] RIBATTI D,CRIVELLATO E,ROCCARO A M,et al.Mast cell contribution to angiogenesis related to tumour progression[J].Clin Exp Allergy,2004,34(11):1660-1664.
[30] MALTBY S,KHAZAIE K,MCNAGNY K M.Mast cells in tumor growth:angiogenesis,tissue remodelling and immunemodulation[J].Biochim Biophys Acta,2009,1796(1):19-26.
[31] JOHANSSON A,RUDOLFSSON S,HAMMARSTEN P,et al.Mast cells are novel independent prognostic markers in prostate cancer and represent a target for therapy[J].Am J Pathol,2010,177(2):1031-1041.
[32] DE SOUZA D A JR,TOSO V D,CAMPOSM R,et al.Expression of mast cell proteases correlates with mast cell maturation and angiogenesis during tumor progression[J].PLoS One,2012,7(7):e40790.
[33] LEVI-SCHAFFER F,AUSTEN K F,GRAVALLESE P M,et al.Coculture of interleukin 3-dependent mouse mast cells with fibroblasts results in a phenotypic change of the mast cells[J].Proc Natl Acad Sci U SA,1986,83(17):6485-6488.
[34] GURISH M F,PEAR W S,STEVENSR L,et al.Tissue-regulated differentiation and maturation of a v-abl-immortalized mast cell-committed progenitor[J].Immunity,1995,3(2):175-186.
[35] RIBATTI D,CRIVELLATO E.The controversial role of mast cells in tumor growth[J].Int Rev Cell Mol Biol,2009,275:89-131.
[36] GRIMBALDESTON M A,FINLAY-JONES J J,HART P H.Mast cells in photodamaged skin:what is their role in skin cancer[J].Photochem Photobiol Sci,2006,5(2):177-183.
[37] SHIN K,WATTSG F,OETTGEN H C,et al.Mouse mast cell tryptase mMCP-6 is a critical link between adaptive and innate immunity in the chronic phase of Trichinella spiralis infection[J].J Immunol,2008,180(7):4885-4891.
[38] SIMSON L,ELLYARD JI,DENTL A,et al.Regulation of carcinogenesis by IL-5 and CCL11:a potential role for eosinophils in tumor immune surveillance[J].J Immunol,2007,178(7):4222-4229.
[39] SOMMERHOFF C P.Mast cell tryptases and airway remodeling[J].Am JRespir Crit Care Med,2001,164(10Pt2):S52-58.
[40] FIORUCCI L,ASCOLI F.Mast cell tryptase,a still enigmatic enzyme[J].Cell Mol Life Sci,2004,61(11):1278-1295.
- 激光生物学报的其它文章
- 去泛素化酶与肿瘤*
- 利用化学小分子实现人胚胎干细胞多能性状态的转化*

