去泛素化酶与肿瘤*
唐时珺,陈 松,叶 茂*
(1.湖南大学生物学院分子科学与分子医学实验室,湖南 长沙410082;2.湖南师范大学生命科学学院,湖南 长沙410006)
泛素是由76个氨基酸组成的球形热稳定蛋白。在真核细胞中,泛素的结构高度保守,蛋白质接受一些信号(如磷酸化、氧化、错误折叠、损伤等)能引发其泛素-蛋白酶体降解途径。泛素-蛋白酶体降解途径是指靶蛋白通过一系列的酶促反应被泛素链标记进而在蛋白酶体中降解,而泛素分子则可以被释放出来重复利用的过程。酶促反应包括三步:泛素激活酶E1激活游离的泛素分子并形成E1-泛素复合物;泛素结合酶E2催化E1-泛素复合物形成高能磷酸键相连的E2-泛素复合物;泛素连接酶E3识别靶蛋白并将泛素链连接到靶蛋白上,真核生物中还存在一些E2(如RAD6/UBC2等),不需要E3的参与就能直接识别靶蛋白并标记上泛素链[1]。近来研究表明,泛素化是一个可逆的过程,去泛素化酶能够水解泛素羧基末端的异肽键,将泛素分子特异性地从底物蛋白或者前体蛋白上水解下来,逆转泛素化过程。去泛素化酶的活性直接影响细胞内多种蛋白的周转率、活性、再生以及定位,在细胞内环境自稳态的维持、促进蛋白的稳定或降解以及细胞内的信号转导通路中起着极其重要的作用[2]。其蛋白结构的改变、异常的时空表达以及活性的失控都会引起多种疾病,如关节炎、神经退行性疾病、心血管疾病、肿瘤等。在人类肿瘤中,去泛素化酶可以作为癌基因或抑癌基因参与肿瘤的发生发展,以其作为分子靶标,通过药物干预其活性,抑制肿瘤的生长,已经成为目前开发新型抗肿瘤药物的热点。本文综述了近年来去泛素化酶在肿瘤领域的相关研究进展。
1 去泛素化酶家族
至今已发现去泛素化酶家族有99个成员,大部分都属于半胱氨酸蛋白酶。基于它们的氨基酸序列和分子结构的相似性,可将它们分为以下6个家族,各家族的成员统计如图1。
1.1 泛素蛋白羧基端水解酶家族(ubiquitin C-terminal hydrolase,UCHs)
UCH属于半胱氨酸蛋白酶,已发现人类基因编码的UCH有UCHL1、UCHL3、UCHL5/UCH37和BAP1(BRCA1 associated protein-1),它们作用的底物通常是一些小分子多肽。UCHs可以通过裂解C末端的氨基酸和酯键,将泛素分子从底物上释放出来。UCHs活性位点上的狭窄裂隙和环状结构直径的限制在一定程度上起到了特异性识别底物的功能,阻止了它对一些大分子泛素化蛋白的结合和催化[3]。
1.2 泛素蛋白特异性蛋白酶家族(ubiquitin-specific protease,USPs)
USPs亦属半胱氨酸蛋白酶,是目前已知包含成员最多(>50个)的去泛素化酶家族。该家族成员都含有一个高度保守的USP结构域,由3个亚结构域组成,类似于人右手的大拇指、手掌和手指。手掌和大拇指亚结构域之间形成催化活性中心,而手指亚结构域负责与泛素相互作用[4]。此外,许多USPs还有其它的结构域和末端延伸,对它们的活性和特异性也起着非常重要的作用,包括B-box结构域(CYLD)、锌 指USP结 构 域(USP3、USP5、USP39、USP44、USP45、USP49和USP51)、泛素相关结构域(USP5和USP13)、核酸外切酶III结构域(USP52)等。尽管USPs成员结构具有多样性,但是大多数USPs都具有共同的特征,即与泛素结合后引起构象改变,促进其由失活状态向催化活性状态的转变。
1.3 卵巢肿瘤(ovarian tumor)相关蛋白酶(the OTU-related protease,OTUs)
OTU结构域最初是通过生物信息学的方法在黑腹果蝇(Drosophila melanogaster)的卵巢肿瘤基因中被发现[5]。虽然OTU与其他已知的去泛素化酶没有序列同源性,但是它也有一个半胱氨酸蛋白酶位点,因此也具有去泛素化酶的活性。在人体内有16种OUT存在,从进化上可以分为四类:OTUs,Otubains(OTUBs),A20类似的OTUs以及OTULIN(ovarian tumor DUB with linear linkage specificity)[6]。OTU
家族成员对不同类型的多泛素链连接具有明显的识别特异性。OTUB1对识别K48(表示泛素蛋白第48号的赖氨酸)连接的多泛素链有高度的特异性,而OTUB2能剪切K63和K48连接的多泛素链[7,8]。A20和Cezanne分别特异性识别K48和K11连接的多泛素链,而TRABID既可以作用于K29也可以作用于K33连接的多泛素链,OTULIN能特异性水解M1连接的多泛素链[9]。OUT家族成员具有识别不同连接类型的多泛素链的特异性很可能是其识别底物的基础。
1.4 Machado-Joseph病蛋白酶(Machado-Joseph disease protein domain proteases,MJDs)
目前,该家族仅有四个成员:ATXN3(ataxin3)、ATXN3L、JOSD1和JOSD2。ATXN3可以作为多泛素链编辑酶调控蛋白折叠和稳定[10],而且它的泛素水解酶活性对于维持正常寿命必不可少[11]。此外,ATXN3L、JOSD1和JOSD2也具有去泛素化活性。所有成员都有由高度保守的一个半胱氨酸和两个组氨酸残基形成的催化三联体。除了Josephlin结构域,ATXN3和ATXN3L还有泛素相互作用基序,很可能介导蛋白多聚体中蛋白与泛素的相互作用[12]。
1.5 JAMM/MPN结构域相关的金属蛋白酶家族(JAMM/MPN domain-associated metallopeptidases,JAMMs)
JAMMs是去泛素化酶中唯一具有金属蛋白酶活性的家族。AMSH(associated molecule with SRC homology 3 domain of STAM)和AMSH-LP(AMSH-like protein)能特异性裂解K63连接的聚泛素链[13],而JAMM的其他成员对于K63连接的聚泛素链没有特异性,却有异肽酶(isopeptidase)活性,如POH1/PSMD14(26Sproteasome-associated PAD1 homolog 1)、MPND(MPN domain-containing protein)等[14]。
1.6 MCPIP(monocyte chemotactic protein-induced protein)
该家族是最近发现具有去泛素化酶活性的新家族。MCPIP有7个成员,MCPIP1~7。它的结构特点为:N端为泛素结合域,中间序列为CCCH-Zn指结构,C端富含多个脯氨酸。酶活性中心包含类似于其他去泛素化酶的半胱氨酸盒和天冬氨酸盒,但是没有组氨酸盒。MCPIP1能对TRAF-2(TNF receptor associated factor)、TRAF-3和TRAF-6去泛素化来负向调节JNK(c-Jun N-terminal kinase)的活性[15]。
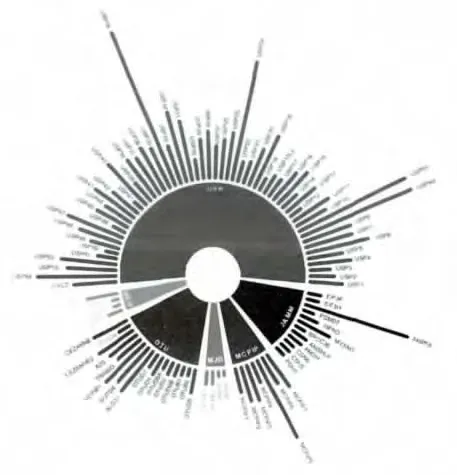
图1 去泛素化酶家族成员统计图Fig.1 The classification of human DUBs
2 去泛素化酶的作用机制
2.1 泛素前体的加工
真核细胞中有两种编码泛素的基因类型,第一类是多个泛素基因的重复序列,编码出来的是多个泛素首尾相连链;第二类是泛素与核糖体的融合基因,融合基因表达出单个泛素和核糖体的融合体。这两类基因的初表达产物都称为泛素前体蛋白(ubiquitin precursor)。UCHL1通过水解作用把第一类泛素前体蛋白分解成多个泛素单体,把第二类泛素前体蛋白分解成单个泛素及核糖体[16]。
2.2 泛素链的编辑
泛素分子中含有多个赖氨酸位点:Lys6(K6)、Lys11(K11)、Lys27(K27)、Lys29(K29)、Lys33(K33)、Lys48(K48)、Lys63(K63)。泛素链中相邻泛素之间大部分是通过赖氨酸残基来连接。因此泛素链中泛素的连接形式有很多种(可以是上面任意两种的搭配,K48和K63这两种类型混合居多,其中以两种及两种以上的赖氨酸位点相连接的泛素链称为异形链),分别传递不同的信息。去泛素化酶能够编辑和改变泛素链中泛素分子的连接形态,转变传达的信号,防止底物被降解。
2.3 底物降解的调节
在底物被泛素-蛋白酶体复合物降解之前,E3连接酶能起到增加底物上泛素分子的作用,因而也是一些去泛素化酶的靶蛋白。这些去泛素化酶通过对E3连接酶的修饰来改变或阻断E3连接酶的连接功能,因而阻止了底物与泛素链的连接,达到去泛素化的作用。p53是细胞中的抑癌蛋白,Mdm2是p53泛素化-蛋白酶体降解途径中的E3连接酶。去泛素化酶USP10分子能抑制Mdm2对p53和泛素链的连接作用,通过对p53进行去泛素化来增强p53的稳定性[17]。
2.4 底物活性的调节
去泛素化酶能直接水解底物上的单个泛素分子或聚泛素链,将底物从泛素连接中释放出来,底物的活性被激发。
2.5 泛素的循环利用
在连有异形泛素链的底物被蛋白酶体降解之前,去泛素化酶可以先将整个异形泛素链从底物上切掉,这条被切掉的泛素链再进一步被水解成单个泛素,以便循环利用。例如,Ubp6通过其氨基末端的一个类似于泛素分子的结构直接与蛋白酶体的19S调节亚基结合并引起构象改变,协助将进入蛋白酶体中的泛素化底物上的泛素分子分离再循环[18]。基因Ubp6缺失引起细胞内蛋白去泛素化及降解异常,并导致游离状态的泛素和靶蛋白的水平均降低。
2.6 去泛素化酶活性的调节
与去泛素化酶相连接的某些特异性蛋白能通过在底物上聚集去泛素化酶或调节去泛素化酶的去泛素化特性,起到激活去泛素化酶的作用,进而将底物去泛素化。如研究发现,26S蛋白酶体含有Rpn13结构域,此结构域可以富集一部分UCH37到26S蛋白酶体的表面[19]。UCH37因而被激活,分离泛素分子以便循环作用。
3 去泛素化酶在肿瘤中的功能作用
3.1 细胞周期调控
肿瘤是一类细胞周期性疾病,许多癌基因、抑癌基因直接参与细胞周期的调控,或者本身就是细胞周期调控机制的主要成分,它们的异常,常导致细胞周期的失控,使细胞获得以增殖过多、凋亡过少为主要形式的失控性生长特征。
近年来发现多种去泛素化酶参与细胞周期各时期的调控。USP37在被CDK2活化后,通过去泛素化cyclin,促进细胞分裂进入S期。去泛素化酶BAP1(BRCA1-associated protein-1)能与转录因子YY1(Yin Yang1)[20],HCF1(host cell factor1)[21]形成复合物共同调控HCF1/E2F应答的启动子,从而控制基因的转录,影响细胞从G1至S期的转变。去泛素化酶还可以通过影响核转录因子的稳定性来调控细胞周期。c-Myc是一个癌基因编码蛋白,能调控细胞生长、增殖及凋亡。c-Myc的泛素化依赖于E3连接酶SCFFbw7α(SKP1,CUL1,ROC1 and FBW7α),去泛素化酶USP28通过识别SCFFbw7α来与c-Myc结合,将其去泛素化,最终促进细胞增殖[22],而DNA损伤可以导致USP28与c-Myc解离,引起细胞周期停滞,因此,USP28功能上可以作为DNA损伤检查点的调控因子。去泛素化酶HAUSP(USP7)能特异性结合核转录因子p53,去泛素化并稳定p53蛋白,促进其靶标基因p21的表达,引起细胞周期的阻滞,从而抑制肿瘤细胞的生长[23]。
3.2 信号转导通路调控
在肿瘤发生发展过程中,细胞在信号转导网络上表现出与正常细胞的许多区别,一些与细胞生长、分裂和增殖有关的信号转导通路处于异常活跃的状态,一些在肿瘤细胞中本应处于活化状态的一些信号转导通路,如凋亡通路则往往传递信号受阻。目前研究表明,DUBs通过介导细胞内多条信号转导通路的调控,参与肿瘤的演进过程。
3.2.1 p53-Mdm2通路 到目前为止,USP2,USP4,USP5,USP7,USP10,USP29以及Otub1(Otubain1)都参与p53-Mdm2通路的调控。HAUSP/USP7能动态调控p53-MDM2通路,促进p53和MDM2的稳定。而USP2只能对MDM2去泛素化,间接调控p53[24]。OTUB1能抑制MDM2对p53的泛素化,稳定p53[25]。USP10虽然不与MDM2相互作用,但能稳定野生型和突变型p53[26]。在应激条件下,USP29能去泛素化并稳定p53[27]。最近研究还报道出USP4能去泛素化ARF-BP1(一种泛素连接酶),促进p53的降解[28]。
3.2.2 NF-κB通路 去泛素化酶CYLD(cylindromatosis)是USP家族中的一员,是NF-κB信号通路的负调控因子。A20(TNFAIP3)虽然属于去泛素化酶OTU家族,但其C端有一个促泛素连接的结构域,因此又能促进RIP的K48聚泛素化。当然,A20和CYLD的去泛素化酶活性区域能把IKKγ、TRAF-2及TRAF-6上K63连接的聚泛素化链去掉[29,30]。相似的,USP21与Cezanne都能通过调控RIPK1的泛素化水平来抑制NF-κB的转录活性[31,32]。最新研究发现STAMBPL1(me-talloprotease STAM-binding proteinlike1)是一种调节Tax介导NF-κB活性的正调控因子[33]。Otud7b(又 称Cezanne)能 通 过 去 泛 素 化TRAF-3阻 止 异 常 的 非 经 典NF-κB途 径 激 活[34]。OTULIN与CYLD以及LUBAC(linear ubiquitin chain assembly complex)形成复合物能抑制LUBAC介导的线性泛素化以及NF-κB的激活[35]。
3.2.3 RTKs通路 现今发现至少有4种去泛素化酶(USP8,USP18,AMSH,POH1)动态调控RTKs信号通路中的因子如EGFR,Met及ErbB2等。USP8能通过去泛素化RTKs以达到RTKs的循环利用[36]。AMSH能促进EGFR在溶酶体中的循环[37]。USP18则调控EGFR的合成及激活miR-7(microRNA-7)宿主基因的转录,从而有利于癌细胞的生长[38],而POH1能对EbrB2的泛素水平进行调控[39]。
3.2.4 Wnt通路 Wnt是胚胎发展期必需蛋白,在癌症中有高表达。去泛素化酶CYLD能去泛素化Dvl(Dishevelled),负调控Wnt信号通路[40]。相似的,USP4去泛素化T-Cell factor4(TCF4),USP15稳定APC(adenomatous polyposis coli),USP4和USP15都是Wnt信号通路的负调控因子[41,42]。而USP34则通过阻碍β-catenin转录,正调控Wnt信号通路[43]。
3.2.5 TGF-β通路 目前研究表明,五种去泛素化酶(USP4,USP15,USP9X,AMSH-LP,UCHL5)在TGF-β信号通路中都有重要作用。USP9X能对SMAD4(mothers against decapentaplegic homolog 4)去泛素化,USP9X的缺失会阻碍由TGF-β介导的神经细胞轴突形成[44]。USP15能去泛素化R-SMADs(receptor-activated SMADs)[45]。AMSH-LP和UCHL5能与SMAD的抑制蛋白I-SMADs相互作用来调控TGFβ应答[46,47]。USP4去泛素化TβR1(TGF-βtype1 receptor),因而是TGF-β信号通路的诱导物[48]。
3.3 DNA损伤修复与染色质的修饰
肿瘤发生与DNA损伤修复机制密切相关。USP1能调控增殖细胞中的核抗原泛素化水平,还能与U2AF1(U2 small nuclear ribonucleoparticle auxiliary factor1)形成复合物通过同源重组促进双链DNA损伤修复[49]。BRCC36、USP3、USP16、OTUB1和USP44能对参与DNA双链损伤修复的泛素连接酶RNF8/RNF168(ring finger protein 8/168)进 行 调 控[50,51]。USP7、USP21、USP22以及MYSM1(myb-like,SWIRM and MPN domains 1)能和组蛋白(主要是H2A和H2B)相 互 作 用 来 调 节 染 色 质 的 动 态 结 构[52,53]。UCHL5能与蛋白酶体联合调控染色质的修饰复合物lno80[54]。
4 总结和展望
去泛素化酶的种类较多,结构多样,功能复杂,作为蛋白泛素化的关键性调控因子,直接影响细胞内多种蛋白的周转率、活性、再生以及定位,并且与肿瘤的发生与演进密切相关。随着最近靶向泛素-蛋白酶体用于临床治疗的成功,去泛素化酶已经成为非常有希望的抗肿瘤分子靶标。到目前为止,已经成功筛选出一批特异性靶向去泛素化酶的小分子化合物如P5091、HBX19818、HBX28258等。进一步深入的理解去泛素化酶的催化活性、调控机制以及底物识别的特异性,将有助于靶向去泛素化酶的策略真正应用于临床抗肿瘤治疗。
[1] MCDONOUGH M,SANGAN P,GONDA D K.Characterization of novel yeast RAD6(UBC2)ubiq uitin-conjugating enzyme mutants constructed by charge-to-Alanine scanning mutagenesis[J].Journal of Bacteriology,1995,177(3):580-585.
[2] ATANASSOV B S,KOUTELOU E,DENT S Y.The role of deubiquitinating enzymes in chromatin regulation[J].FEBS Lett,2011,585(13):2016-2023.
[3] JOHNSTON SC,RIDDLE SM,COHEN R E,et al.Structural basis for the specificity of ubiquitin C-terminal hydrolases[J].EMBO J,2000,18(14):3877-3887.
[4] HU M,LI P,LI M,et al.Crystal structure of a UBP-family deubiquitinating enzyme in isolation and in complex with ubiquitin aldehyde[J].Cell,2002,111(7):1041-1054.
[5] MAKAROVA K S,ARAVIND L,KOONIN E V.A novel superfamily of predicted cysteine proteases from eukaryotes,viruses and Chlamydia pneumoniae[J].Trends in Biochemical Sciences,2000,25(2):50-52.
[6] TYCHO E T M,MANUELA K H,PAUL P G,et al.OTU deubiquitinases reveal mechanisms of linkage specificity and enable ubiquitin chain restriction analysis[J].Cell,2013,154:169-184.
[7] T Wang,L YIN,E M COOPER,et al.Evidence for bidentate substrate binding as the basis for the K48 linkage specificity of otubain 1[J].Journal of Molecular Biology.2009,386:1011-1023.
[8] M JEDELMANN,A LPHOFER,M AKUTSU,et al.Structural basis and specificity of human otubain 1-mediated deubiquitination[J].Biochemical Journal,2009,418:379-390.
[9] KEUSEKOTTEN K,et al.OTULIN antagonizes LUBAC signaling by specifically hydrolyzing Met1-Linked polyubiquitin[J].Cell,2013,153(6):1312-1326.
[10] Y MAO,F SENIC-MATUGLIA,P P DI FIORE,et al.Deubiquitinating function of ataxin-3:insights from the solution structure of the Josephin domain[J].Proceedings of the National Academy of Sciences of the USA,2005,102:12700-12705.
[11] K KUHLBRODT,P C JANIESCH,E KEVEI,et al.The Machado-Joseph disease deubiquitylase ATX-3 couples longevity and proteostasis[J].Nature Cell Biology,2011,13:273-281.
[12] B BURNETT,F LI,R N Pittman.The polyglutamine neurodegenerative protein ataxin-3 binds polyubiquitylated proteins and has ubiquitin protease activity[J].Human Molecular Genetics,2003,12:3195-3205.
[13] SATO Y,YOSHIKAWA A,YAMAGATA A,et al.Structural basis for specific cleavage of Lys63-linked polyubiquitin chains[J].Nature,2008,455:358-362.
[14] J M FRAILE,V QUESADA,D RODRIGUEZ,et al.Deubiquitinase in cancer:new functions and therapeutic options[J].Oncogene,2012,31:2373-2388.
[15] JIAN LIANG,YASSER SAAD,TIANHUA LEI,et al.MCPinduced protein 1 deubiquitinates TRAF proteins and negatively regulates JNK and NF-κB signaling[J].The Journal of Experimental Medicine,2010,207(13):2959-2973.
[16] 孙晋华,程汉华,周荣家.泛素C末端水解酶L1的生理和病理学意义[J].生物化学与生物物理进展,2007,34(8):800-805.SUN Jinhua,CHEN Hanhua,ZHOU Rongjia.The physiological and pathological significance of Ubiquitin C-terminal hydrolase L1(UCHL1)[J].Progress in Biochemistry and Biophysics,2007,34(8):800-805.
[17] JIAN YUAN,KUNTIAN LUO,LIZHI ZHANG,et al.USP10 regulates p53 localization and stability by deubiquitinating p53[J].Cell,2010,140:384-396.
[18]DAVID S LEGGETT,JOHN HANNA,ANNA BORODOVSKY,et al.Multiple associated proteins regulate proteasome structure and function[J].Molecular Cell,2002,10(3):495-507.
[19] SCHREINER P,CHEN X,HUSNJAK K,et al.Ubiquitin docking at the proteasome through a novel pleckstrin-homology domain interaction[J].Nature,2008,453(7194):548-552.
[20] YU H,MASHTALIR N,DAOU S,et al.The ubiquitin carboxyl hydrolase BAP1 forms a ternary complex with YY1 and HCF-1 and is a critical regulator of gene expression[J].Molecular Cell Biology,2010,30(21):5071-5085.
[21] ELETR Z M,WILKINSON K D.An emerging model for BAP1’s role in regulating cell cycle progression[J].Cell Biochemistry Biophysics,2011,60(1-2):3-11.
[22]NIKITA POPOV,MICHAEL WANZEL,MANDY MADIREDJO,et al.The ubiquitin-specific protease USP28 is required for MYC stability[J].Nature Cell Biology,2007,9:765-774.
[23] MUYANG L I,CHRISTOPHER L BROOKS,NING KON,et al.A dynamic role of HAUSP in the p53-Mdm2 Pathway[J].Molecular Cell,2004,13:879-886.
[24] STEVENSON L F,SPARKS A,ALLENDE-VEGA N,et al.The deubiquitinating enzyme USP2a regulates the p53 pathway by targeting Mdm2[J].European Molecular Biology Organization Journal,2007,26:976-986.
[25] XIAO XIN SUN,KISHORE B CHALLAQUNDLA,MU-SHUI DAI.Positive regulation of p53 stability and activity by the deubiquitinating enzyme Otubain1[J].European Molecular Biology Organization Journal,2012,31(3):576-592.
[26] YUAN J,LUO K,ZHANG L,et al.USP10 regulates p53 localization and stability by deubiquitinating p53[J].Cell,2010,140:384-396.
[27] LIU J,CHUNG H J,VOGT M,et al.JTV1 co-activates FBP to induce USP29 transcription and stabilize p53 in response to oxidative stress[J].European Molecular Biology Organization Journal,2011,30:846-858.
[28] ZHANG X,BERGER F G,YANG J,et al.USP4 inhibits p53 through deubiquitinating and stabilizing ARF-BP1[J].European Molecular Biology Organization Journal,2011,30:2177-2189.
[29] ANDREW KOVALENKO,CHRISTINE CHABLE-BESSIA,GIUSEPPINA CANTARELLA,et al.The tumour suppressor CYLD negatively regulates NF-κB signaling by deubiquitination[J].Nature,2003,424:801-805.
[30] INGRID E WERTZ,KAREN M O’ROURKE,HONGLIN ZHOU,et al.Deubiquitination and ubiquitin ligase domains of A20 downregulate NF-κB signaling[J].Nature,2004,430:694-699.
[31] XU G,TAN X,WANG H,et al.Ubiquitin-specific peptidase 21 inhibits tumor necrosis factor alpha-induced nuclear factor kappaB activation via binding and deubiquitinating receptor-interacting protein1[J].The Journal of Biological Chemistry,2010,285:969-978.
[32] ENESA K,ZAKKAR M,CHAUDHURY H,et al.NF-κB suppression by the deubiquitinating enzyme Cezanne:a novel negative feedback loop in proinflammatory signaling[J].The Journal of Biological Chemistry,2008,283:7036-7045.
[33] LAVORGNA A,HARHAJ E W.An RNA interference screen identifier the Deubiquitinase STAMB-PL1 an a critical regulator of human T-cell leukemia virus type1 tax nuclear export and NF-κB activation[J].Journal of Virology,2012,86(6):3357-3369.
[34]HONGBO HU,GEORGE CBRITTAIN,JAE-HOON CHANG,et al.Otud7b controls noncanonical NF-κB active-tion via deubiquitination of TRAF3[J].Nature,2013,494(7437):371-374.
[35] TAKIUCHI T,NAKAGAWA T,TAMIYA H,et al.Suppression of LUBAC-mediated linear ubiquitination by a specific interaction between LUBAC and the deubiquitinases CYLD and OTULIN[J].Genes to Cells,2014.19(3):254-272.
[36] NIENDORF S,OKSCHE A,KISSER A,et al.Essential role of ubiquitin-specific protease 8 for receptor tyrosine kinase stability and endocytic trafficking in vivo[J].Molecular Cell Biology,2007,27:5029-5039.
[37] MCCULLOUGH J,CLAGUE M J,URBE S.AMSH is an endosome-associated ubiquitin isopeptidase[J].The Journal of Cell Biology,2004,166:487-492.
[38] DUEX J E,COMEAU L,SORKIN A,et al.USP18 regulates EGF receptor expression and cancer cell survival via microrna-7[J].The Journal of Biological Chemistry,2011,286:25377-25386.
[39] LIU H,BUUS R,CLAGUE M J,et al.Regulation of ErbB2 receptor status by the proteasomal DUB POH1[J].Public Library of Science One,2009,4(5):e5544.
[40] TAURIELLO D V,HAEGEBARTH A,KUPER I,et al.Loss of the tumor suppressor CYLD enhances Wnt/beta-catenin signaling through K63-linked ubiquitination of Dvl[J].Molecular Cell,2010,37(5):607-619.
[41] ZHAO B,SCHLESIGER C,MASUCCI M G,et al.The ubiquitin specific protease 4(USP4)is a new player in the Wnt signaling pathway[J].Journal of Cell Molecular Medicine,2009,13:1886-1895.
[42] HUANGX,LANGELOTZ C,HETFELD-PECHOCB K,et al.The COP9 signalosome mediates beta-catenin degradation by deneddylation and blocks adenomatous polyposis coli destruction via USP15[J].Journal of Molecular Biology,2009,391:691-702.
[38] LUI T T,LACROIX C,AHMED S M,et al.The ubiquitinspecific protease USP34 regulates axin stability and Wnt/{beta}-catenin signaling[J].Molecular Cell Biology,2011,31:2053-2065.
[43] STEGEMAN S,JOLLY L A,PREMARATHNE S,et al.Loss of Usp9x disrupts cortical architecture,hippocampal development and TGFβ-Mediated axonogenesis[J].Public Library of Science One,2013,8(7):e68287.
[44] INUI M,MANFRIN A,MAMIDIA,et al.USP15 is a deubiquitylating enzyme for receptor-activated SMADs[J].Nature Cell Biology,2011,13(11):1368-1375.
[45] IBARROLA N,KRATCHMAROVA I,NAKAJIMA D,et al.Cloning of a novel signaling molecule,AMSH-2,that potentiates transforming growth factor beta signaling[J].Business-Medium-Consumer Cell Biolgogy,2004,5:2.
[46] WICKSSJ,HAROSK,MAILLARD M,et al.The deubiquitinating enzyme UCH37 interacts with Smads and regulates TGFbeta signaling[J].Oncogene,2005,24:8080-8084.
[47]LONG ZHANG,FANGFANG ZHOU,YVETTE DRABSCH,et al.USP4 is regulated by AKT phosphorylation and directly deubiquitylates TGF-βtype 1 receptor[J].Nature Cell Biology,2012,14:717-726.
[48] MURAI J,YANG K,DEJSUPHONG D,et al.The USP1/UAF1 complex promotes double-strand break repair through homologous recombination[J].Molecular Cell Biology,2011,31:2462-2469.
[49] AL-HAKIM A,ESCRIBANO-DIAZ C,LANDRY M C,et al.The ubiquitous role of ubiquitin in the DNA damage response[J].DNA Repair(Amst),2010,9(42):1229-1240.
[50] MOSBECH A,LUKAS C,BEKKER-JENSEN S,et al.The deubiquitylating enzyme USP44 counteracts the DNA doublestrand break response mediated by the RNF8 and RNF168 ubiquitin ligases[J].Journal of Biology Chemistry,2013,288(23):16579-16587.
[51] MICHAEL J CLAGUE,JUDY M COULSON,SYLVIE URBE.Deciphering histone 2A deubiquitination[J].Genome Biology,2008,9(1):202.
[52]ERIC JBENNETT,MATHEW E SOWA,JWADE HARPER.Cellular regulation by deubiquitinating enzymes[J].Nature Molecular Cell Biology,2010,poster.
[53] GOEDELE N MAERTENS,SELMA E I MESSAOUDI-AUBERT,SARAH ELDERKIN,et al.Ubiquitin-specific proteases7 and 11 modulate polycomb regulation of the INK4a tumor suppressor[J].European Molecular Biology Organiztion Journal,2010,29:2553-2565.
[54] TINGTING YAO,LING SONG,JINGJI JIN,et al.Distinct modes of regulation of the Uch37 deubiquitinating enzyme in the proteasome and in the Ino80 chromatin-remodeling complex[J].Molecular Cell,2008,31:909-917.

