利用化学小分子实现人胚胎干细胞多能性状态的转化*
欧阳琦,杨青青,周晓樱,林 戈,卢光琇,胡维新
(中南大学 a.生命科学学院;b.生殖与干细胞研究所,湖南 长沙410078)
小鼠胚胎干细胞依据其来源的发育阶段以及细胞的生物学特性可分为两类:一类是传统意义上的胚胎干细胞(mouse embryonic stem cells,mESCs),来源于植入前囊胚的内细胞团,处于原始多能性状态(naive)[1];一类是上胚层干细胞(mouse epiblast stem cells,mEpiSCs),来源于植入后胚胎的上胚层,处于始发态的多能性状态(Primed)[2]。这两类小鼠多能性干细胞从克隆形态、分化能力、维持自我更新的信号通路、表观遗传学特征以及单细胞生长能力等方面都存在明显不同。mESCs克隆形态紧密,呈鸟巢状隆起,三维生长;依赖LIF/stat3信号通路的活化来维持不分化状态;雌性mESCs具有两条活化的X染色体;能够耐受酶消化进行单细胞传代,有利于基因定点改造和筛选。而mEpiSCs培养时克隆形态扁平,二维生长;其不分化状态的维持依赖bFGF和Activin A/Nodal信号通路;雌性mEpiSCs通常失活一条X染色体;单细胞传代效率低,难以进行基因定点改造操作。此外,mESCs具有更为完整的多能性,将mESCs注射到宿主囊胚腔内能够整合并参与后者的发育过程,形成嵌合体小鼠,并能分化为生殖细胞而实现生殖系的传递。而mEpiSCs只具备部分多能性,虽然能够向三个胚层的细胞分化,但不具有形成嵌合胚胎的能力,也基本无法实现生殖系的传递。以往常规“bFGF+Activin A”培养体系下分离的人胚胎干细胞(human ESCs,hESCs)在生物学特性上更接近于mEpiSCs,即处于始发态多能性[3,4]。因此,单细胞传代效率低以及嵌合能力低等特性将在一定程度上限制了hESCs在基础和临床研究领域更广泛的应用。
从2007年开始,人们尝试各种方法建立naive的hESCs。Hanna等[5]过表达多能性基因将现有的hESCs逆转至原始多能性状态,但是细胞不稳定,撤除外源性基因的表达,细胞将失去原始态的表型,回复到始发态。Beucker课题组[6]利用在LIF条件下过表达5个重编程基因获得了原始态的人诱导性多能干细胞,但是这类干细胞不能启动内源性多能性关键基因的表达,分化能力受损。转入外源性基因的方法只能获得亚稳态的原始多能性干细胞,且具有安全性隐患,因此建立一种无需转基因操作、仅通过改变培养条件获得原始态hESCs的方法是亟待解决的重要问题。目前国外有研究组利用不同的化学小分子和生长因子组合实现了hESCs多能性的转化,这些化学小分子组合通过激活或者抑制发育过程中不同的关键信号通路,使逆转后的hESCs具有部分原始态多能性特征,但是逆转后的hESCs之间存在明显的基因表达差异[7-10]。而建立原始态hESCs的研究在国内尚未见报道。
本实验利用已经建立的hESCs资源,综合并改良文献报道的原始多能性干细胞培养条件,利用化学小分子对已建系的hESCs进行多能性转化,并评估了转化后hESCs的原始多能性特征。
1 材料与方法
1.1 试剂
1.1.1 人胚胎干细胞系 chHES-278为本实验室自主建系,核型为46,XX;已进行相应干细胞特征性鉴定,符合NIH对胚胎干细胞的鉴定标准。
1.1.2 小鼠胚胎成纤维细胞(MEF)从CF1小鼠第12.5天胚胎中分离获得,经丝裂霉素有丝分裂灭活后,作为hESCs的饲养层细胞。
1.1.3 培养基及配制 始发态hESCs培养基(DFES):基础培养基DMEM/F12,15%血清替代物,0.1 mmol/Lβ-ME,2 mmol/L L-Glu,4 ng/mL bFGF,1%非必需氨基酸。
拟胚体(EB)培养基:即始发态hESCs培养基不添加bFGF。
2i(ERK1/2抑制剂及GSK3β抑制剂)培养基:基础培养基DMEM/F12和Neurobasal,1%N2,2%B27,0.1 mmol/Lβ-ME,2 mmol/L L-Glu,3μmol/L CHIR99021(GSK3βi,Stemgent公 司),1μmol/L PD0325901(ERK1/2i,Tocris公司),1 000 U/L LIF(Millipore公司)。
原始态hESCs培养基(NHSM):基础培养基DMEM/F12,2 g/L AlbuMAX,1%N2,1%非必需氨基酸,0.1 mmol/Lβ-ME,1 mmol/L L-Glu,12.5 mg/mL insulin(sigma公司),8 ng/mL bFGF,1 ng/mL TGF-β1(Peprotech公 司),3μmol/L CHIR99021(GSK3βi,Stemgent公司),0.5μmol/L PD0325901(ERK1/2i,Tocris公司),10μmol/L SP600125(JNKi,Tocris公司),5μmol/L SB202190(p38i,Axon Medchem公司),5μmol/L Go6983(PKCi,Tocris公司),5μmol/L Y-27632(ROCKi,Millipore公 司),1 000 U/L LIF(Millipore公司)。
1.2 胚胎干细胞培养
以小鼠胚胎成纤维细胞为饲养层细胞,分别采用hESCs培养基、2i培养基和NHSM培养基。机械或者酶消化传代,置于37℃,5%CO2培养箱中,每5-7天传代一次。
1.3 hESCs的相关检测
1.3.1 碱性磷酸酶(AKP)的检测 采用Zymed Laboratories Inc公司提供的试剂盒对未分化的hESCs克隆进行检测,操作步骤按试剂盒说明进行,阳性染色结果为紫色。周边的MEF不着色,为阴性对照。
1.3.2 细胞特异抗原的检测 多能性干细胞特异性抗原,包括:TRA-1-60、TRA-1-81、OCT-4;三胚层特异性标记,包括:AFP(内胚层)、β-tubulin(外胚层)、SMA(中胚层);其他抗体:H3K27me3、E-cadherin。均采用间接免疫荧光法来检测,步骤如下:4%的多聚甲醛固定20 min;0.1%Triton-X-100透膜10 min(针对核内抗原,胞膜抗原不需要透膜);正常驴血清室温封闭30 min;一抗4℃孵育过夜;加入Alexa Flour 488-连接二抗,室温避光孵育1 h;DAPI复染核;荧光显微镜下观察检测结果并照相。
1.3.3 多能性相关基因的检测 收集未分化的hESCs,用Trizol抽提总RNA,用Roche公司提供的逆转录试剂盒将1μg RNA反转录为cDNA,再以cDNA为模板进行Real-time PCR分析,以检测其中多能性相关基因的表达,28S为反应体系阳性对照。Realtime PCR反应条件:95℃5 min;45个循环(95℃10 s,58℃10 s,72℃15 s)。
1.3.4 单克隆形成率实验 未分化的hESCs经胰酶消化成单细胞后计数,按照200个细胞/10 cm培养皿的密度种植,根据消化前hESCs的培养条件分别采用原始态或者始发态hESCs培养基进行培养,6天后计数克隆数目,克隆数目与接种细胞数目之比即为单克隆形成率,每组实验重复3次。
2 实验结果
2.1 hESCs无法在2i体系下长期培养
mESCs既可以在LIF+2i体系下成功分离建系,也可以长期稳定培养。但是将已建立的具有始发态多能性特征的hESCs转至2i体系不能保持未分化状态,难以传代培养,往往3代之内即完全分化,AKP染色呈阴性(图1)。
2.2 2i联合JNKi、P38i可以获得类mESCs的原始态hESCs
在2i体系中进一步添加JNK抑制剂(SP600125)、p38抑制剂(SB202190)并联合生长因子bFGF、TGFβ,可以获得形态上类似mESCs的hESCs,细胞形态表现为紧密、圆形、隆起的克隆。培养过程中,hESCs克隆周边始终有少量分化细胞,将ERKi(PD0325901)的浓度从1μmol/L降低至0.5μmol/L,则细胞基本无分化。(图2)
2.3 转化后的hESCs具有naive多能性特征
将NHSM培养体系下培养的hESCs进行多能性特征性鉴定,结果提示转化后的hESCs具有原始多能性的特征。始发态培养体系的hESCs进行H3K27me3染色,细胞内有凝集点,说明一条X染色体失活,转移至naive体系下培养,H3K27me3凝集点消失,说明X染色体重新活化,再将转化后的hESCs形成EB自发分化后,H3K27me3凝集点再次出现,说明X染色体又重新启动失活。将两种体系下的hESCs进行Xist基因表达的对比分析,结果也提示后者的Xist表达水平明显偏低,与H3K27me3染色结果吻合。DNA甲基转移酶(DNMT)主要参与基因组从头甲基化,在哺乳动物的基因印记和X染色体失活的调节中起关键作用,与始发态培养体系相比,naive培养体系下hESCs的DNMT3A和DNMT3B表达水平明显升高。此外,转化后的hESCs单克隆形成率明显增高。始发态hESCs单克隆形成率约3%,添加具有抗凋亡作用的ROCKi,单克隆形成率提高到19%;转化的hESCs单克隆形成率为38%,添加ROCKi后,单克隆形成率上升到75.6%,明显高于始发态hESCs。(图3)

图1 2i体系和bFGF体系下hESCs培养的形态变化及AKP染色情况Fig.1 The morphologic change and AKP staining of hESCs cultured in the culture system containing 2i or bFGF
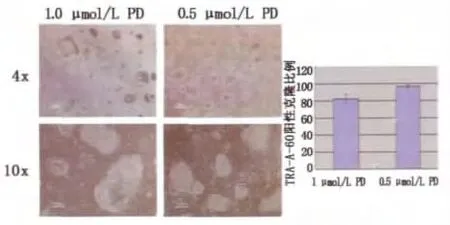
图2 原始态hESCs培养体系中不同ERKi浓度培养下的hESCs形态图Fig.2 The morphologic change of hESCs cultured in the naive ESCs culture system containing ERKi with different concentration.
2.4 转化后的hESCs不具备mESCs多能性基因表达模式
将NHSM体系转化后的hESCs与转化前的hESCs进行多能性基因的表达对比分析,除LIMCH1和TBX3以外,mEpiSCs中明确高表达的多能性基因OTX2以及mESCs高表达的多能性相关基因KLF4、PRDM14、REX1等在两者之间均无明显差别,ESRRB、FGF5、FOXA2不表达(图4)。
3 讨论
小鼠上胚层干细胞(mEpiSCs)的成功分离使人们意识到胚胎干细胞由于组织来源不同而具有不同的多能性状态,早期原始多能性阶段主要指植入前囊胚内细胞团,以mESCs为代表,晚期始发态多能性阶段主要指植入后胚胎的上胚层,以mEpiSCs和既往bFGF体系下培养的hESCs为代表。这两类多能性干细胞在生物学特性上存在明显不同,因此在应用前景上也有明显差别。mESCs具有更广泛的发育潜能,能够整合到宿主胚胎参与各器官组织的发育,形成嵌合体,因此可以用于制备转基因动物或者在宿主体内形成完全由供者细胞来源的器官,能够生殖系传递,在未来器官组织工程方面具有很大的发展前景。mEpiSCs和hESCs的发育潜能被进一步限定,虽然能够向三个胚层各种组织细胞分化,但是不能整合到宿主胚胎形成嵌合体,且不具备生殖系传递的能力,因此在器官组织工程方面用途受限。而转基因往往需要进行克隆筛选,mESCs能够耐受单细胞传代,是目前研究基因功能最常用的的哺乳动物,而mEpiSCs和hESCs在胰酶处理后单克隆形成能力很差,很大程度上限制了hESCs的基因操作。
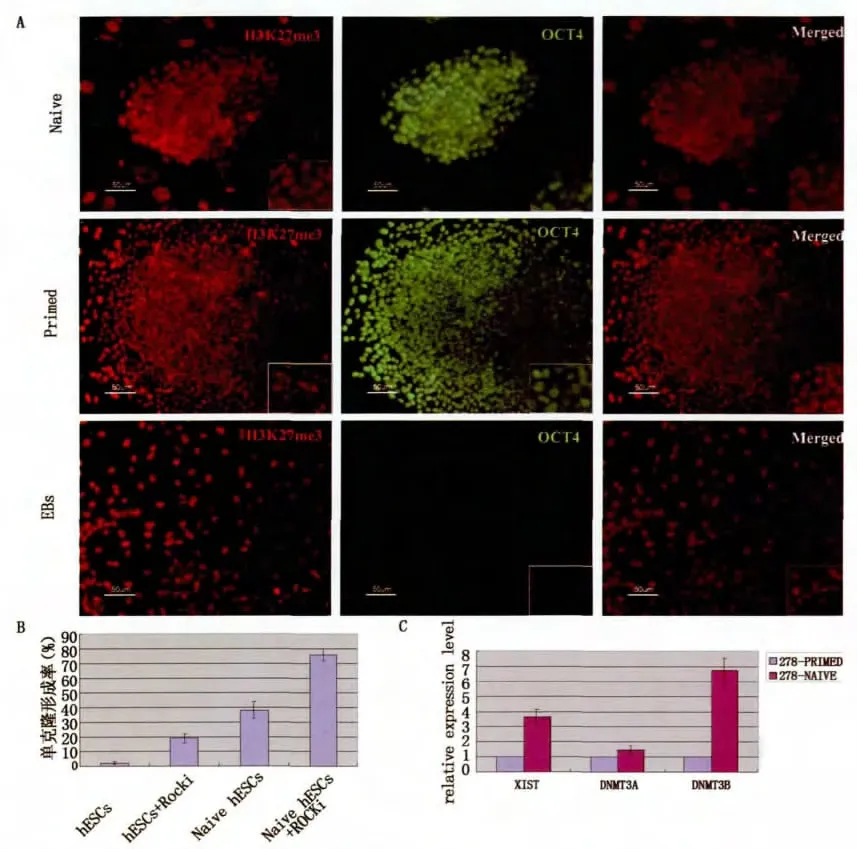
图3 NHSM培养条件下的hESCs表达原始态多能性的生物学特性Fig.3 naive Characteristics of transformed hESCs cultured in NHSM media
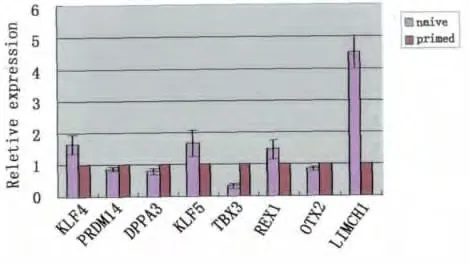
图4 转化后原始态与始发态hESCs多能性基因表达的对比分析Fig.4 The expression analysis of pluripotency-related gene between naive and primed hESCs
意识到胚胎源性干细胞具有两种不同的多能性状态,人们开始寻找建立naive状态hESCs的方法。2008年以前,mESCs依赖LIF+BMP4体系来维持自我更新,2008年,Ying创建了2i体系,ERK1/2i能够抑制mESCs自身分泌的FGF4,而GSK3βi能够活化Wnt信号通路,均可以加强mESCs的自我更新能力,能够更好地维持原始多能性状态[11]。许多在LIF+BMP体系下难以建系的物种都能够通过2i体系建立原始多能性干细胞[12-15]。本研究将始发态的hESCs转入2i体系中培养,细胞很快分化,说明2i不足以抗衡人类原始多能性状态维持所需要克服的内因障碍。Hanna等借助外源性基因(例如:Oct4、Klf2、Klf4)的导入,帮助hESCs在2i体系中获得原始多能性,但是这种逆转不稳定,撤除外源性基因的表达,细胞将迅速回复到始发态多能性水平[5]。Buecker等过表达5个重编程因子虽然能够获得原始多能性的人诱导性多能干细胞(hiPSCs),但这类细胞以牺牲多能性为代价,细胞的分化能力受损[6]。上述研究证明转入外源性基因的方法只能获得亚稳态的原始多能性干细胞,且具有安全性隐患。如果能够不依赖基因操作,仅通过改变培养条件就实现干细胞系多能性状态的转化,则有益于推动这类干细胞在再生医学中的应用。2013年12月,Gafni[7]和Chan[8]两个课题组分别报道利用培养条件实现了hESCs的多能性状态转化,其培养体系能将现有的多能性干细胞从primed状态逆转到naive状态。2014年3月,Ware等利用2i+bFGF也获得了具有原始多能性特征的hESCs,但是该方法并且依赖bFGF,撤除bFGF后细胞培养过程中始终存在背景分化[10]。这些研究组所采用的naive hESCs培养条件不尽相同,通过分析利用这些不同培养体系获得的“naive”多能性干细胞的基因表达谱,结果提示它们之间基因表达存在明显差异,并且部分mESCs高表达的原始多能性相关基因在转化后的hESCs中无明显差别。我们参考并改良了naive hESCs培养体系,也获得了具有原始多能性特征的hESCs,细胞重新获得两条活化的X染色体,单克隆形成率明显增高,DNA甲基转移酶活性增高等。但与mESCs比较,多能性基因表达模式也不尽相同,因此这些具有naive特征的hESCs是否为真正意义上的原始多能性干细胞还有待考证,而上述培养条件中哪些是naive多能性维持的关键因素、它们发挥作用的分子机制以及不同培养体系造成的基因表达差别是否影响其生物学功能和安全性等问题还需要进一步研究。
目前的研究结果表明人类原始态和始发态这两种多能性状态维持的分子机制存在差异,与已知小鼠相应多能性状态维持的分子机制也不尽相同。如果能更好地认识上述问题,不仅可以帮助我们了解人类早期胚胎发育规律、多能性状态建立的过程和分子机制,还能够帮助我们建立原始多能性的hESCs,拓展hESCs在再生医学以及遗传性疾病机理研究上的应用。
[1] EVANS J,KAUFMAN H.Establishment in culture of pluripotential cells from mouse embryos[J].Nature,1981,(5819)292:154-156.
[2] BRONSG,SMITHERS E,TROTTER W,et al.Derivation of pluripotent epiblast stem cells from mammalian embryos[J].Nature,2007,448(7150):191-195.
[3] GINISI,LUO Y,MIURA T,et al.Differences between human and mouse embryonic stem cells[J].Developmental Biology,2004,269(2):360-380.
[4] KOESTENBAUER S,ZECH H,JUCH H,et al.Embryonic stem cells:similarities and differences between human and murine embryonic stem cells[J].American Journal of Reproductive Immunology,2006,55(3):169-180.
[5] HANNA J,CHENG W,SAHA K,et al.Human embryonic stem cells with biological and epigenetic characteristics similar to those of mouse ESCs[J].Proc Natl Acad Sci,USA 2010,107(20):9222-9227.
[6] BUECHER C,CHEN H,POLO M,et al.A murine ESC-like state facilitates transgenesis and homologous recombination in human pluripotent stem cells[J].Cell Stem Cell,2010,6(6):535-546.
[7] GAFNI O,WEINBERGER L,MANSOUR A,et al.Derivation of novel human ground state naive pluripotent stem cells[J].Nature,2013,504(7479):282-286.
[8] CHAN S,GOKE J,NG H,et al.Induction of a human pluripotent state with distinct regulatory circuitry that resembles preimplantation epiblast[J].Cell Stem Cell,2013,13(6):663-675.
[9] XU Y,ZHU X,HAHM S,et al.Revealing a core signaling regulatory mechanism for pluripotent stem cell survival and self-renewal by small molecules[J].Proc Natl Acad Sci USA,2010,107(18):8129-8134.
[10] WARE B,NELSON A,MECHAM B,et al.Derivation of naive human embryonic stem cells[J].Proc Natl Acad Sci USA,2014,111(12):4484-4489.
[11] YING L,WRAY J,NICHOLS J,et al.The ground state of embryonic stem cell self-renewal[J].Nature,2008,453(7194):519-523.
[12] NICHOLSJ,JONES K,PHILLIPS M,et al.Validated germline-competent embryonic stem cell lines from nonobese diabetic mice[J].Nature Medicine,2009,15(7):814-818.
[13] HANNA J,MARKOULAKI S,MITALIPOVA M,et al.Metastable pluripotent states in NOD mouse derived ESCs[J].Cell Stem Cell,2009,(6):513-524.
[14] BUEHR M,MEEK S,BLAIR K,et al.Capture of authentic embryonic stem cells from rat blastocysts[J].Cell,2008,135(7):1287-1298.
[15] LI P,TONG C,MEHRIAN-SHAI R,et al.Germline competent embryonic stem cells derived from rat blastocysts[J].Cell,2008,135(7):1299-1310.
- 激光生物学报的其它文章
- 去泛素化酶与肿瘤*
- 流式细胞仪分析癌细胞对肥大细胞募集的影响*

