内质网应激参与介导脂多糖诱导的大鼠肝细胞凋亡
季英磊,闫骏,王艳莎,刘夷嫦,谷振勇
(南通大学医学院法医学系,江苏南通226001)
在法医学实践中,创伤应激诱导的急性肝损伤是创伤性多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)发病的早期重要环节[1]。多种肝病的发生与内质网应激介导的细胞凋亡有关[2],创伤应激引起肠黏膜屏障功能异常、肠道细菌移位、内毒素入血是导致急性肝损伤的关键发病途径[3]。本研究应用脂多糖(lipopolysaccharide,LPS),内质网应激诱导剂毒胡萝卜素(thapsigargin,TG)[4]、内质网应激抑制剂4-苯基丁酸(4-phenylbutyric acid,4-PBA)[5]处理肝细胞,观察肝细胞活力及凋亡变化并检测内质网应激标志性蛋白和内质网应激相关的凋亡蛋白表达变化,初步探讨内质网应激在LPS诱导肝细胞凋亡中的作用,为探索创伤性MODS急性肝损伤的相关机制提供实验依据。
1 材料与方法
1.1 主要试剂和仪器
LPS、TG、4-PBA、二甲基亚砜(dmethyl sulfoxide,DMSO)、ECL荧光检测试剂盒(美国Sigma公司),RPMI 1640培养基、胰蛋白酶、青霉素、链霉素(美国Invitrogen公司),胎牛血清(美国Thermo Scientific公司),细胞裂解液(美国Fermentas Life Sciences公司),MTT细胞增殖及细胞毒性检测试剂盒、Hoechst染色试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒(南京建成生物工程研究所),GRP78、CHOP、caspase-12兔多克隆抗体、激活型caspase-3(c-caspase-3)小鼠单克隆抗体,辣根过氧化物酶(horse radish peroxidase,HRP)标记的抗小鼠,抗兔IgG(美国Santa Cruz公司),β-tubulin小鼠单克隆抗体(美国Cell Signaling Technology公司),其他试剂为国产分析纯。
3111型CO2培养箱(美国Thermo公司),Syn-H4型酶标仪(美国Bio-Tek公司),BX51型荧光显微镜(日本OLYMPUS公司),FC500型流式细胞仪(美国Beckman公司),5430R型高速低温离心机(德国Eppendorf公司),GelDOC型凝胶电化学发光成像系统(美国Bio-Rad公司)。
1.2 细胞培养及分组
正常大鼠肝细胞系BRL细胞购自中国科学院上海细胞研究所细胞库。BRL细胞用含10%胎牛血清的RPMI 1640培养液(含青霉素100 U/mL、链霉素100U/mL),置于37℃、5%CO23111型培养箱中培养。
为观察LPS的时效和量效关系,本实验分别给予10μg/mL LPS处理BRL细胞4、8、12、24h,以及0.1、1、10、100 μg/mL LPS处理BRL细胞12 h,以PBS溶剂作为空白对照,每组重复3次。
为观察LPS诱导内质网应激与细胞凋亡之间的因果关系,实验分为溶剂对照组、内质网应激诱导剂TG组、内质网应激抑制剂4-PBA组、LPS组、LPS+TG组、LPS+4-PBA组,分别给予溶剂、2 μmol/L TG、5 mmol/L 4-PBA、10 μg/mL LPS、10 μg/mL LPS和2 μmol/L TG、10 μg/mL LPS和5 mmol/L 4-PBA,均处理细胞12h,每组重复3次。
1.3 细胞活力的检测
用MTT比色法检测细胞活力[6]。取对数生长期的肝细胞,以2×104个细胞/mL接种于96孔板内,每孔200μL,37℃、5%CO2条件下孵育过夜,更换培养液,按前述分组方法处理细胞,培养至实验要求时间,每孔加入5 mg/mL MTT 20 μL、混匀,继续培养4 h,吸弃上清液,每孔加入DMSO 150 μL振荡使沉淀充分溶解,酶标仪在490nm波长测定吸光度值(OD值)。用OD值反映细胞活力,OD值越大细胞活力越强。
1.4 细胞凋亡的确证实验
Hoechst 33258染色检测凋亡细胞核形态以确证细胞凋亡[7]。取对数生长期的肝细胞接种于24孔板内,按前述分组方法处理细胞至适当时间,加入新鲜配制的4%多聚甲醛,4℃固定细胞10 min,加入5 mg/L Hoechst 33258染色液作用10min,PBS冲洗,荧光显微镜下观察、摄片。正常细胞的细胞核呈弥漫均匀的低强度荧光,凋亡细胞的细胞核呈致密的固缩状强荧光或颗粒状荧光[8]。
1.5 细胞凋亡率的检测
用AnnexinV-FITC/PI双染流式细胞术(flow cytometry,FCM)检测细胞凋亡率[9]。取对数生长期的肝细胞按前述分组方法处理细胞,PBS洗涤,加入适量胰酶消化细胞,弃去胰酶,加入培养液重悬细胞并计数。流式细胞仪检测细胞凋亡率,操作方法按试剂盒说明书进行。主要步骤为:取1×105个细胞,1 000×g离心5min,弃上清液,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,加入10 μL Annexin V-FITC和5μL PI,混匀室温避光放置15min,再加入300μL Annexin V-FITC结合缓冲液,在流式细胞仪上检测。
1.6 Western印迹法检测
取对数生长期的BRL细胞按前述分组方法处理细胞,PBS洗涤,加入细胞裂解液(每100 μL中加入1μL蛋白酶抑制剂)裂解细胞约10min,收集细胞至微量离心管中,12 000×g,4℃高速离心15 min后,留取上清液进行蛋白定量(Bradford法)。根据目标蛋白的分子量大小选用不同浓度的SDS-PAGE,取30μg蛋白上样量,浓缩胶80V 20min,分离胶110V,当电泳前端溴酚蓝行进至分离胶下缘时,停止电泳。采用半干式进行转膜,15V 1h。然后用5%脱脂奶粉封闭PVDF膜2h,分别加1∶200稀释的内质网应激标志蛋白GRP78和内质网应激相关的凋亡蛋白CHOP、caspase-12和c-caspase-3一抗4℃孵育过夜,TBS洗涤3次,每次10min,再分别加入1∶1000稀释的HRP标记的羊抗兔IgG或羊抗小鼠IgG二抗室温孵育2 h,TBST洗涤3次,每次10min。ECL化学发光法显色,以β-tubulin为内参照。Bio-Rad凝胶成像系统采集图片并用Quantity One图像分析系统进行光密度分析,以目标蛋白与内参的光密度比值表示各蛋白的相对表达量。
1.7 统计学分析
2 结果
2.1 肝细胞活力的变化
溶剂对照组不同时间肝细胞活力未见明显变化,LPS时间依赖性和浓度依赖性引起肝细胞活力明显降低(P<0.05),其中10 μg/mL LPS处理12 h细胞活力约为溶剂对照组的40%(表1~2)。TG处理12h可引起肝细胞活力明显降低,为溶剂对照组的79%(P<0.05)。LPS+TG处理12h引起了肝细胞活力进一步降低,为溶剂对照组的15%(P<0.05),并低于LPS单独处理引起的细胞活力降低(P<0.05)。4-PBA处理12h对肝细胞活力影响不大,但LPS+4-PBA处理12h可部分逆转LPS引起的细胞活力降低(P<0.05),见表3。
表1 LPS时间依赖性引起肝细胞活力变化(OD值)(n=3,±s)

表1 LPS时间依赖性引起肝细胞活力变化(OD值)(n=3,±s)
注:1)与相同时间点溶剂对照组比较,P<0.05
组别4h8h12h24h溶剂对照0.652±0.0410.665±0.0350.657±0.0370.648±0.041 10μg/mL LPS0.581±0.0290.595±0.0280.275±0.0311)0.084±0.0301)
表2 LPS浓度依赖性引起肝细胞活力变化(n=3,±s)

表2 LPS浓度依赖性引起肝细胞活力变化(n=3,±s)
注:1)与溶剂对照组比较,P<0.05
组别OD值溶剂对照0.712±0.035 0.1μg/mL0.688±0.027 1.0μg/mL0.612±0.032 10μg/mL0.275±0.0341)100μg/mL0.114±0.0241)
表3 内质网应激在LPS引起肝细胞活力变化中的作用(n=3,±s)

表3 内质网应激在LPS引起肝细胞活力变化中的作用(n=3,±s)
注:1)与溶剂对照组比较,P<0.05;2)与LPS组比较,P<0.05
组别OD值溶剂对照0.682±0.037 TG0.542±0.0281)4-PBA0.701±0.040 LPS0.275±0.0311)LPS+TG0.103±0.0341)2)LPS+4-PBA0.434±0.0351)2)
2.2 肝细胞凋亡的核形态变化
溶剂对照组肝细胞核荧光染色均匀;TG、LPS、LPS+TG和LPS+4-PBA处理后可见肝细胞呈现典型凋亡细胞核特征变化,如细胞核浓缩、聚集,细胞核呈致密浓染荧光;4-PBA处理后偶见肝细胞显示细胞凋亡核特征变化。
2.3 肝细胞凋亡率的变化
LPS能诱导肝细胞凋亡明显增多,且具有浓度和时间依赖性(P<0.05,表4~5),其中LPS处理12h时肝细胞凋亡率约为50%,高于溶剂对照组(P<0.05,图1~2);TG处理12h时肝细胞凋亡率为29.4%,高于对照组(P<0.05),而LPS+TG处理12h时肝细胞凋亡率明显增高,为55.1%(P<0.05)。4-PBA处理12h时肝细胞凋亡率仅为9.7%(P<0.05),LPS+4-PBA处理12 h能翻转LPS诱导的肝细胞凋亡率增高,肝细胞凋亡率降低为30.6%(P<0.05,表6、图3)。
表4 LPS时间依赖性引起肝细胞凋亡率变化(n=3,±s,%)

表4 LPS时间依赖性引起肝细胞凋亡率变化(n=3,±s,%)
注:1)与溶剂对照组比较,P<0.05
组别细胞凋亡率溶剂对照0.7±0.5 4h8.1±2.11)8h39.4±5.01)12h50.1±2.61)24h60.9±7.91)
表5 LPS浓度依赖性引起肝细胞凋亡率变化(n=3,±s,%)

表5 LPS浓度依赖性引起肝细胞凋亡率变化(n=3,±s,%)
注:1)与溶剂对照组比较,P<0.05
组别细胞凋亡率溶剂对照0.7±0.6 0.1μg/mL35.6±0.51)1.0μg/mL46.2±4.01)10μg/mL50.0±2.61)100μg/mL57.1±3.11)
表6 内质网应激在LPS引起肝细胞凋亡率变化中的作用(n=3,±s,%)

表6 内质网应激在LPS引起肝细胞凋亡率变化中的作用(n=3,±s,%)
注:1)与溶剂对照组比较,P<0.05;2)与LPS组比较,P<0.05
组别细胞凋亡率溶剂对照1.6±0.8 TG29.4±4.31)4-PBA9.7±1.91)LPS49.6±2.01)LPS+TG55.1±1.11)2)LPS+4-PBA30.6±4.21)2)

图1 流式细胞仪检测LPS诱导肝细胞时间依赖性凋亡率变化
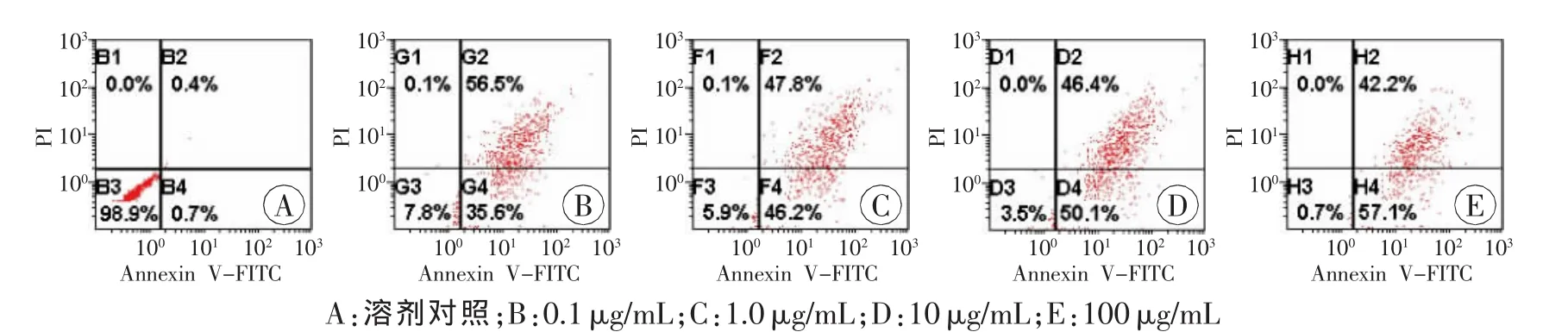
图2 流式细胞仪检测LPS诱导肝细胞浓度依赖性凋亡率变化

图3 流式细胞仪检测LPS联合内质网应激相关试剂诱导肝细胞凋亡率变化
2.4 GRP78、CHOP、caspase-12和c-caspase-3的表达变化(表7~8,图4)
与溶剂对照组比较,10μg/mL LPS处理4~24 h,肝细胞GRP78蛋白呈时间依赖性表达,其中8、12 h时表达明显上调(P<0.05),在24 h时表达略微下降(P<0.05);0.1、1.0、10、100μg/mL LPS处理12h,肝细胞GRP78蛋白表达呈剂量依赖性上调(P<0.05)。
10 μg/mL LPS处理4~24 h,肝细胞CHOP、caspase-12蛋白呈时间依赖性表达上调,与溶剂对照组相比,8、12、24h时差异均具有统计学意义(P<0.05);0.1、1.0、10、100μg/mL LPS处理12h,肝细胞CHOP、caspase-12蛋白呈浓度依赖性表达上调,与溶剂对照组相比1.0、10、100μg/mL LPS处理组差异具有统计学意义(P<0.05)。
10 μg/mL LPS处理4~24 h,肝细胞c-caspase-3蛋白表达呈时间依赖性上调,其中在8~24 h明显上调(P<0.05);0.1、1.0、10、100 μg/mL LPS处理12 h,肝细胞c-caspase-3蛋白表达上调,与溶剂对照组相比,10、100 μg/mL LPS处理组差异具有统计学意义(P<0.05)。
表7 LPS时间依赖性引起GRP78、CHOP、caspase-12、c-caspase-3的表达变化(n=3,±s)
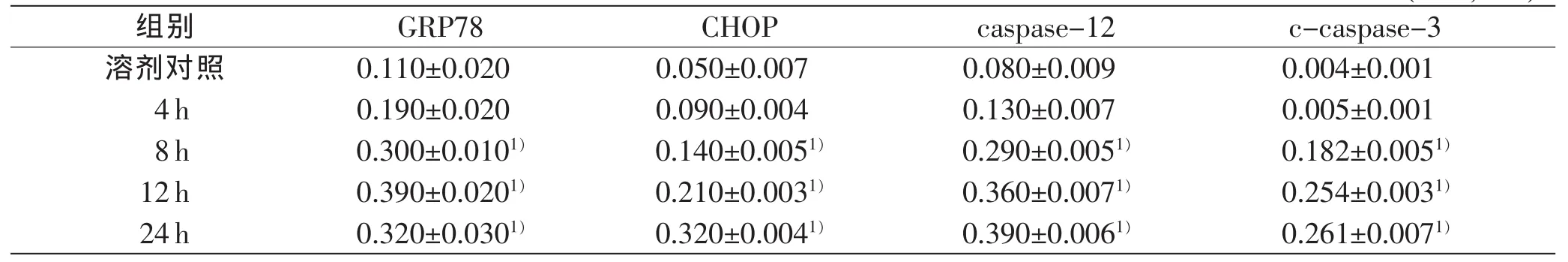
表7 LPS时间依赖性引起GRP78、CHOP、caspase-12、c-caspase-3的表达变化(n=3,±s)
注:1)与溶剂对照组比较,P<0.05
组别GRP78CHOPcaspase-12c-caspase-3溶剂对照0.110±0.0200.050±0.0070.080±0.0090.004±0.001 4h0.190±0.0200.090±0.0040.130±0.0070.005±0.001 8h0.300±0.0101)0.140±0.0051)0.290±0.0051)0.182±0.0051)12h0.390±0.0201)0.210±0.0031)0.360±0.0071)0.254±0.0031)24h0.320±0.0301)0.320±0.0041)0.390±0.0061)0.261±0.0071)
表8 LPS浓度依赖性引起GRP78、CHOP、caspase-12、c-caspase-3的表达变化(n=3,±s)
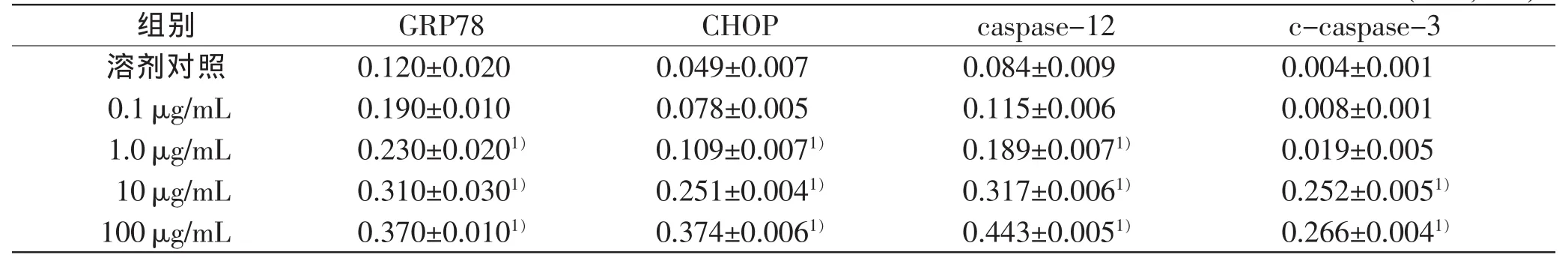
表8 LPS浓度依赖性引起GRP78、CHOP、caspase-12、c-caspase-3的表达变化(n=3,±s)
注:1)与溶剂对照组比较,P<0.05
组别GRP78CHOPcaspase-12c-caspase-3溶剂对照0.120±0.0200.049±0.0070.084±0.0090.004±0.001 0.1μg/mL0.190±0.0100.078±0.0050.115±0.0060.008±0.001 1.0μg/mL0.230±0.0201)0.109±0.0071)0.189±0.0071)0.019±0.005 10μg/mL0.310±0.0301)0.251±0.0041)0.317±0.0061)0.252±0.0051)100μg/mL0.370±0.0101)0.374±0.0061)0.443±0.0051)0.266±0.0041)

图4 LPS引起大鼠肝细胞GRP78、caspase-12、CHOP、c-caspase-3表达变化的电泳图
3 讨论
创伤性MODS是具有明显法医学特色的综合性病理过程,其死亡性质属于外力作用引起的暴力性死亡,但由于死亡发生的主要机制为外伤激活的体内病理过程,其致命性病理学变化为非特征性的,并且创伤性MODS引起的死亡并非发生于所受外伤当时,往往接受了临床抢救后原发性外伤发生了变化或某些外伤貌似轻微如大面积软组织挫压伤,这些特点导致对判断相关案件受害人的死亡性质出现困难。因此,研究创伤性MODS的发生机制一直是法医学的研究热点之一。探讨创伤性MODS的病理生理过程可以把原发性外伤与非特异性病理变化联系起来,成为构建法医学诊断创伤性MODS标准体系的有机组成部分。研究[10]表明,大面积软组织外伤可以导致急性肝损伤;创伤应激引起的肠源性LPS入血是急性肝损伤的重要环节。本实验主要发现,LPS诱导肝细胞内质网应激,LPS和内质网应激诱导剂TG均能导致肝细胞活力降低和细胞凋亡增加,TG加重而4-PBA减轻LPS引起的肝细胞损伤,表明内质网应激参与介导了LPS引起的肝细胞损伤。
内质网为细胞蛋白质分子合成、折叠修饰以及脂质合成、Ca2+储存的场所,也是感受细胞应激的重要细胞器[11]。在内质网功能正常时,分子伴侣GRP78主要分布于内质网内膜并与IRE1α、PERK和ATF6等处于结合状态。当内质网内未折叠或错误折叠的蛋白质分子增多亦即内质网应激发生时,GRP78与前述3种蛋白质分子解离并且蛋白表达上调、以结合未折叠或错误折叠的蛋白质分子。因此,GRP78表达量的变化成为内质网应激的标志[12]。以往报道[3],病毒性肝炎、脂肪代谢异常均可引起内质网应激而导致肝细胞损伤。本实验结果显示,LPS引起了肝细胞GRP78蛋白表达明显上调,并呈现时效和量效关系,表明LPS引起了肝细胞内质网应激。LPS引起肝细胞活力明显降低和细胞凋亡明显增多,说明LPS可造成肝细胞损伤,细胞凋亡可能是LPS引起肝细胞损伤的主要形式,这与以往报道[13-14]一致。为了查明内质网应激在LPS引起肝细胞损伤中的作用,实验用内质网应激诱导剂TG和抑制剂4-PBA分别处理肝细胞。结果显示,TG也能引起肝细胞活力明显降低、细胞凋亡明显增多,这与LPS的作用类似但程度明显轻微;4-PBA对细胞活力影响不大而引起细胞凋亡,凋亡率为9.7%。提示内质网应激是肝细胞损伤的重要发生机制,LPS引起肝细胞内质网应激可能介导了LPS引起的肝细胞损伤,4-PBA引起细胞凋亡的机制尚不清楚,有待进一步研究。同样剂量的TG和LPS共同作用引起肝细胞活力显著降低、细胞凋亡明显增高,与TG和LPS单独作用相比差异具有统计学意义;而4-PBA部分翻转了LPS对肝细胞的损伤效应。这些实验结果证实LPS引起的内质网应激参与介导了LPS引起的肝细胞损伤,内质网应激是LPS导致肝细胞损伤的重要发病途径。
本实验初步探讨了内质网应激介导LPS引起肝细胞凋亡的上游信号途径。在内质网应激发生过程中,与GRP78解离的IRE1α、PERK和ATF6分别发生磷酸化修饰、激活,并启动内质网应激反应或非折叠蛋白反应,分别激活不同的信号转导途径,对细胞功能和代谢等予以调整、适应从而发挥细胞代偿反应和保护作用。只有当内质网应激过于严重或处于持续状态时,细胞即启动内质网相关的细胞死亡途径、引发细胞死亡[15]。这是近年来发现的、一种新颖的细胞凋亡途径。CHOP和caspase-12是内质网应激介导细胞凋亡的关键蛋白分子。在正常细胞中CHOP表达水平十分低下;在内质网应激过程中,非折叠蛋白反应的效应分子IRE1α、PERK和ATF6活化后均可诱导CHOP表达上调[16]。caspase-12是内质网应激介导细胞凋亡的一个主要调节因子,属于蛋白质水解酶caspases家族成员,正常情况下以蛋白酶原的形式存在于细胞内质网内膜上[17],caspase-12活化后可通过激活caspase-9和caspase-3等效应分子,独立诱导细胞凋亡,而不需依赖于细胞凋亡的死亡受体和线粒体途径[18]。本实验结果显示,在LPS引起肝细胞CHOP、caspase-12和c-caspase-3蛋白表达上调,并呈现量效和时效关系,综合前述细胞凋亡结果,提示LPS不仅诱导了肝细胞内质网应激,且激活了内质网应激介导细胞凋亡信号,CHOP、caspase-12和c-caspase-3途径可能是LPS诱导内质网应激介导细胞凋亡增加的信号途径。值得注意的是,10μg/mL LPS引起肝细胞活力降低在12h开始明显降低、肝细胞凋亡则在4~24 h呈现时间依赖性增高,而GRP78、CHOP、caspase-12和c-caspase-3均在8h表达明显上调,这提示LPS诱导的内质网应激介导细胞凋亡途径可能介导了LPS作用8h后肝细胞损伤,而与早期的肝细胞凋亡关系不大。
综上所述,本实验发现LPS引起肝细胞损伤和诱导肝细胞发生内质网应激;内质网应激介导细胞凋亡途径参与介导了LPS引起的肝细胞凋亡,提示内质网应激是LPS诱导肝细胞损伤的重要发病途径,有助于加深对创伤应激导致创伤性MODS急性肝损伤发生机制的认识。
(本实验得到了南通大学医学院金国华教授和沈之君教授的大力支持,在此表示感谢!)
[1]Walsh CR.Multiple organ dysfunction syndrome after multiple trauma[J].Orthop Nurs,2005,24(5):324-333.
[2]Malhi H,Kaufman RJ.Endoplasmic reticulum stress in liver disease[J].J Hepatol,2011,54(4):795-809.
[3]Bernal W,Auzinger G,Dhawan A,et al.Acute liver failure[J].Lancet,2010,376(9736):190-201.
[4]Canová NK,Kmonícková E,Martínek J,et al.Thapsigargin,a selective inhibitor of sarco-endoplasmic reticulum Ca2+-ATPases,modulates nitric oxide production and cell death of primary rat hepatocytes in culture[J].Cell Biol Toxicol,2007,23(5):337-354.
[5]Vilatoba M,Eckstein C,Bilbao G,et al.Sodium 4-phenylbutyrate protects against liver ischemia reperfusion injury by inhibition of endoplasmic reticulumstress mediated apoptosis[J].Surgery,2005,138(2):342-351.
[6]Shpakova AP,Pavlova KS,Bulycheva TI.MTT-colorimetric method for detection the cytotoxic activity of human natural killer cells[J].Klin Lab Diagn,2000,(2):20-23.
[7]McGowan KB,Kurtis MS,Lottman LM,et al.Biochemical quantification of DNA in human articular and septal cartilage using PicoGreen and Hoechst 33258[J].Osteoarthritis Cartilage,2002,10(7):580-587.
[8]Häcker G.The morphology of apoptosis[J].Cell Tissue Res,2000,301(1):5-17.
[9]Eray M,Mättö M,Kaartinen M,et al.Flow cytometric analysis of apoptotic subpopulations with a combination of annexin V-FITC,propidium iodide,and SYTO 17[J].Cytometry,2001,43(2):134-142.
[10]韩业兴,谷振勇,丛斌,等.挤压家兔后肢导致急性肝损伤和抗氧化能力降低[J].法医学杂志,2006,22(4):248-250.
[11]Kapoor A,Sanyal AJ.Endoplasmic reticulum stress and the unfolded protein response[J].Clin Liver Dis,2009,13(4):581-590.
[12]Lee AS.The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress[J].Methods,2005,35(4):373-381.
[13]Su GL.Lipopolysaccharides in liver injury:molecular mechanisms of Kupffer cell activation[J].Am J Physiol Gastrointest Liver Physiol,2002,283(2):G256-G265.
[14]Kudo H,Takahara T,Yata Y,et al.Lipopolysaccharide triggered TNF-alpha-induced hepatocyte apoptosis in a murine non-alcoholic steatohepatitis model[J].J Hepatol,2009,51(1):168-175.
[15]Xu C,Bailly-Maitre B,Reed JC.Endoplasmic reticulum stress:cell life and death decisions[J].J Clin Invest,2005,115(10):2656-2664.
[16]Oyadomari S,Mori M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J].Cell Death Differ,2004,11(4):381-389.
[17]Nakagawa T,Zhu H,Morishima N,et al.Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-beta[J].Nature,2000,403(6765):98-103.
[18]Kalai M,Lamkanfi M,Denecker G,et al.Regulation of the expression and processing of caspase-12[J].J Cell Biol,2003,162(3):457-467.

