吡喹酮压力下日本血吸虫耐药性的诱导和虫体差异表达蛋白的分析
董兰兰,许 静,赵 波,梁 松,王言言,关志勋,曹 蕴,夏超明
血吸虫病(schistosomiasis)是由血吸虫引起的全球重点防治的热带病之一,King, C.H.(2011)指出每年全球血吸虫病的疾病负担将近(9-36)百万DALY(伤残调整寿命年),仅次于HIV/AIDS[1],针对其危害,目前尚无疫苗治疗措施[2],化学药物治疗是减轻其病情损害和控制其传播的一项重要手段[3],长期以来,吡喹酮(Praziquantel,PZQ)是治疗血吸虫病的首选药物,是治疗日本血吸虫病的唯一抗虫药[4]。但过分依赖或长期反复使用PZQ单一药物治疗具有产生抗药性的潜在危险。非洲一些地区,曼氏血吸虫对广泛用于抗虫治疗的海蒽酮和奥沙尼喹产生抗药性早有报道[5-6]。另梁幼生等建立现场采集株和实验室传代株日本血吸虫小鼠-钉螺实验室生活史循环,经过8轮筛选证实中国大陆日本血吸虫在PZQ持续药物压力下可产生抗药性,且不同虫株间对PZQ敏感性存在差异,药物压力下产生抗性的潜能也存在差异[7-8]。抗药性的出现引起人们的高度关注,因此,寻找抗血吸虫新药,加强抗血吸虫疫苗的开发和新药物靶标的筛选显得极其重要。
本实验应用PZQ半数有效量(ED50)对单性感染小鼠体内日本血吸虫进行药物压力下的耐药虫体筛选,体外培养观察诱导虫体对PZQ敏感性的变化;并利用荧光差异凝胶双向电泳(2D-DIGE)技术和基质辅助激光解析飞行时间质谱(MALDI-TOF-MS)技术,比较分析PZQ ED50诱导虫体和未诱导虫体差异表达蛋白,为新药的研发和进一步研究血吸虫对PZQ产生抗性的机制提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物与寄生虫 雌性ICR小鼠(20~25 g,6~8周龄,雌性,清洁级), 由苏州大学实验动物中心提供。阳性钉螺和日本血吸虫虫株均购自江苏省血吸虫病防治研究所。
1.1.2主要试剂及配制 PZQ片剂(南京制药厂有限公司,批号20110808),配制工作浓度为50 mmol/L,4 ℃保存备用。DMEM(Dulbecco—modified Minimum Eagle’Medium)培养液:以100 mLDMEM LOW GLUCOSE、20 mL胎牛血清、1.2 mL青霉素链霉素溶液的比例进行配制,所用容器高压蒸汽灭菌30 min,无菌操作,配后溶液置-20 ℃保存备用。
硫脲(Thiourea)、考马斯亮蓝G-250(Coomassie G-250)购自美国Sigma公司。尿素 (Urea)、甘油(Glycerol)、硫代硫酸钠 ( Na2S2O3)、丙烯酰胺 ( Acrylamide )、甲叉双丙烯酰胺( N,N-methylenebis acrylamide )、四甲基乙二胺( N,N,N,N-Tetramethyle thylenediamine, TEMED)、过硫酸氨(Ammonium persulfate, AP)、甘氨酸 (Glycine)、低熔点琼脂糖(Argrose)、溴酚兰(Bromophenol blue)、Tris碱(Tris-base)、十二烷基硫酸钠(Sodium Dodecyl sulfate,SDS)、、3-[3-(胆酰胺丙基)-二乙胺]-丙璜酸(CHAPS)、二硫苏糖醇 ( Dithiothreitol,DTT )、碘乙酰胺(Iodoacetamide)、玻璃板硅烷化剂(Bind-silane)、固相PH干胶条(IPG Strip)、IPG buffer、蛋白质纯化试剂盒(2D-Clean-Up Kit)、定量试剂盒(Quant Kit)、荧光标记试剂盒(CyDye DIGE Flour (minimal Dye)Labelling Kit)、标准分子量Marker均购自瑞典Amersham Bioscience公司。
1.2方法
1.2.1日本血吸虫雄虫ED50的测定 雌性ICR鼠60只,每只小鼠经腹部皮肤感染单只阳性钉螺逸出的日本血吸虫尾蚴(单性)70~80条,感染4周后的小鼠分为6组,10只/组,其中对照组不作任何处理,5组实验组分别经口服灌胃给予不同剂量的PZQ混悬液,依次为12.5、25、50、100、200 mg/kg,连续5 d,给药结束后21 d,同时解剖6组小鼠,肝门静脉灌注法收集虫体并计算减虫率,计算ED50值。具体参考杨巧林等[9]的方法进行。

1.2.2日本血吸虫对PZQ( ED50)抗性的诱导方法 ICR鼠300只,分为诱导组和未诱导组,每组150只,每只小鼠经腹部皮肤感染单只钉螺逸出的日本血吸虫尾蚴(单性)70~80条。诱导组小鼠于感染后4周,连续30 d口服喂饲ED50PZQ(25.98 mg/kg)混悬液,停药21 d后,再用治疗剂量(200 mg/kg)连续给药5 d,给药结束后3周解剖小鼠,而未诱导组不作任何处理,与诱导组小鼠同时解剖,采用肝门静脉灌注法收集虫体。所获虫体部分用于验证对PZQ的敏感性,其余均冻存于-80 ℃冰箱用于后续虫体总蛋白提取。
1.2.3诱导虫体对PZQ敏感性变化 将上述诱导虫体,置于加入DMEM培养液的6孔板中,5条/皿,加入不同浓度的PZQ,培养过夜(16 h)后用生理盐水洗涤虫体,加入新鲜培养液,于体视显微镜下连续观察72 h,并对血吸虫活力状态进行评分,虫体活力评分标准参考杨巧林等的方法[9]。
1.2.4日本血吸虫虫体总蛋白的制备提取 称取诱导虫体(约160 mg)和未诱导虫体(约320 mg)分别放入玻璃匀浆研磨器中,每80 mg虫体加入500 μL组织裂解液(7 mol/L尿素,2 mol/L硫脲,4%CHAPS,40 mmol/L Tris,30 mmol/L DTT,0.2 mmol/L PMSF)充分研磨匀浆,冰浴超声破碎,4 ℃离心,12 000g离心30 min,吸上清,保存于-80 ℃。
1.2.5蛋白样品的纯化和定量 按2D-Clean-Up Kit和Quant Ki使用说明书分别进行蛋白纯化与定量。
1.2.6蛋白样品的分离(2D-DIGE)
1.2.6.1CyDye荧光标记 以每400 pmol荧光能标记50 μg蛋白的比例设计实验方案标记各蛋白样品,内标(Cy2)为各组混合物,充分混匀,置于冰盒上,暗处标记,反应30 min。加入和荧光等量的终止液赖氨酸,避光反应10 min。然后将样本进行Cy3、Cy5正反标。
1.2.6.2双向凝胶电泳 将制备好的已用荧光染料标记的蛋白样品(460 μL)进行水化上样,按IPGphor 等电聚焦系统指南进行第一向固相pH梯度等电聚焦电泳(IEF),上样量为 500 μg总蛋白。IPG 干胶条水化和聚焦在 20 ℃自动进行,程序参数设置如下:30 V,12 h;500 V,1 h;1 000 V,1 h;10 000V,2 h(grad);10 000 V,9 h(8 500 Vhr);500 V,12 h。
第1向等电聚焦完成后,IPG胶条在胶条平衡缓冲液Ⅰ(6 mol/L尿素,50 mmol/L Tris(pH 8.8),30%甘油,2%SDS,0.002%溴酚蓝+0.1gDTT)中进行第1次平衡15 min,然后再在平衡缓冲液Ⅱ(6 mol/L尿素,50 mmol/L Tris(pH8.8),30%甘油,2%SDS,0.002%溴酚蓝+0.25g碘乙酰胺)中第2次平衡15 min。平衡后的胶条转移至已预先制备好的12.5%分离胶进行第2向SDS-PAGE电泳,在其胶条左边插入带有标准分子量的Maker(高分子量)的滤纸片,右边插入带有低分子量Maker滤纸片。最后将低熔点琼脂糖封胶液加热融化,用温热的琼脂糖封胶液将胶面上缘因放置IPG胶条而产生的空隙填满。待其凝固,将放置好IPG胶条的SDS-PAGE凝胶板依次插入电泳槽,在Ettan DALT Six大型垂直电泳系统中进行蛋白分离,SDS-PAGE电泳程序设置:开始2 W/gel,50 min;然后17 W/gel直至溴酚蓝指示剂迁移到胶的底部边缘时结束电泳,进行考马斯亮蓝染色。2D-DIGE避光条件下进行。
1.2.7凝胶图像的扫描和图像分析 利用Typhoon 9400型多功能激光扫描仪对电泳后的胶板进行图像扫描。通过 Decyder V6.0凝胶分析软件自动完成对凝胶图像斑点的识别,并进行胶内差异(DIA)和生物学变化(BVA)的初步分析,排除图谱内由于凝胶制备或电泳过程中产生的干扰因素如颗粒污染等,同时能纠正可能出现的错误匹配的斑点。
在蛋白质统计中进行T-test,选取平均表达量比率(AR)>1.5且P<0.01的蛋白质点,作为进一步基质辅助激光解吸附飞行时间质谱(MOLDI-TOF/MS)分析的差异候选蛋白,对这些点进行标记,然后在同步匹配的考马斯亮蓝染色的制备胶图谱上于全自动斑点处理工作站进行取点酶解。
1.2.8蛋白点胶内酶解 将切出的差异蛋白的凝胶从96孔板中取出,放入已标记好的1.5 mLEP管,各管加入脱色液(25 mmol/L NH4HCO3、50%ACN)150 μL,37 ℃脱色20 min,吸干,重复脱色2~3次,至蓝色褪去。加ANC(100%)100 μL脱水至胶粒变白,吸弃ACN,约5 min,重复两次。用25 mmol/L NH4HCO3稀释Trypsin至12.5 μg/mL,每管加10 μL,稍微离心(12 000 r/min,1 min),让酶与胶粒充分接触,4 ℃放置30 min。待酶解液被胶粒完全吸收,吸弃多余的酶液,加入10 μL 25 mmol/L NH4HCO3于37 ℃过夜。将样本取出于24孔振荡器上震荡15 min,于冻干机中冻干,6 min/次,共2次,冻干后剩余蛋白样品去4 μL左右点靶并自然干燥,然后进行质谱分析。
1.2.9差异蛋白点的质谱分析和数据检索 样品用4700串联飞行时间质谱仪进行质谱分析,采用正离子模式和自动获取数据的模式采集数据;所得的肽质量指纹图谱用在线工具MASCOT(http://www.lnatrixseienee.eom)进行数据检索;利用NCBI(http://www.nebi.nlm.nih.gov)数据库进行搜索;物种分类选择Schistosomejaponicum进行比对,只有在MASCOT中阈值超过95%的置信水平,才被认为是有效的差异点,若匹配到多个蛋白注释,则选择得分最高的作为鉴定的蛋白。
1.2.10生物信息学分析 将质谱鉴定和NCBI上BLAST的结果通过Uniprot(http://www.uniprot.org/)和DAVID(http://david.abcc.ncifcrf.gov/)的在线软件进行蛋白功能注释和分类。
2 结 果
2.1PZQ半数有效量(ED50)的测定 日本血吸虫感染小鼠经不同剂量PZQ作用后减虫率如表1所示,应用PHARM verson4.2软件计算出抗日本血吸虫的PZQ ED50为25.98 mg/kg。
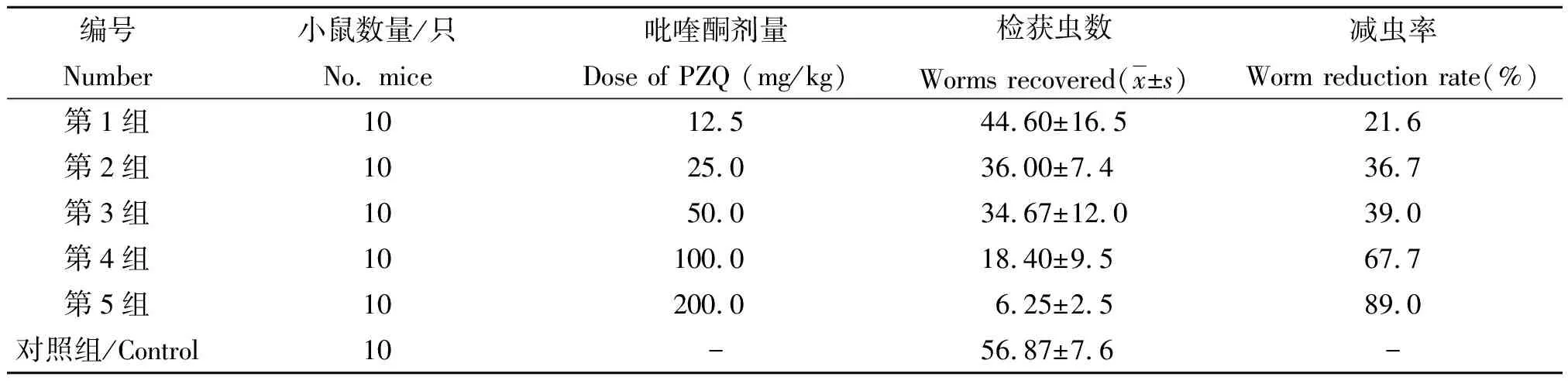
表1 日本血吸虫感染小鼠经不同浓度PZQ作用后减虫率
2.2PZQ ED50诱导虫体体外培养对PZQ敏感性的变化 本课题组前期研究结果表明PZQ(片剂)抗日本血吸虫未诱导成虫的临界致死浓度为14 μmol/L[10]。表2显示,经PZQ ED50压力诱导的虫体体外分别暴露于14 μmol/L、28 μmol/L、56 μmol/L和112 μmol/L的PZQ作用后72 h,虫体存活率分别为87.5%、82.0%、77.3%和75.6%,与对照组相比无统计学差异(P>0.05)。由表2可知,随着PZQ临界致死浓度的倍数增加,诱导后虫体的存活率与活力分值虽然有所下降,但变化不明显,特别是PZQ浓度增至112 μmol/L,即8倍的未诱导血吸虫临界致死浓度,仍有75.6%虫体存活,可见诱导后虫体对PZQ的敏感性显著下降,显示耐药趋势。
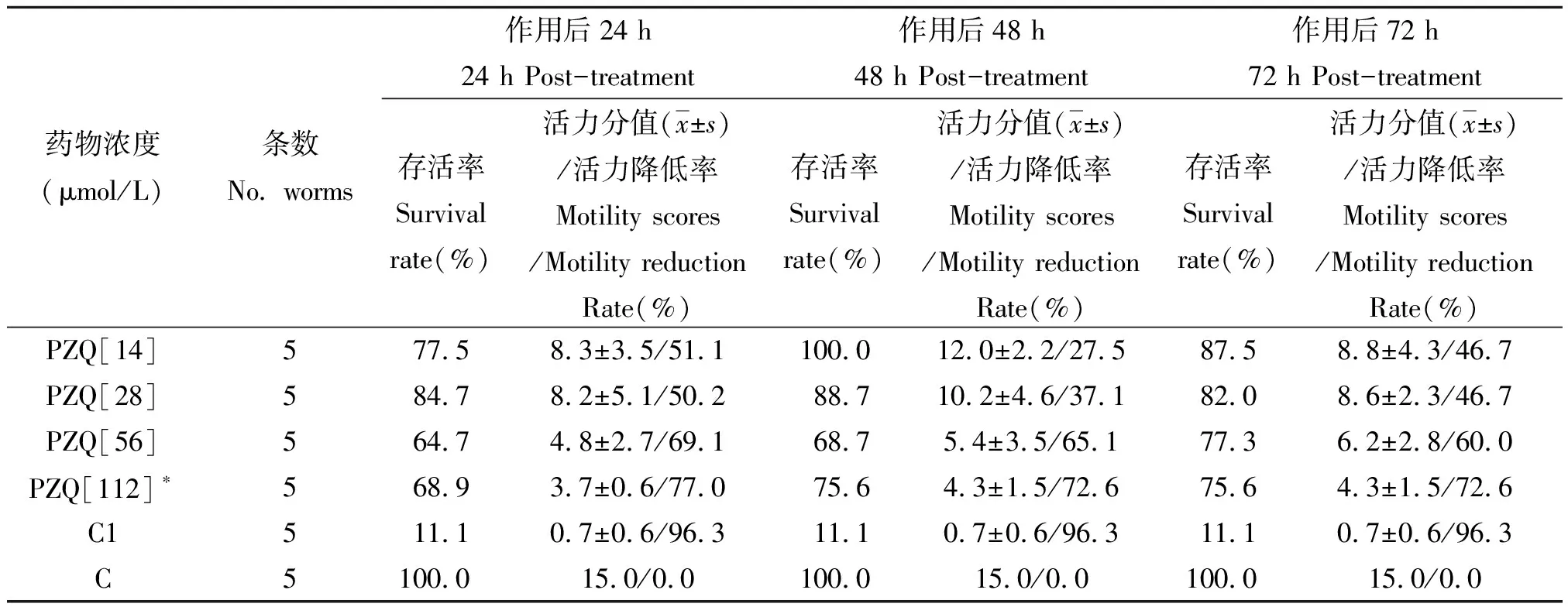
表2 诱导虫体体外对PZQ敏感性变化
2.3PZQ ED50诱导的耐药虫体差异表达蛋白的筛选
2.3.1诱导虫体和未诱导虫体总蛋白含量 取出-80 ℃冰箱保存的诱导成虫和未诱导虫体,提取虫体总蛋白,根据蛋白质标准曲线图(图1)和A480值,测得诱导虫体和未诱导虫体总蛋白的浓度分别为9.7 μg/μL和13.27 μg/μL。
2.3.22D-DIGE图谱分析 经双向凝胶电泳,用Typhoon 9400激光扫描仪于荧光模式下进行凝胶成像扫描,可得到分别由Cy2、Cy3、Cy5标记的诱导虫体和未诱导虫体蛋白样品的图像及合并的胶内差异图像,Decyder软件分析总共分别检测到2 741±22和2 763±20个蛋白斑点,筛选出AR>1.5的蛋白点为差异蛋白表达点,蛋白表达差异值经统计学分析(T-test),P<0.05。经分析,找出诱导虫体和未诱导虫体差异蛋白点35个,如图2所示。
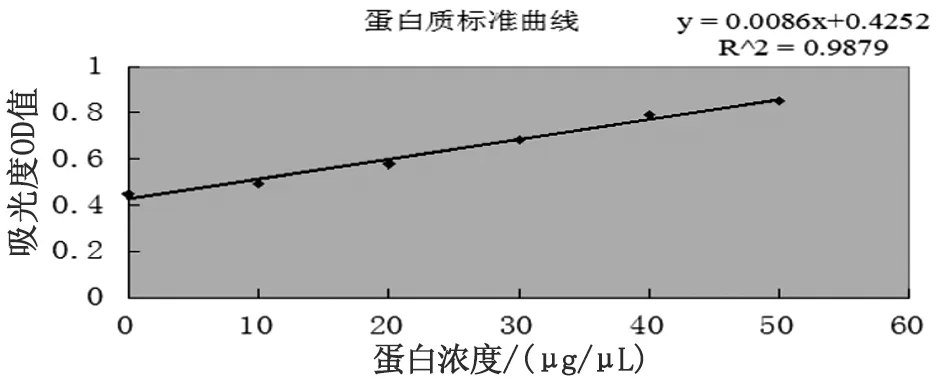
图1 蛋白浓度标准曲线
2.3.3差异蛋白点的MALDI-TOF-MS质谱分析 对图2的35个差异蛋白点与质谱胶进行匹配,于全自动蛋白斑点处理工作站进行切胶、酶解消化后点样,进行MALDI-TOF-MS质谱分析,质谱结果通过MASCOT软件搜索并通过NCBI数据库去重复分析后共确认有30个差异表达蛋白,结果如表3所示。其中12个蛋白表达上调,18个蛋白表达下调。Uniprot软件在线分析发现其中28个蛋白是功能蛋白,DAVID在线软件进行GO功能分类发现这些蛋白主要是细胞组分(Cellular Component)和生物过程(Biological Process)类蛋白。主要包括细胞骨架相关蛋白、细胞中参与糖代谢和能量代谢的酶类、氧化还原酶类以及应激蛋白和参与解毒代谢的蛋白酶等,另有2个蛋白功能未知(点1579:SJCHGC02633 protein(假说蛋白);点1701:SJCHGC05544(未知蛋白)。

图2 日本血吸虫诱导虫体和未诱导虫体差异蛋白质2D-DIGE凝胶图谱
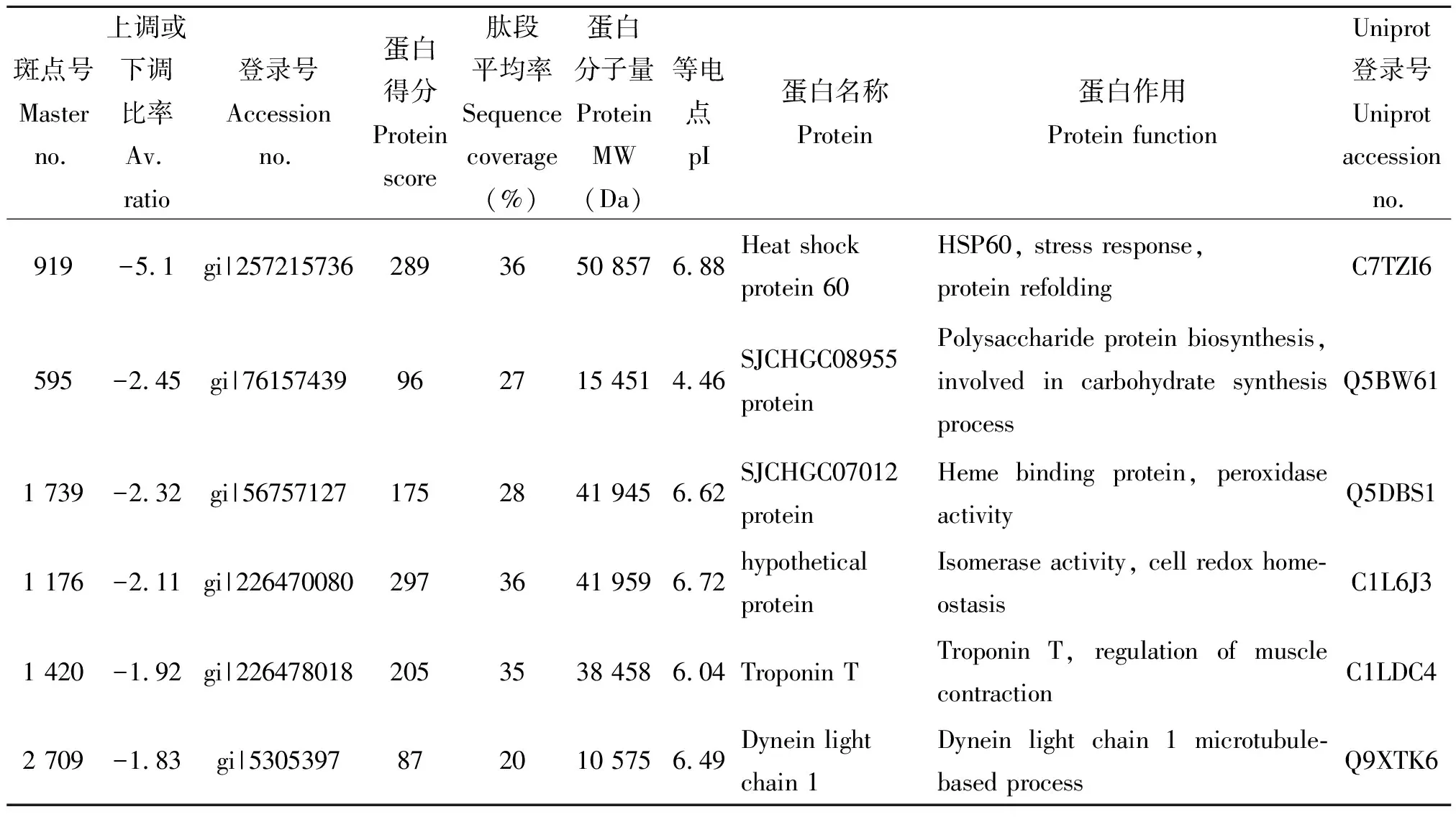
表3 诱导虫体与未诱导虫体鉴定的差异蛋白点
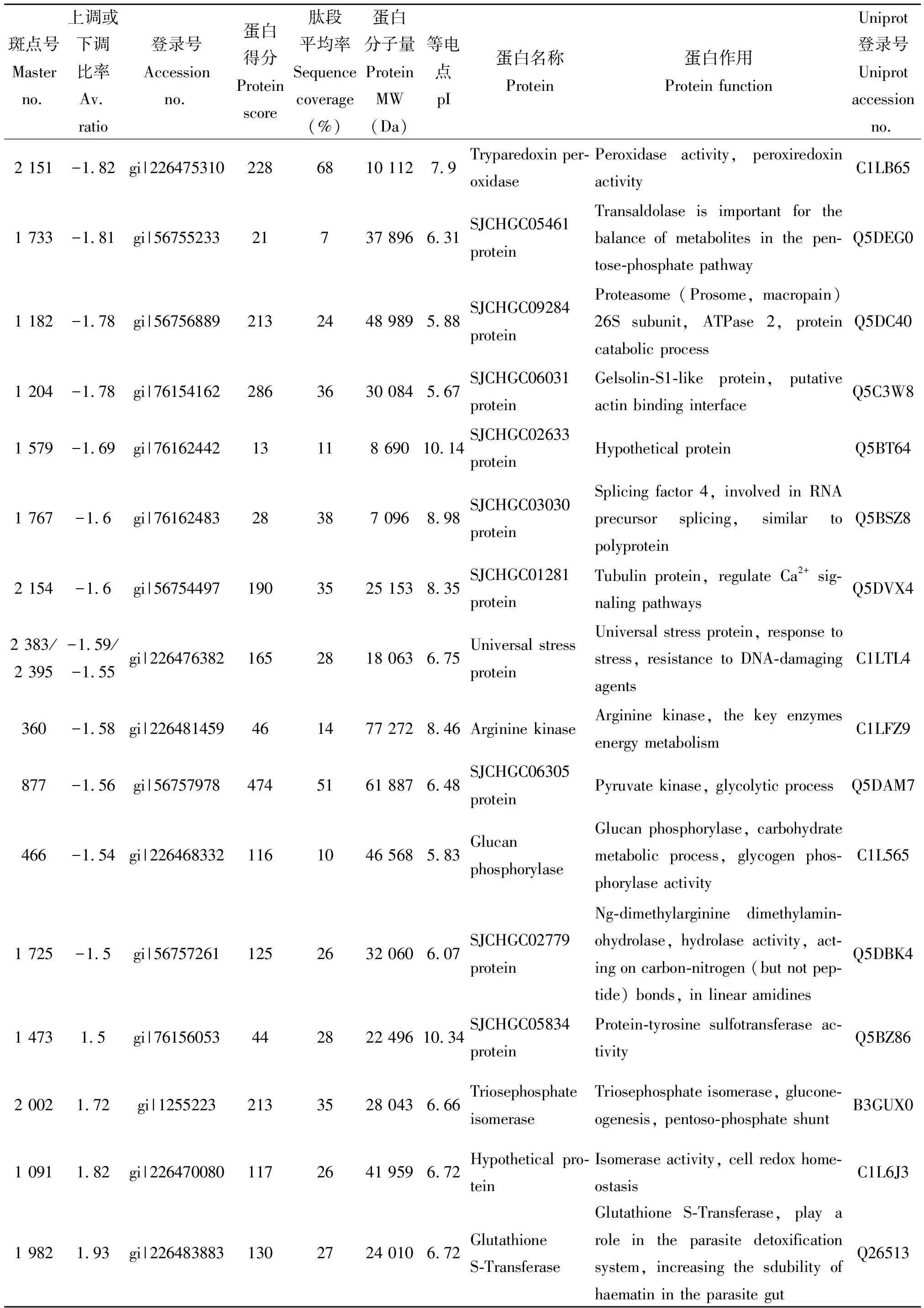
续表1
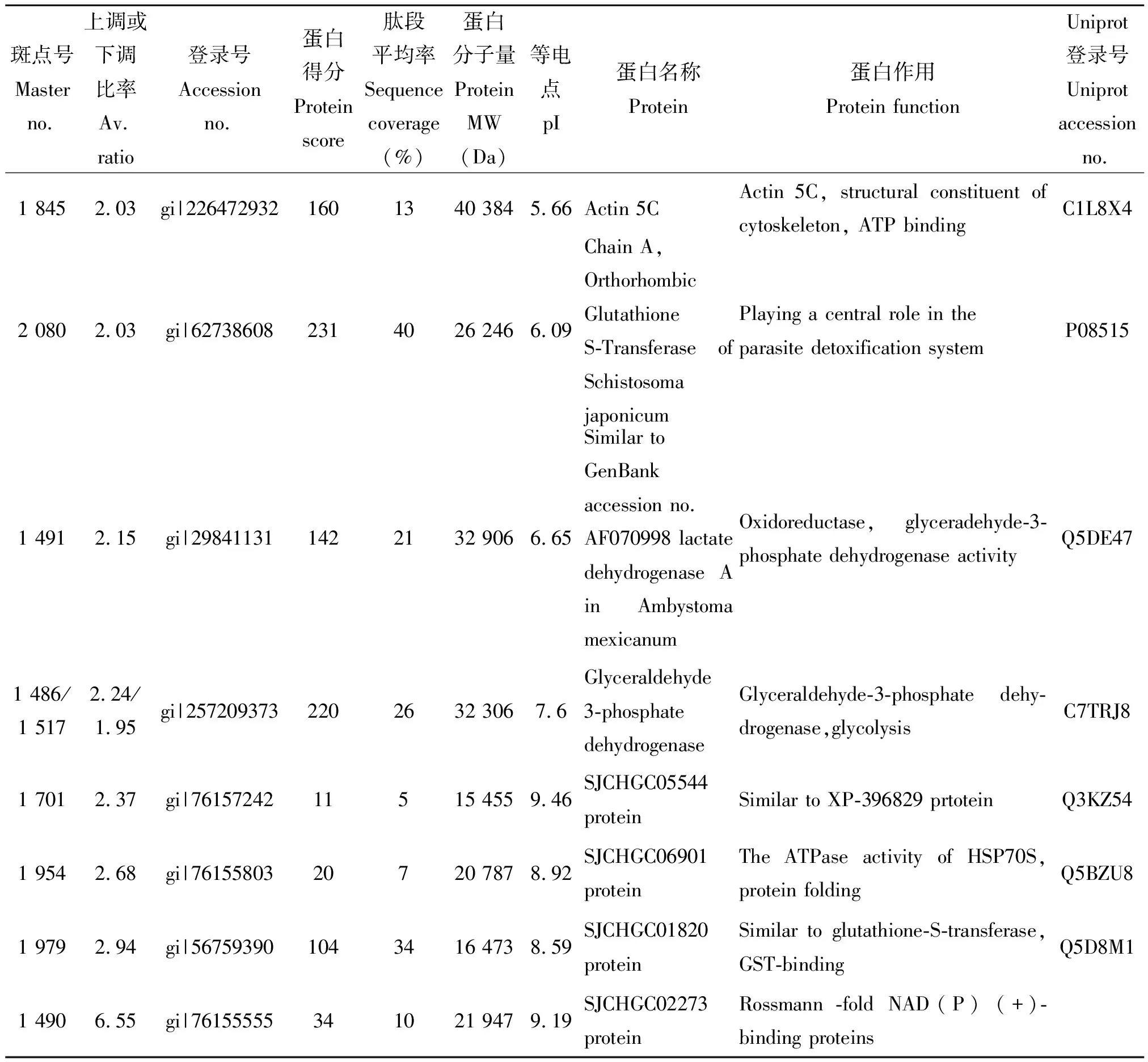
续表2
3 讨 论
近年来血吸虫对PZQ产生抗性的问题是研究的热点之一,Kohler[11]认为抗药性遗传物质的传播是通过亲本直系传递,通过低于治疗剂量的化疗选择性的移去寄生虫种群对药物敏感的个体,导致种群中携带的抗性基因能够传给下一代的个体比例增加;若反复用同一种药物对某一种群进行化疗,抗性基因会逐渐积累,导致相当数量的虫体存活。在对曼氏血吸虫的研究中,Fallon和Doenhoff[12]通过实验室亚治疗剂量即半数有效量(ED50)PZQ对感染小鼠体内的曼氏血吸虫进行连续传代与治疗筛选,诱导出曼氏血吸虫的PZQ抗性株,从而认为在药物压力作用下曼氏血吸虫可以对PZQ产生抗性。
参照曼氏血吸虫ED50的测定方法[13],本研究应用PZQ半数有效量(ED50=25.98 mg/kg)对感染小鼠体内的日本血吸虫进行抗性诱导。体外实验结果表明诱导虫体对PZQ的敏感性降低了8倍,其对PZQ的临界致死剂量从未诱导虫体的14 μmol/L增加至112 μmol/L,敏感性下降显著,显示出耐药趋势。该现象提示药物压力的持续作用下日本血吸虫具有产生PZQ抗性的潜在可能性,该结果与杨巧林等[9]实验结果报道一致。
利用2D-DIGE和质谱技术对PZQ诱导虫体与未诱导虫体差异表达蛋白筛选与分析发现共有30个差异表达蛋白,其中12个蛋白表达上调,18个蛋白表达下调,涉及糖代谢和能量代谢的酶类、细胞骨架相关蛋白、氧化还原酶类和参与解毒代谢的蛋白酶以及应激蛋白等。
首先是糖代谢途径相关酶类。与大多数寄生虫一样,血吸虫需要通过无氧酵解来进行能量代谢,从而维持正常的生长发育[14]。血吸虫能够从宿主吸取大量的糖来进行代谢,每5 h便可消耗与虫体干重相当的葡萄糖[15],因此血吸虫通过糖代谢获得能量得以生存。本实验中发现,参与糖酵解途径的重要酶如丙酮酸激酶(PKM)在诱导虫体中下调表达,同时,磷酸丙糖异构酶(TPI)和乳酸脱氢酶(LDH)上调表达。PKM的下调能够抑制磷酸烯醇式丙酮酸转化为丙酮酸,而TPI可以可逆的催化磷酸二羟丙酮转化为3-磷酸甘油醛,LDH可催化丙酮酸转化为乳酸。表明PZQED50长期作用虫体,使糖酵解进程减弱,由糖酵解产生能量代谢障碍,血吸虫可能通过其他代谢途径供能,代偿糖酵解过程。糖酵解途径的很多酶类均位于体被,除利于血吸虫方便得到葡萄糖合成ATP,同时也是许多抗血吸虫药物靶标的相关分子[16],成为重要的潜在药物靶点。目前PKM、TPI和LDH均是公认的具有保护性作用的血吸虫病疫苗候选分子[17-19]。药物抑制实验结果表明,血红素、Fe3+、青蒿素对重组日本血吸虫LDH的活性有极强的抑制作用[20]。本研究中PZQ诱导后,虫体LDH上调表达,推测PZQ压力下LDH代偿性表达上调,维持虫体正常能量代谢的稳定,提示LDH可能是潜在的PZQ靶标之一。
其次是细胞骨架和运动相关蛋白。肌动蛋白在所有真核生物中是一类高度保守的蛋白,并且是肌肉组织的重要组成成分[21],它也存在于血吸虫的肌肉、被膜和表皮中[22]。以往的研究报道表明,PZQ作用成虫后,皮层首先产生严重损伤[23]。Tanima等[24]通过实验证明,PZQ可与曼氏血吸虫成虫肌动蛋白结合,而肌动蛋白又广泛分布在血吸虫的体被膜,因此他们推测,PZQ是通过这种方式进入血吸虫的磷脂双分子层而发挥作用的。本实验中诱导虫体肌动蛋白Actin 5C 上调表达,提示PZQ ED50长期作用后,虫体皮层屏障被破坏,机体为了修复皮层损伤不断改变体壁的肌肉组织从而合成大量细胞骨架蛋白,重塑细胞骨架。这与Matsumoto等[25]的报道一致。血吸虫的体被也是成虫摄取营养的重要部位,同时具有重要的生理功能和防御功能,是血吸虫逃避宿主免疫识别的屏障。这些蛋白在血吸虫体被蛋白组的研究中亦得到证实[26]。此外,本研究中还检测到Troponin T(肌钙蛋白T),Troponin作为Ca2+信号传导途径中的参与者能够调节细胞间的Ca2+水平和介导Ca2+稳态效应[27]。PZQ作用后除引起皮层损害外,还导致虫体肌肉收缩,这均与Ca2+密切相关,虽然目前PZQ破坏钙离子稳态的确切作用机制不明确,但本研究发现Ca2+信号传导途径中的参与者Troponin T在PZQED50诱导虫体中下调表达,提示PZQ诱导后虫体通过下调表达这些蛋白抑制了Ca2+内流,维持Ca2+稳态。
再次为氧化还原酶类。硫氧还蛋白过氧化物酶(TPx)是广泛存在于原核生物和真核生物体内的抗氧化酶,与硫氧还蛋白(TRx)、还原型烟酰腺嘌呤二核苷磷酸(NADPH)共同组成硫氧还蛋白系统(TPx系统)[28]。筑成抗氧化作用的第一道防线,抑制初始自由基链的反应。谷胱甘肽S转移酶(GST)作为抗氧化作用的第二道防线,对初始自由基链反应释放的毒性分子进行解毒。目前也是一个主要的血吸虫疫苗和抗血吸虫药物的作用靶点[29]。现已知日本血吸虫谷胱甘肽-S-转移酶(SjGST)融合蛋白是WHO首批提出的作为血吸虫病重要疫苗候选分子之一[30]。GST的酶解产物不但参与虫体发育过程,而且还调节宿主的免疫应答反应,在日本血吸虫的免疫方面,以GST重组蛋白质免疫的鼠、猪、羊、水牛和黄牛的减卵率分别在38.0%~59.96%之间[31]。此外,研究表明PZQ可以和GST结合并抑制其活性。本实验中诱导虫体GST类蛋白表达上调,提示血吸虫可能通过增强GST与PZQ的结合而降低PZQ对血吸虫造成的损伤,从而使虫体得以存活,但其具体的作用机制仍需探索。
最后是应激反应相关蛋白。在所有生物体中,应激反应相关蛋白在细胞的发育过程中起着重要的作用,在血吸虫进入终宿主,适应宿主免疫环境的过程[32]中以及血吸虫在PZQ长期作用下能够存活下来具有重要作用。在人体内,当血吸虫遇到明显的逆境环境时,HSP家族蛋白会过量表达[33]。本实验中HSP70蛋白在诱导虫体中表达上调,其他应激蛋白如SJCHGC06312 protein、HSP60等表达下调。HSP70蛋白在HSP蛋白家族中占主导地位,在寄生虫的发育和致病作用中起着重要的调节作用[34-35]。HSP70作为一个重要的保守热休克蛋白,除具有分子伴侣作用外,还有耐热力作用、抑制细胞凋亡、细胞识别和免疫作用[36]。用对血吸虫具有天然抗性的东方田鼠血清免疫筛选日本血吸虫cDNA文库,获得的与东方田鼠血清发生抗体反应的相关抗原就包括HSP70[37]。本实验HSP70蛋白在诱导虫体上调表达可能是对PZQ压力作用的保护性反应,帮助细胞维持代谢结构的完整。
此外,其他一些蛋白如SJCHGC09284 protein,功能分析发现其是26S蛋白酶体,具有催化活性的多亚基大分子复合物。许多研究表明,蛋白酶体在血吸虫的生长发育中具有重要作用[38],在细胞内降解多种短半衰期蛋白、错误折叠蛋白和核蛋白的细胞器,参与细胞周期、特异性基因转录、抗原处理、分泌、膜蛋白的定位和蛋白质的质量监控等许多重要的过程[39-40]。本研究中PZQ作用后,26S蛋白酶体下调表达,不能进行正常的蛋白降解,势必会影响到虫体对PZQ的敏感性变化,因而进一步深入对这些差异表达蛋白的研究可为日本血吸虫抗药性方面的研究提供依据。
本研究结果中这些差异蛋白的表达上调或下调,提示在PZQ药物压力的作用下可能促进或抑制了特定蛋白分子的表达。这些差异表达蛋白分子的发现有助于我们更好的理解PZQ抗血吸虫的药物作用机制,也为抗血吸虫疫苗和潜在药物靶点的研究提供了新实验依据,为新药研发开拓新途径和新思路。
参考文献:
[1]Kasinathan RS, Greenberg M. Pharmacology and potential physiological significance of schistosome multidrug resistance transporters[J]. Exp Parasitol, 2012, 132(1): 2-6.
[2]Hagan P, Sharaf O. Schistosomiasis vaccines[J]. Exp Opin Bio Ther, 2003, 3(8): 1271-1278.
[3]Wang LD, Zhou XN, Chen HG, et al. A new strategy to control transmission ofSchistosomajaponicum[J]. Engineer Sci, 2009, 11(5): 37-43. (in Chinese)
王陇德,周晓农,陈红根,等.血吸虫病控制新策略的研究[J].中国工程科学,2009,11(5): 37-43.
[4]Garba A, Toure S, Dembele R, et al. Present and future schistosomiasis control activities with support from the Schistosomiasis Control Initiative in West Africa[J]. Parasitology, 2009, 136(13): 1731-1737. DOI: 10.1017/S0031182009990369
[5]Katz N, Dias EP, Araujo N. Estudo de ume cepa humana deSchistosomamansoniresistant a agents esquistossomicidas[J]. Rev Soc Bras Med Trop, 1973, (7): 281-287.
[6]Canpos R, Moreira AA, Sette H Jr, et al. Hycanthone resistance in a human strain ofSchistosomamansoni[J]. Trans R Soc Trop Med Hyg, 1976, (70): 261-262.
[7]Liang YS, Li HJ, Dai JR, et al. Studies on resistance of Schistosoma to praziquantel ⅩⅢ resistance ofSchistosomajaponicumto praziquantel is experimentally induced in laboratory[J]. Chin J Schisto Ctrl, 2011, 23(6): 605-610. (in Chinese)
梁幼生,李洪军,戴建荣,等.血吸虫对吡喹酮抗药性的研究ⅩⅢ- 日本血吸虫吡喹酮抗性株的实验室诱导[J].中国血吸虫病防治杂志,2011,23(6):605-610.
[8]Liang YS, Coles GC, Doenhoff MJ, et al.Invitroresponse of praziquantel -resistant and -susceptibleSchistosomamansonito praziquantel[J]. Int J Parasitol, 2001, 31: 1227-1235.
[9]Yang QL, Cai R, Li X, et al. Selected schistosomes of decreased praziquantel sensitivity and ultrastructural alterations of worms under drug pressure[J]. Chin J Schisto Ctrl, 2010, (3): 206-212. (in Chinese)
杨巧林,蔡茹,李欣,等.日本血吸虫吡喹酮耐药虫体筛选及其超微结构观察[J].中国血吸虫病防治杂志, 2010 (3): 206-212.
[10]Cai R, Yang QL, Zhang HQ, et al. Effect of Cytochalasin D and Calcium channel blockers on ultrastructure ofSchistosomajaponicumtreated with praziquantelinvitro[J]. Chin J Zoonoses, 2010, 26(4): 315-319. (in Chinese)
蔡茹,杨巧林,张惠琴,等.细胞松弛素 D 与钙通道阻滞剂拮抗吡喹酮作用对血吸虫超微结构的影响[J].中国人兽共患病学报,2010,26(4):315-319.
[11]Kohler P. The biochemical basis of anthelmintic action and resistance[J]. Int J Parasitol, 2001, 31(4): 336-345.
[12]Fallon PG, Doenhoff MJ. Drug-resistant schistosomiasis: resistance to praziquantel and oxamniquine induced inSchistosomamansoniin mice is drug specific[J]. Am J Trop Med Hyg, 1994, 51(1): 83-88.
[13]Cioli D, Botros SS, Wheatcroft-Francklow K, et al. Determination of ED50values for praziquantel in praziquantel-resistant and-susceptibleSchistosomamansoniisolates[J]. Int J Parasitol, 2004, 34(8): 979-987.
[14]Bueding E, Fisher J. Metabolic requirements of schistosomes[J]. J Parasitol, 1982: 208-212.
[15]Camacho M, Agnew A. Glucose uptake rates bySchistosomamansoni,S.haematobium, andS.bovisadults using a flow in vitro culture system[J]. J Parasitol, 1995, 81(4): 637-640.
[16]Veerakumari L, Munuswamy N.Invitroeffect of some anthelmintics on lactate dehydrogenase activity of Cotylophoron cotylophorum (Digenea: Paramphistomidae)[J]. Vet Parasitol, 2000, 91(1): 129-140.
[17]Wu XS, Su DD, Cai WJ, et al. Research progress of gene engineering vaccine ofSchistosomajaponicum[J]. Hunan J Animal Sci Vet Med, 2007, (6): 1-3. (in Chinese)
伍小松,苏丁丁,蔡文杰,等.血吸虫基因工程疫苗研究进展[J].湖南畜牧兽医, 2007 (6):1-3.
[18]Harn DA, Mitsuyama M, Huguenel ED, et al. Identification by monoclonal antibody of a major (28 kDa) surface membrane antigen ofSchistosomamansoni[J]. Mol Biochem Parasitol, 1985, 16(3): 345-354.
[19]Harn DA, Gu W, Oligino LD, et al. A protective monoclonal antibody recognizes and alters the catalytic activity of schistosome triose-phosphate isomerase[J]. J Immunol, 1992, 148(2): 562-567.
[20]Wang YG, Dong H, Huang B. Progress in research on lactate dehydrogenase of parasites[J]. Chin J Anim Infect Dis, 2014, 22(1): 80-86. (in Chinese)
王艳歌,董辉,黄兵.寄生虫乳酸脱氢酶研究进展[J].中国动物传染病学报,2014, 22(1):80-86.
[21]Huxley HE. The mechanism of muscular contraction[J]. Science, 1969, 164(886): 1356-1365.
[22]MacGregor AN, Shore SJ. Immunocytochemistry of cytoskeletal proteins in adultSchistosomamansoni[J]. Int J Parasitol, 1990, 20(3): 279-284.
[23]Mehlhorn H, Becker B, Andrews P, et al.Invivoandinvitroexperiments on the effects of praziquantel onSchistosomamansoni. A light and electron microscopic study[J]. Arzneimittel-Forschung, 1981, 31(3a): 544-554.
[24]Tallima H, El Ridi R. Praziquantel bindsSchistosomamansoniadult worm actin[J]. Int J Antimicrob Agents, 2007, 29(5): 570-575.
[25]Matsumoto Y, Perry G, Levine RJC, et al. Paramyosin and actin in schistosomal teguments[J]. Nature, 1988, 333(6168): 76-78.
[26]Braschi S, Curwen RS, Ashton PD, et al. The tegument surface membranes of the human blood parasiteSchistosomamansoni: a proteomic analysis after differential extraction[J]. Proteomics, 2006, 6(5): 1471-1482.
[27]Day TA, Bennett JL, Pax RA. Praziquantel: the enigmatic antiparasitic[J]. Parasitol Today, 1992, 8(10): 342-344.
[28]Dong WF, Li YH, Yue WB. Progress in the study of thioredoxin[J]. Grass-Feeding Licestock, 2007, (4): 4-6. (in Chinese)
董文甫,李艳红,岳文斌.硫氧还蛋白研究进展[J].草食家畜,2007 (4): 4-6.
[29]Xiao SH. Study progress on the mode of action of praziquantel against schistosomes[J]. Chin J Parasitol Parasit Dis, 2008, 25(6): 492-502. (in Chinese)
肖树华.吡喹酮抗血吸虫作用的研究进展[J].中国寄生虫学与寄生虫病杂志,2008, 25(6): 492-502.
[30]Tang XN, Zhou PP, Gao XY, et al. Studies on immunization effects of single vaccine delivery system of biodegradable microspheres of recombinant glutathione -S-transferase fromSchistosomajaponicum[J]. Chin J Schisto Ctrl, 2007, 19(2): 98-101. (in Chinese)
唐小牛,周萍萍,高锡银,等.重组日本血吸虫谷胱甘肽-S-转移酶可生物降解微球单剂免疫效果的研究[J].中国血吸虫病防治杂志,2007,19(2): 98-101.
[31]Wu Z, Liu S, Zhang S, et al. Persistence of the protective immunity toSchistosomajaponicumin Chinese yellow cattle induced by recombinant 26 kDa glutathione-S-transferase (reSjc26GST)[J]. Vet Parasitol, 2004, 123(3): 167-177.
[32]Wang X, Gobert GN, Feng XG, et al. Analysis of early hepatic stage schistosomula gene expression by subtractive expressed sequence tags library[J]. Mol Biochem Parasitol, 2009, 166(1): 62-69.
[33]Maresca B, Carratu L. The biology of the heat shock response in parasites[J]. Parasitol Today, 1992, 8(8): 260-266.
[34]De Jong-Brink M. How schistosomes profit from the stress responses they elicit in their hosts[J]. Adv Parasitol, 1994, 35: 177-256.
[35]Kanamura HY, Hancock K, Rodrigues V, et al.Schistosomamansoniheat shock protein 70 elicits an early humoral immune response inS.mansoniinfected baboons[J]. Mem Inst Oswaldo Cruz, 2002, 97(5): 711-716.
[36]Yang J, Wu ZD. Research progress on heat shock protein 70s and schistosome -derived HSP70s[J]. Int J Med Parasit Dis, 2011, 39(6): 360-364. (in Chinese)
杨洁,吴忠道.热激蛋白 70 (HSP70) 及血吸虫 HSP70 研究进展[J].国际医学寄生虫病杂志, 2011, 39(6): 360-364.
[37]Yan YT, Liu SX, Song GC, et al. Screening and cloning of genes encodingSchistosomajaponicumantigens related to the serum antibodies inMirotusfortis[J]. Chin J Parasitol Parasit Dis, 2000, 19(3): 153-156.
[38]Hong Y, Peng J, Jiang W, et al. Proteomic analysis ofSchistosomajaponicumschistosomulum proteins that are differentially expressed among hosts differing in their susceptibility to the infection[J]. Mol Cell Proteomics, 2011, 10(8): M110. 006098. DOI: 10.1074/mcp.M110.006098
[39]Orlowski M, Wilk S. Ubiquitin-independent proteolytic functions of the proteasome[J]. ABB, 2003, 415(1): 1-5.
[40]Guerra-Sa R, Castro-Borges W, Evangelista EA, et al.Schistosomamansoni: Functional proteasomes are required for development in the vertebrate host[J]. Exp Parasitol, 2005, 109(4): 228-236.

