布氏菌苗皮内与划痕接种的效果评价
陈 成,魏 东,李恪梅,付丽丽,黄长江,王国治
布鲁氏菌简称布氏菌(Brucella),是革兰氏阴性,兼性胞内寄生菌,具有侵袭力强、传染途径多、引起多器官损伤的特点。布鲁氏菌病(简称布病)是一种由布鲁氏菌属引起的一类人兽共患疾病,严重威胁着人类和多种动物的生命安全[1]。据调查,全世界200多个国家和地区已经有170多个存在布病疫情[2-4],在我国布病波及28个省市区,并且近年疫情反弹,死灰复燃,每年造成近千万元的损失。
目前,虽然治疗布病主要使用抗生素,但是长期应用抗生素容易造成细菌耐药[5]。因此,预防接种布氏疫苗仍是我国目前预防布氏菌感染和传播最实际、最有效的方法[6]。疫苗接种的方法有滴鼻、注射、气雾及皮肤划痕等[7-8]。我国从1965年开始采用皮上划痕接种牛种弱毒株104M菌株[9]。该方法接种复杂,不能定量接种,常伴有局部或异常反应,被接种者皮肤有损伤和划痕时疼痛,遗留疤痕不易被接受。与皮上划痕比较,皮内注射接种方式具有定量接种、节省菌苗、操作简单,同时又能改善被接受者痛苦的优点。改善疫苗的免疫途径是疫苗研究的热点,国内外有学者对布氏疫苗免疫方法进行深入的研究和探索[10]。
本次研究对豚鼠进行皮内注射和皮上划痕两种方式免疫布氏菌活疫苗,通过体液免疫、细胞免疫和免疫保护力试验结果来比较两种免疫方式的免疫效果,为皮内注射布氏菌活疫苗取代传统人用皮上划痕布氏菌活疫苗提供实验依据。
1 材料与方法
1.1材料
1.1.1动物 SPF级Hartly豚鼠,雌性,300~350 g,共15只,由中国食品药品检定研究院(简称中检院)实验动物中心提供( 实验动物生产许可证号: SCXK( 京) 2009-0017) ,饲养于中国食品药品检定研究院清洁级动物室。
1.1.2菌种 皮内和划痕用布氏活疫苗为皮上划痕人用布氏菌活疫苗、羊布氏菌M5弱毒株均由中检院结核病疫苗室提供。
1.1.3变应原 Br-PPD蛋白,由中检院结核病疫苗室提供,制备方法见参考文献[11]。
1.1.4试剂 布氏菌培养基(脑心琼脂购自美国BD公司)、牛血清白蛋白(BSA)美国Sigma公司购进、碱性磷酸酶标记山羊抗豚鼠IgG(美国Bethyl公司)、pNPP底物显色液(SurModics)
1.1.5实验仪器 生物安全柜(telstar bio-Ⅱ-A)、酶标仪(Labsystems Dragon-MK3)、恒温培养箱(天津市泰斯特仪器-DH6000AB型)、高速离心机(德国eppendorf-5415D)
1.1.6实验耗材 15 mL离心管,50 mL离心管、96孔培养板。
1.2方法
1.2.1分组及免疫 将15只300~350 g体重SPF级豚鼠随机分成3组,每组5只。第1组为皮内注射组(5×107/只);第2组为皮上划痕组(9.5×109/只);第3组为阴性对照组(生理盐水)。皮内接种即先将豚鼠右大腿外侧脱毛,然后用酒精擦拭后,待酒精挥干,后肢皮内注射,剂量为100 μL/只;划痕接种即先将豚鼠右大腿外侧脱毛,然后用酒精擦拭后,待酒精挥干,用1 mL无菌注射器针头在免疫部位划#字,确保表皮开裂后,在#字上均匀涂布菌液50 μL/只,等待5 min后,用无菌医用干棉球吸干表面菌液完成免疫。
免疫4周后,对每只豚鼠进行心脏抽血,分离血清,-20 ℃保存,用于豚鼠ELISA抗体检测。
1.2.2抗体水平检测 用间接 ELISA法检测小鼠血清IgG的效价。以灭活布氏菌体5×108/mL的浓度包被96孔酶标板,4 ℃过夜;以PBST 300 μL 洗板5次,用1%的BSA封闭(200 μL/孔),37 ℃静置1 h;每孔加入100 μL的50×开始倍比稀释的待检血清,37 ℃静置1 h;按1∶2 500稀释的碱性磷酸酶标记山羊抗豚鼠IgG,洗板后100 μL/孔加入,37 ℃静置1 h;洗板,加入100 μL/孔的PNPP底物显色液,室温避光28 min后加入100 μL/孔终止液(3 mol/L的NaOH)终止反应;在波长为405 nm处检测吸光值A405。
1.2.3迟发型变态反应(DTH) 采血3 d后,暴露豚鼠背部皮肤,除毛,皮内注射PPD变态反应原,注射剂量均为每只30 μg,每点0.2 mL。注射24 h和48 h后分别观察注射部位出现红肿反应,并测量平均硬结反应直径,以纵、横直径相加除以2≥5 mm为阳性标准,计算阳性反应率。
1.2.4布鲁氏菌活苗免疫保护力检测 豚鼠皮肤实验3 d后,对每只豚鼠皮下攻击羊种布氏菌M5弱毒株,攻击剂量为5×108CFU/只,攻击部位为后肢皮下。3周后断颈处死豚鼠,无菌取脾脏,通过脾脏细菌计数比较布鲁氏菌活苗两种免疫方式的保护效果。
2 结 果
2.1血清中总IgG水平测定 两种方式免疫豚鼠均能产生高滴度抗体,与阴性对照组比较差异有统计学意义(F=593.628,P<0.05,n=15)。但皮内组与划痕组相比差异无统计学意义(t=0.365,P>0.05,n=10)。说明两种方式免疫产生的体液免疫效果无明显差异,结果见图1。
2.2迟发型变态反应试验结果(DTH) 皮内组和划痕组豚鼠针对PPD抗原24 h及48 h的DTH阳转率均为100%,结果见表1。
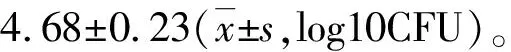
3 讨 论
两种方式免疫豚鼠抗体检测结果表明,体液免疫中的皮内注射组和皮上划痕组均能产生高滴度的IgG抗体,划痕组产生的抗体效价几何均数为11 143,皮内注射组抗体效价几何均数为9 700。从效价水平来看,划痕组略高于皮内组,经统计学分析,两者间差异无统计学意义。实验结果显示皮内注射免疫和皮上划痕免疫均能诱导较强的体液免疫应答,两者体液免疫效果相近。
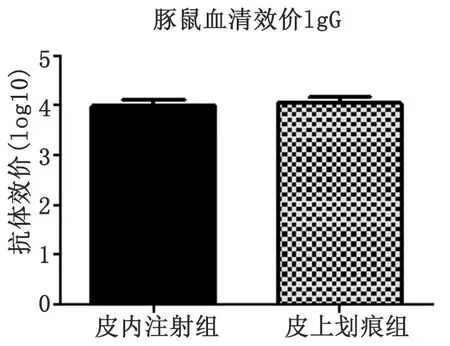
图1 血清IgG抗体效价
表1 Br-PPD免疫4周后皮肤试验结果
布氏菌是一种胞内寄生菌,寄生于单核巨噬细胞内,能够逃脱宿主细胞免疫系统的监视,所以细胞免疫是机体对抗布病主要的免疫方式[12]。皮肤变态反应又称迟发型变态反应,发挥其效应细胞有CD4+Th1细胞,CD8+或CD4+CTL,以及一部分巨噬细胞及中性粒细胞等[13]。皮肤迟发型超敏反应是进行体内细胞免疫评价的有效方法,本次试验结果显示皮内组和划痕组两种接种方式Br-PPD变应原DTH阳转率均为100%,表明两种方式免疫均能诱导机体产生较强的细胞免疫应答。
为评价两种免疫方式的保护效果,用羊布氏菌M5弱毒株攻击,阴性组豚鼠脾脏分离出大量的羊M5布氏活菌,皮内组和划痕组豚鼠脾脏均无羊M5布氏菌存在,表明两种方式免疫布氏菌活苗均可使豚鼠获得很强的免疫保护。
综上所述,通过体液免疫检测、细胞免疫评价和疫苗免疫保护力实验3个方面结果显示,两种方式免疫豚鼠获得免疫效果几乎相当,说明皮内注射接种有希望代替皮上划痕接种方法,至于能否真正取代传统接种方法,还有待强毒布鲁氏菌攻击保护试验和临床试验进一步研究。
参考文献:
[1]Jin NY, Hu ZM, Feng SZ, et al. New zoonoses[M]. Beijing: Science Press, 2007: 493-512. (in Chinese)
金宁一,胡仲明,冯书章,等.新编人兽共患病学[M].北京:科学出版社,2007:493-512.
[2]Zhao K, Zhang YH, Li HM, et al. Medical biology[M]. 2nded. Beijing: People’s Medical Publishing House, 2007: 641-650. (in Chinese)
赵铠,章以浩,李河民,等.医学生物制品学[M]. 2版.北京:人民卫生出版社,2007:641-650.
[3]Boschiroli ML, Foulongne V, O’Callaghan D. Brucellosis: a worldwide zoonosis[J]. Curr Opin Microbiol, 2001, 4(1): 58-64. DOI: 10.1164/rccm.200607-923ED
[4]Pappas G, Papadimitriou P, Akritidis N, et al. The new global map of human brucellosis[J]. Lancet Infect Dis, 2006, 6(2): 91-99. DOI:10.1083/jcb.200811079
[5]Ficht T. Brucella taxonomy and evolution[J]. Future Microbiol, 2010, 5(6): 859-866. DOI: 10.2217/fmb.10.52
[6]Yu H, Chen MJ, Wang JY, et al. Research progress of antiviral vaccines ofBrucellaantigen and immune protection[J]. Guangdong Agr Sci, 2011,24,102-104. (in Chinese)
玉花,陈敏洁,王晶妍,等.布鲁氏菌免疫保护抗原与抗病疫苗的研究进展[J].广东农业科学,2011,24,102-104.
[7]Guo ZL. Scientific application of animal vaccination method[J]. Anim Husb Vet Sci Technol Inform, 2010, 10: 5-11. (in Chinese)
郭昭林.动物接种疫苗方法的科学应用[[J].城市畜牧兽医科技信息,2010,10:5-11.
[8]Ye JL, Deng AG, Li QC. Introduce several common vaccination method[J]. Anim Husb, 2005(10):40 (in Chinese)
叶敬礼,邓爱国,李崎川.介绍几种常用疫苗接种方法[J].畜牧业,2005(10):40.
[9]Liu JF, Li KM, She FF, et al. XTT (Tetrazolium salt) assay for rapid determination of viable count ofBrucellavaccine[J]. Chin J Ctrl Endem Dis, 2011,26(2):103-106. (in Chinese)
刘景福,李恪梅,佘菲菲,等. XTT(四唑鎓盐)法快速检测布氏菌疫苗活菌含量的建立[J]. 中国地方病防治杂志, 2011,26(2):103-106.
[10]Pan SW, Chen SQ. Study ofBrucellavaccine approaches[J]. J Microbiol, 1958, 6(1): 79-81. (in Chinese)
潘绍武,陈世祺.布氏杆菌死菌疫苗免疫途径的研究[J].微生物报,1958,6(1):79-81.
[11]Li KM, Wang GZ, Huang J, et al. Study and preparation of the brucellin purified protein derivative[J]. Chin J Ctrl Endem Dis, 1995, 10(5): 268. (in Chinese)
李恪梅,王国治,黄健,等.布氏菌素纯蛋白衍生物的研制[J].中国地方病防治杂志,1995,10(5):268.
[12]Zhao ZP. Identification of virulence associated and immunogenic candidate protein ofBrucellamelitensisfor vaccine development[D]. Beijing: China Academy of Military Medical Science, 2008. (in Chinese)
赵忠鹏 .布鲁氏菌毒力、免疫相关分子的筛选研究[D].北京: 中国人民解放军军事医学科学院,2008.
[13]Gong FL. Medical immunology[M]. 3rd ed. Beijing: Science Press, 2009: 63-71.

