3,5-二溴-2,6-双(2’-噁唑啉基)苯基钯(Ⅱ)钳型物的合成及其催化Suzuki反应
刘 芳,彭 秒,王洪星
(天津大学理学院,天津 300072)
E^C^E钳型金属化合物是一类具有C—M(M=金属)键的稠合双环金属化合物(图1),由于其结构独特,且在空气中较为稳定,因而被广泛应用于各种有机合成反应中[1],此外,它还可以作为传感器、生物制剂(Biomaker)以及自组装的模板等[2]。E^C^E中与金属配位的E多是杂原子如N, P, S,也有一些氮杂卡宾(NHC),而金属除过渡金属外,也有一些主族金属。在众多的钳形化合物中,尤以NCN型居多,且配位原子多以亚胺、吡啶、咪唑啉、噁唑啉、胺、噻唑等形式出现。其中,噁唑啉又是其主要形式,其金属钳型物以铑, 钌等为主[3]。而双噁唑啉钳型钯化物的报道则相对较少[4]。虽然也有个别文献涉及到供电子基团的例子,但仅有的钳型钯化物多以无侧臂(side arm)即R1=R2=H的形式出现。由于侧臂的性质不仅影响到钳型钯化物的合成,而且影响所形成钯化物的催化效果,故本研究合成了带有拉电子基团侧臂即4,6-二溴取代的噁唑啉钳形钯化物,并考察该化合物对较难偶合的芳氯与苯硼酸的反应。
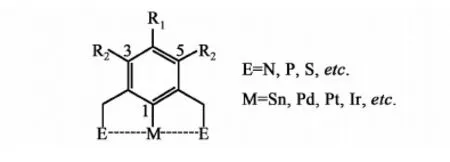
图1 钳形化合物的基本结构特征Fig.1 Basic skeleton of ECE pincer complexes
1 实验部分
1.1 仪器及试剂
熔点测定使用WRS-1A数字分析仪,元素分析采用PerkinElmer 2400-B元素分析仪,红外光谱为AVATAR 360 FT-IR光谱仪,核磁共振仪为Varian Mercury Plus 400,内标为Me4Si, 各种缩写代表: s, 单峰; d, 双重峰; t, 三重峰;q, 四重峰;br, 宽峰; m, 多重峰。4,6-二溴间苯二甲酸1参照文献合成[5-6],合成中其他各无机和有机试剂均来自国内。
1.2 钳形钯化物的合成
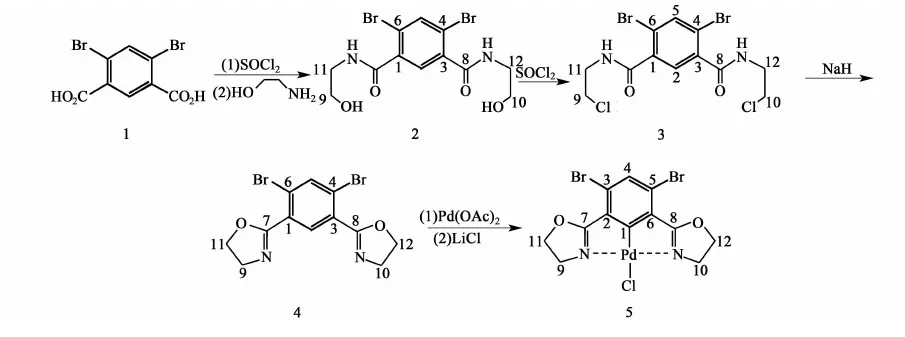
1.2.14,6-二溴-1,3-双(β-羟乙基)苯甲酰二胺的制备(2)
在100 mL圆底烧瓶中加入50 mL氯化亚砜和1滴DMF,室温搅拌30 min,称取2 g(6.2 mmol)化合物4,6-二溴间苯二甲酸1加入到圆底烧瓶中,加热回流12 h。反应完全后,旋蒸除去多余的氯化亚砜,之后用油泵抽24 h,尽量除尽氯化亚砜,得到浅黄色固体。
在氮气保护下,在三口瓶中加入上述浅黄色固体2 g(5.5 mmol),量取30 mL新蒸的THF,并在恒压滴液漏斗中加入3.2 g(32.9 mmol)三乙胺、0.81 g(12.2 mmol)乙醇胺和30 mL新蒸的THF溶剂,30 min内滴加完成,室温搅拌过夜。过滤得到白色固体,用水洗涤,烘干待用;将滤液旋蒸除去溶剂,加入二氯甲烷,溶液用盐水洗涤,有机相用无水硫酸钠干燥,旋出溶剂,得到白色固体,合并固体,用乙醇约40 mL重结晶,得到白色固体2,产率67%; m.p. 249~250 ℃,分子式 C12H14Br2N2O4,元素分析:实测C, 35.05; H, 3.40; N,6.79; 理论值:C, 35.15; H, 3.44; N, 6.83。IR (KBr):3242(s), 3 074(m), 2 973(m), 1 650(s), 1 588(s), 1 552(m), 1 461(m), 786(vs) cm-1。1H NMR (400 MHz, DMSO):δ8.51(t, 2H, N—H), 7.97(s, 1H, H3), 7.46(s, 1H, H4), 4.78(t, 2H, O—H), 3.50(m, 4H, H7),3.27(m, 4H, H6)。13C NMR (400 MHz, DMSO):δ41.97(C11, C12), 43.46(C9, 10), 125.23(C4, C6), 128.64(C2), 135.84(C5), 137.92(C1, C3), 165.93(C7, C8)。
1.2.24,6-二溴-1,3-双(β-氯乙基)苯甲酰二胺的制备(3)
称取2.14 g(5.9 mmol)化合物2加入到100 mL圆底烧瓶中,加入50 mL氯化亚砜,加热回流9 h。反应完毕后,旋出多余的二氯亚砜,得到黄色固体,将固体溶于水中,水相用二氯甲烷萃取,萃取液用无水硫酸钠干燥,旋出溶剂,残余物用V(乙酸乙酯)∶V(石油醚)(60~90 ℃)=10∶1的混合溶剂重结晶,得到浅黄色针状晶体3,产率: 87%; m.p.219~220 ℃。元素分析:分子式 C12H12Br2Cl2N2O2,实测C, 32.13; H, 2.69; N,6.19; 理论值:C, 32.25; H, 2.71; N, 6.27。IR (KBr):3 270(vs), 3 065(m), 2 969(m), 1 652(s), 1 584(m), 1 543(s), 1 041(m), 723(m) cm-1。1H NMR (400 MHz, CDCl3):δ8.36(t, N—H), 7.84(s, H3),7.68(s, H4), 3.81(t, 4H, H7), 3.46(t, 4H, H6)。13C NMR (400 MHz, CDCl3):δ42.04(C11, C12), 43.87(C9, 10), 125.31(C4, C6), 128.92(C2), 135.80(C5), 138.01(C1, C3), 165.43(C7, C8)。
1.2.34,6-二溴-1,3-双(2’-噁唑啉基)苯配体的制备(4)
在100 mL圆底烧瓶中加入0.21 g(8.9 mmol)氢化钠和40 mL的THF溶剂,在恒压滴液漏斗中加入0.74 g(2.3 mmol)化合物3的THF溶液,30 min内滴加完成,室温搅拌过夜。过滤,并浓缩溶液,剩余液用二氯甲烷(3×50 mL)萃取,萃取液用无水硫酸钠干燥,旋出溶剂,得到浅黄色固体,用V(乙酸乙酯)∶V(石油醚)(60~90 ℃)=10∶1的混合溶剂重结晶,得到浅黄色针状晶体4,产率: 84%; m.p. 217~219 ℃。分子式C12H10Br2N2O2, 实测C, 38.35; H, 2.69; N, 7.41;理论值:C, 38.53; H, 2.69; N, 7.49。IR (KBr):3 040(m), 2 973(m), 1 630(s), 1 588(s), 1 456(s), 1 301(m), 1 201(m), 613(w) cm-1。1H NMR (400 MHz, DMSO):δ8.20(s, 1H, H3), 8.05(s, 1H, H4), 4.42(t, 4H, H7), 4.00(t, 4H, H6)。13C NMR (400MHz, DMSO):δ54.99(C9, C10), 67.66(C11, C12), 125.78(C4, C6), 130.82(C2), 133.09(C5), 138.41(C1, C3), 165.89(C7, C8)。
1.2.4氯化[3,5-二溴-2,6-双(2’-噁唑啉基)]苯基钯(II)的制备(5)
在100 mL圆底烧瓶中加入119 mg(0.53 mmol)醋酸钯,加20 mL二氯甲烷使其溶解,将200 mg(0.53 mmol)化合物4溶于30 mL二氯甲烷加入到圆底烧瓶中,全部加完后加热回流5 h。反应毕后,抽滤,将溶液旋干,固体用甲醇、乙醚洗涤,抽滤并干燥得到黄色固体。
把得到的固体加入到250 mL三口瓶中,加入50 mL甲醇使其溶解。称取60 mg氯化锂,将其溶解到20 mL甲醇中,转移到恒压滴液漏斗中,30 min内滴加到三口瓶中,加热回流2 h,室温搅拌过夜,抽滤,得到黄色固体,固体分别用甲醇和乙醚洗涤,干燥。固体用V(二氯甲烷)∶V(乙醚)=7∶1的混合溶剂重结晶,得到黄色针状晶体5,产率为51%; m.p. 297~299 ℃。分子式 C12H9ClN2O2Pd, 实测C, 27.72; H, 1.74; N, 5.15;理论值:C, 27.99; H, 1.76; N, 5.44。IR (KBr):3 030(m), 2 915(m), 1 607(vs), 1 584(s), 1 458(m), 1 132(m), 1 056(m), 941(m), 800(m) cm-1。1H NMR (400 MHz, DMSO):δ7.88(s, 1H, H4), 4.58(t, 4H, H7), 4.14(t, 4H, H6)。13C NMR (400 MHz, DMSO): 56.05(C9, C10), 70.2(C11, C12), 125.88(C3, C5), 134.50(C4), 129.6(C2, C6), 167.08(C7, C8), 174.9(C1)。
1.3 钳形钯化物催化Suzuki反应
在50 mL的圆底烧瓶中加入15 mL的溶剂,2 mmol的氯代苯,苯基硼酸2.5 mmol,路易斯碱4.0 mmol,在一定温度下反应一定的时间。反应结束后旋出溶剂,经硅胶柱层析V(乙酸乙酯)∶V(石油醚)(60~90C)=1∶50,分离得到偶联产物。
2 结果与讨论
2.1 钯化物的合成及表征
合成噁唑啉通常有两条路线[7],其一是经双腈与乙醇胺直接缩合得到;第二条路线则是利用β-羟乙基间苯二甲酰胺与有机锡或脱水剂等的作用下得到。由于双腈不易制得,且第二条路线中的有机锡有一定毒性,故我们采用经过修饰的第二条路线(式1),即先将生成的双β-羟乙基间苯二甲酰胺2与氯化亚砜作用后生成双β-氯乙基间苯二甲酰胺3,然后在氢化钠的作用下经过自身关环最终生成较高收率的双噁唑啉4。4与醋酸钯在乙酸介质中回流,后经过与氯负离子离子交换,最终得到浅黄色的钳型钯化物5。化合物2~5的结构均经元素分析、红外、核磁证实。
2.2 环钯化合物在Suzuki反应中的催化
作为碳-碳偶联的Suzuki偶合是合成联苯化合物的最有效方法。以往的研究表明:各种形式的钯催化剂在催化碘苯(或溴苯)与苯硼酸的偶合时可得到高收率的偶合产物。相反,由于氯苯反应活性较差,其与苯硼酸的偶合相对困难。但取代氯苯有容易获得、价格便宜等优点,因此我们选择各种取代氯苯与苯硼酸进行偶合以考察钳型钯化物5的催化活性。
2.2.1优化条件的选择
以氯苯与苯硼酸的偶合反应为例(式2),考察反应时间、反应温度以及溶剂极性、催化剂用量等各种因素对反应结果的可能影响,有关结果见表1。
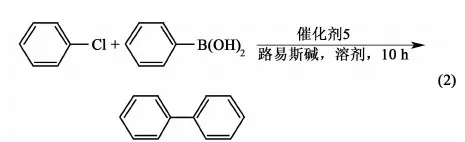
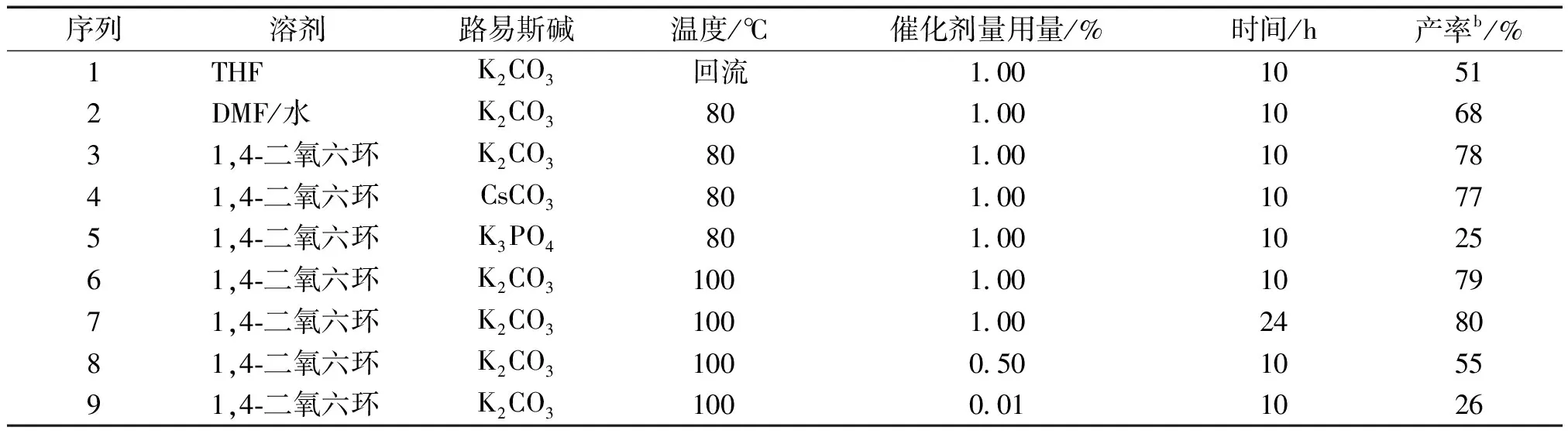
表1 溶剂、路易斯碱、反应时间、反应温度和催化剂量对Suzuki反应的影响aTable 1 Effects of solvent, Lewis base, time, temperature and catalyst loading in Suzuki reactiona
注:a反应条件:氯苯(2 mmol), 苯基硼酸(2.5 mmol), 路易斯碱(4 mmol), 溶剂(15 mL)。b分离产率。
表1清楚地表明:相对于THF和DMF/水,上述偶合在1,4-二氧六环溶剂中可获得较高收率(78%,序列3)。以1,4-二氧六环溶剂为溶剂,考察所需的碱发现,K2CO3与CsCO3均比K3PO4的偶合效果好(序列3~5),由于K2CO3与CsCO3二者的偶合收率非常接近(~78%),故选择碳酸钾为最终的碱。类似的,通过反应温度(序列3, 6)以及反应时间(序列6, 7)的对比可得出最适宜的温度和时间分别为80 ℃和10 h。在前述基础上,降低催化剂用量(摩尔分数)从1.00%到0.50%再到0.01%,催化收率急剧降低,预示1%的量即最适宜催化量。
综合以上各种因素,确定的最适宜反应条件为:催化剂量1.00%,1,4-二氧六环为溶剂,K2CO3为碱,80 ℃下反应10 h。
2.2.2各种氯苯与苯硼酸的偶合
在上述条件下,我们又考察了环钯化合物5催化的系列芳基卤化物和芳基硼酸的偶联反应(式3),其结果列于表2。
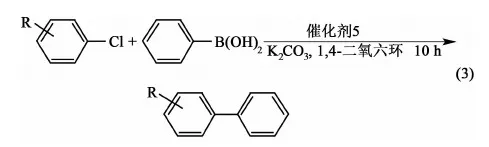

表2 钳型物5催化取代氯代苯和苯硼酸的Suzuki偶合反应aTable 2 Suzuki reaction of ArCl and C6H5B(OH)2 catalyzed by pincer complex 5
注:a反应条件: 钯化物5(1%), 卤代苯(2 mmol), 苯硼酸(2.5 mmol), 碳酸钾(4 mmol), 1,4-二氧六环(15 mL)。b实测熔点。c柱层析分离产率。
从表2中可以看出,除对氯苯胺的偶合外,总体上看其余取代氯苯的偶合收率普遍较高(序列2~7)。通过与其他钳形化合物对Suzuki偶合的催化效率看[8],本实验中的钳形化合物5具有较高的催化效率,这可能与该钳形化合物中溴原子的吸电子性能有关。由于在催化过程中,催化剂要经历一个Pd(II)/Pd(0)催化循环, 我们认为,钳形化合物5带有吸电子这一结构特点可能会对零价钯的形成起一定作用,因为吸电子基团使得钳形化合物5中的N—Pd配位键变得不牢固,更易断开。从电子效应的角度看,相较于带有吸电子基团的氯苯,钳形化合物5对催化带有供电子基团的氯苯的偶合(序列2, 3)更为有利,其最高收率达90%(序列3,表2)。其原因目前尚不清楚。而对氯苯胺偶合的收率最低,这可能因为在偶合过程中苯胺被空气中的氧气氧化所致。此外,采用具有空间位阻的5-叔丁基-2-氯-1,3-二甲苯与苯硼酸进行偶合(序列8),其收率约为75%,说明钳形钯化物5在催化过程中底物的空间障碍并不是偶合反应的决定因素。
3 结论
以带有吸电子基团的钳形钯化物为催化剂催化氯苯特别是那些带有供电子基团的氯苯与苯硼酸的偶合具有较好的催化效率。此外该型钯化物还具有催化底物广,反应条件温和,不需惰气保护等优点。
参考文献:
[1](a) Van der Boom M E, Milstein D. Cyclometalated phosphine-based pincer complexes: Mechanistic insight in catalysis, coordination, and bond activation[J]. Chem Rev, 2003, 103(5): 1 759-1 792
(b) Albrecht M. Cyclometalation using d-block transition metals: Fundamental aspects and recent trends[J]. Chem Rev, 2010, 110(2): 576-623
(c) Selander N, Szabo K J. Catalysis by palladium pincer complexes[J]. Chem Rev, 2011, 111(3): 2 048-2 076
(d) Chen R,Chen Y,Wang H X,etal. Cyclometalation of bisimines. Synthesis, characterization of 3, 5-dimethyl-2, 6-bis(N-arylimino)phenylpalladium (II) pincer complexes and their application in carbon-carbon cross coupling reactions[J]. 化学工业与工程, 2013, 30(6):15-26
(e)曹义春. 非对称NCN钳形钯化合物的合成及其催化的Sonogashira偶联反应[D]. 郑州:郑州大学,2011
[2](a) Rodriguez G, Albrecht M, Van Koten G,etal. Bifunctional pincer-type organometallics as substrates for organic transformations and as novel building blocks for polymetallic materials[J]. J Am Chem Soc, 2002, 124: 5 127-5 138
(b) Gagliardo M, Rodriguez G, van Koten G,etal. A novel heteroditopic terpyridine-pincer ligand as building block for mono-and heterometallic Pd(Ⅱ) and Ru(Ⅱ) complexes[J]. Inorg Chem, 2006, 45: 2 143-2 155
(c) Moughton A O, O’reilly R K. Noncovalently connected micelles, nanoparticles, and metal-functionalized nanocages using supramolecular self-assembly[J]. J Am Chem Soc, 2008, 130: 8 714-8 725
(d) Wieczorek B, Gebbink R J M K, Van Koten G,etal. Incorporating ECE-pincer metal complexes as functional building blocks in semisynthetic metalloenzymes, supramolecular polypeptide hybrids, tamoxifen derivatives, biomarkers and sensors[J]. J Organomet Chem, 2009, 694: 812-822
[3]Nishiyama H, Ito J. Bis(oxazolinyl)phenyl transition-metal complexes: Asymmetric catalysis and some reactions of the metals[J]. Chem Commun, 2010, 46: 203-212
[4](a) Bugarin A, Connell B T. A highly active and selective palladium pincer catalyst for the formation ofα-aryl ketones via cross-coupling[J]. Chem Commun, 2011, 47: 7 218-7 220
(b) Hatimi A E, Gómez M, Muller G,etal. Chiral bis(oxazoline) ligands. Synthesis of mono-and bi-metallic complexes of nickel and palladium[J]. J Chem Soc, Dalton Trans, 1998, 4 229-4 236
(c) Motoyama Y, Kawakami H, Nishiyama H,etal. Synthesis and X-ray crystal structures of bis(oxazolinyl)phenyl-derived chiral palladium(II) and platinum(II) and -(IV) complexes and their use in the catalytic asymmetric aldol-type condensation of isocyanides and aldehydes[J]. Organometallics, 2002, 21: 3 408-3 416
(d) Stark M A, Jones G, Richards C J. Cationic[2,6-bis(2’-oxazolinyl)phenyl]palladium(II) complexes: Catalysts for the asymmetric michael reaction[J]. Organometallics, 2000, 19: 1 282-1 291
(e) Bugarin A, Connell B T. Chiral nickel(II) and palladium(II) ncn-pincer complexes based on substituted benzene: Synthesis, structure, and lewis acidity[J]. Organometallics, 2008, 27: 4 357-4 369
[5]Richard B, Michael B H, Prnelope S J,etal. Dimorphs of[1,2-bis(diphenylphosphino)ethane] dichloronickel(II)[J]. J Chem Soc, Dalton Trans, 1993, 1: 3 767-3 770
[6]Corwin H, Sharon D R, Priscilla Y C J,etal. Substituent constants for correlation analysis[J]. J Med Chem, 1977, 20: 304-306
[7]Desimoni G, Faita G, Jorgensen K A. C2-Symmetric chiral bis(oxazoline) ligands in asymmetric catalysis[J]. Chem Rev, 2011, 111: 284-437
[8](a) Inamoto K, Kuroda J, Hiroya K,etal. Synthesis and catalytic activity of a pincer-type bis(imidazolin-2-ylidene) nickel(II) complex[J]. Organometallics, 2006, 25: 3 095-3 098
(b) Ines B, Sanmartin R, Dominguez E,etal. A nonsymmetric pincer-type palladium catalyst in Suzuki, Sonogashira, and Hiyama couplings in neat water[J]. Organometallics, 2008, 27: 2 833-2 839
(c) Luo Q, Tan J, Xiao D,etal. Suzuki-Miyaura coupling of aryl iodides, bromides, and chlorides catalyzed by bis(thiazole) pincer palladium complexes[J]. J Org Chem, 2012, 77: 8 332-8 337
(d) Lipke M C, Woloszynek R A, Protasiewicz J D,etal.m-Terphenyl anchored palladium diphosphinite PCP-pincer complexes that promote the Suzuki-Miyaura reaction under mild conditions[J]. Organometallics, 2009, 28: 188-196

