混合菌修复石油污染土壤
张 超,陈文兵,武道吉,魏天迪
(1. 山东建筑大学 市政与环境工程学院,山东 济南 250101;2.山东大学 微生物技术国家重点实验室,山东 济南 250100)
石油及其制品在生产、加工、运输和使用过程中产生的大量石油污染物进入环境,对土壤造成了严重污染,因此对石油污染土壤的治理已迫在眉睫[1-2]。石油污染土壤治理技术中,与物理修复、化学修复技术相比,微生物修复技术因其修复效果好、操作简便、费用低、降解过程迅速和无二次污染等特点,被广泛采用[3]。微生物修复技术的本质是通过微生物的代谢活动将污染物降解,修复过程所用的微生物多为土著微生物;若要提高修复效果,还需引入驯化的高效石油降解菌[4]。
相比于正交设计,均匀设计的主要优势是:在因素和水平数均较多的情况下,用较少的实验次数就可获得期望的结果,节省人力和物力,便于实施[5]。目前,国内还少见将均匀设计法用于石油污染土壤微生物修复技术的研究报道。
本工作采用从东营石油污染土壤中富集、分离出的4种高效石油降解菌,对模拟石油污染土壤进行微生物修复。在单菌种使用效果不理想的情况下,研究了多种高效石油降解菌混合使用的效果,确定了各菌的最佳配比及菌群的最优培养条件,并进一步从理化性质、酶活性和微生物种群数量方面比较了土壤经微生物修复前后的变化,为东营石油污染土壤微生物修复的现场应用提供了技术参考和理论支持。
1 实验部分
1.1 材料、试剂和仪器
原油:山东省东营市某炼油厂;土壤:山东省东营市东营未受污染的浅层(5~25 cm)土壤。土壤经破碎、除杂、混匀、筛分后,按原油与土壤质量比为1∶20混合均匀,制成模拟石油污染土壤(模拟土样),并将其密封储存在灭菌牛皮纸袋内冷藏备用。
LB培养基:酵母膏5 g/L,蛋白胨10 g/L,NaCl 5g/L,琼脂15 g/L;菌种(包括根瘤菌(A)、节细菌(B)、嗜盐菌(C)和芽孢杆菌(D)):实验室保藏;表面活性剂:主要成分为槐糖脂。
PHS-3型酸度计:上海精密科学仪器有限公司;721型可见光分光光度计:北京光学仪器厂。
1.2 实验方法
1.2.1 4种单菌与土著微生物石油降解率的比较
采用LB培养基保藏4种单菌。将模拟土样按每份50 g分别装入80个锥形瓶中,并将锥形瓶分成5组,每组16个。取其中4组分别以50.0 mL/kg的接种量加入A,B,C,D菌悬液,置于28 ℃恒温箱中。剩余1组未加菌种,作为对照样考察土著微生物的修复作用。每间隔一段时间取样,采用重量法测定土壤试样中石油的含量[6],计算石油降解率。
1.2.2 优势菌群的构建和最佳配比的确定
对4种菌进行2种、3种、4种的组合,分别将不同组合的混合菌按一定的接种量加入到模拟土样中,每组加入的混合菌菌悬液的总接种量均为50.0 mL/kg,各加入菌的接种量分别相等。在28 ℃的恒温箱中放置40 d后,测定土壤试样中石油的含量,计算石油降解率,从而构建出优势菌群。采用均匀设计法对优势菌群的配比进行优化。
1.2.3 培养条件优化实验
选取5个影响石油降解率的代表性因素:混合菌接种量、土壤含水率、鸡粪加入量、麦糠加入量和表面活性剂加入量,并将其控制在不同水平,采取均匀设计考察各因素对修复效果的影响。按确定的最佳配比将4种菌接种到石油污染土壤中,在28℃的恒温箱中放置40 d后,测定土壤试样中石油的含量,计算石油降解率。
1.3 分析方法
1.3.1 土壤理化性质测定方法
采用电位法测定土样pH,水与土的体积比为2.5;重铬酸钾容量法测定模拟土样的有机质含量[7];半微量凯氏法测定模拟土样的总氮含量[8];钼锑抗比色法测定模拟土样的总磷含量[9]。
1.3.2 土壤酶活性及微生物种群数量的测定
采用TTC法测定模拟土样中脱氢酶的活性[10],奈氏比色法测定脲酶的活性[11],邻苯三酚比色法测定多酚氧化酶的活性[12],高锰酸钾滴定法测定过氧化氢酶的活性[13];采用菌落形成单位CFU计数测定土壤的微生物种群数量[13]。
2 结果与讨论
2.1 4种单菌与土著微生物对石油降解率的影响
4种单菌与土著微生物对石油降解率的影响见图1。由图1可见:使用4种单菌时石油降解率的高低顺序为D>C>A>B,且均高于土著微生物;D菌处理40 d后,石油降解率达30.08%,而土著微生物处理40 d培养后的石油降解率仅为5.02%。
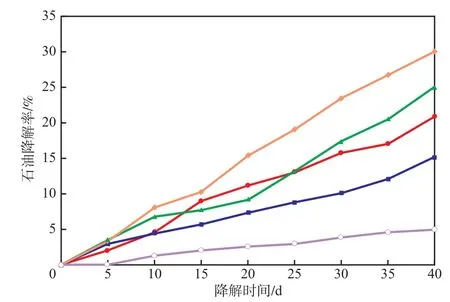
图1 4种单菌与土著微生物对石油降解率的影响
2.2 优势菌群的构建和最佳配比的确定
混合菌的配比对石油降解率的影响见表1。由表1可见,当A,B,C,D 4种菌混合使用时,石油 降解率最高,达到40.02%。
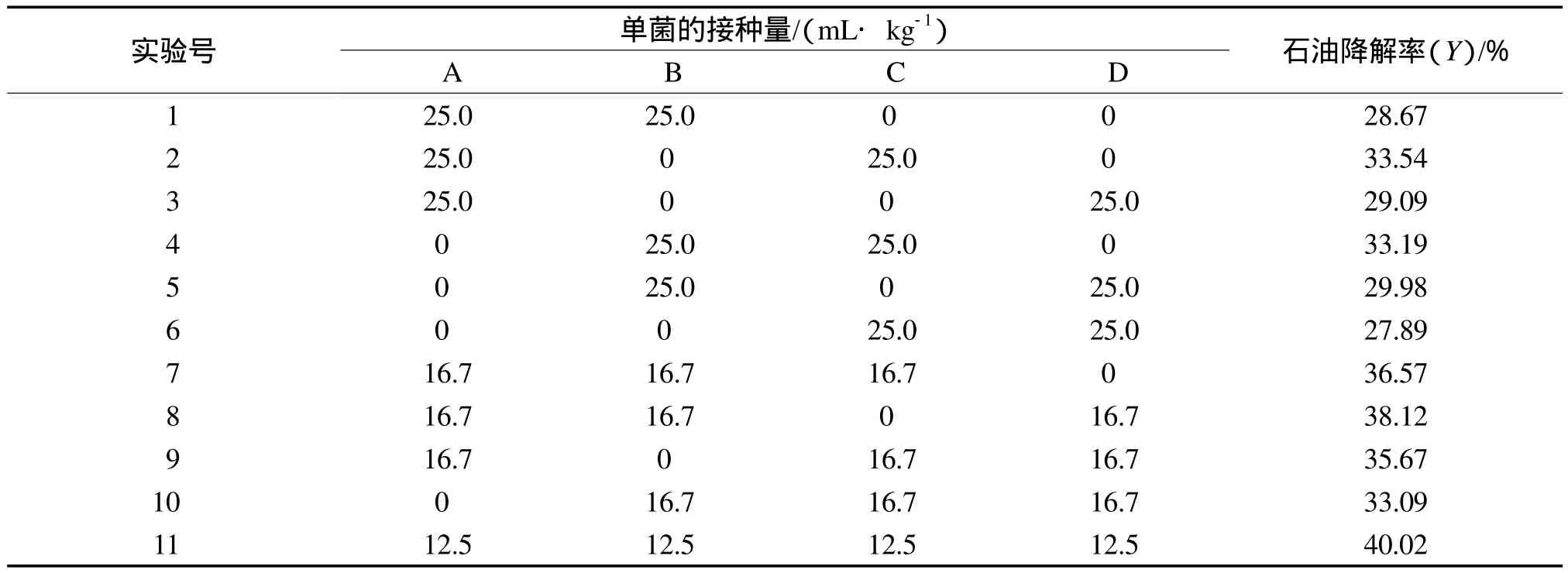
表1 混合菌的配比对石油降解率的影响
采用U11(114)均匀设计表进行实验,确定A,B,C,D 4种菌的最佳配比。U11(114)均匀设计的实验方案和结果见表2,其中:X1为A的质量分数,X2为B的质量分数,X3为C的质量分数,X4为D的质量分数。
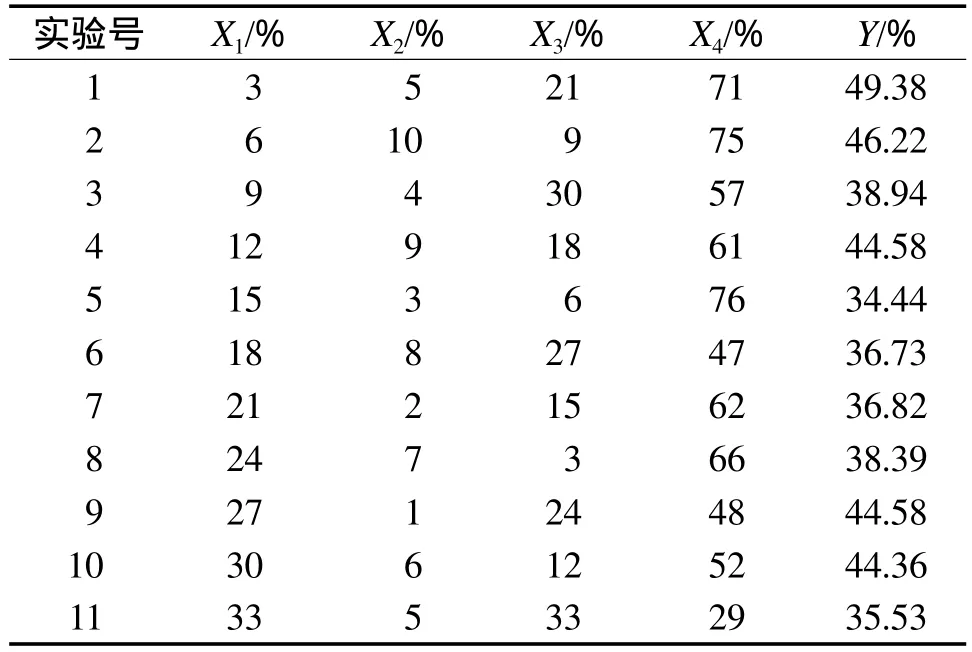
表2 U11(114)均匀设计的实验方案和结果
U11(114)均匀实验的数据处理采用Uniform Design 2.10软件,得出回归方程见式(1)。
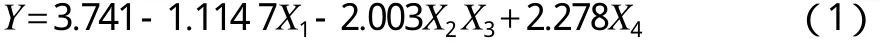
方差分析表中显著性水平为0.009<0.01,回归方程变量间关系是极显著的。混合菌的最佳配比为:X1=12%,X2=2%,X3=21%,X4=65%,预测最高石油降解率为54.30%。在最佳配比条件下进行验证实验,石油降解率为54.50%,与预测结果的误差为0.37%。实验值与预测值的误差在允许范围之内,说明均匀设计优化的菌种配比准确可信。
2.3 培养条件优化实验
采用U14(148)均匀设计表进行实验,研究各培养条件对石油降解率的影响。U14(148)均匀设计的实验方案和结果见表3。其中:U1为混合菌接种量,U2为土壤含水率,U3为鸡粪加入量,U4为麦糠加入量,U5为表面活性剂加入量。
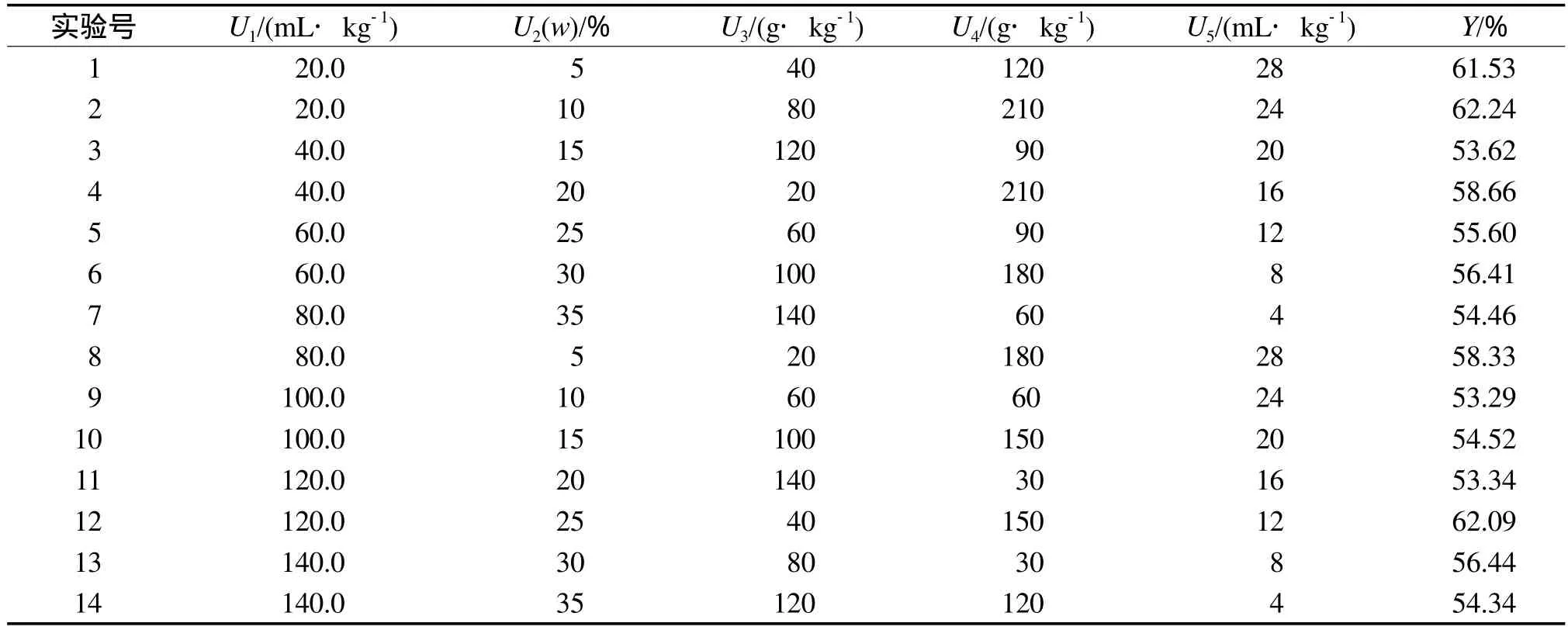
表3 U14(148)均匀设计的实验方案和结果
U14(148)均匀实验数据的处理采用Uniform Design 2.10软件,得出回归方程见式(2)。
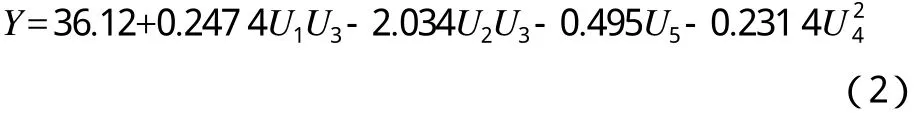
方差分析表中显著性水平为0.001<0.01,回归方程变量间关系是极显著的。菌群的最优培养条件为:混合菌接种量122.0 mL/kg、土壤含水率14%(w)、鸡粪加入量90 g/kg、麦糠加入量150 g/kg和表面活性剂加入量22 mL/kg,预测最高石油降解率为67.35%。在最优培养条件下进行验证实验,石油降解率为66.95%,与预测结果的误差为0.59%。实验值与预测值的误差在允许范围之内,说明均匀设计优化的菌群培养条件准确可信。
2.4 微生物修复前后土壤性质的对比
分别将未经处理的模拟土样、经土著微生物通风堆肥法处理的模拟土样、经混合菌处理(最佳配比及最优培养条件下)的模拟土样记作M1,M2,M3,考察微生物修复前后土壤理化性质、酶活性和微生物种群数量的变化。经过不同处理的模拟土样的性质见表4。
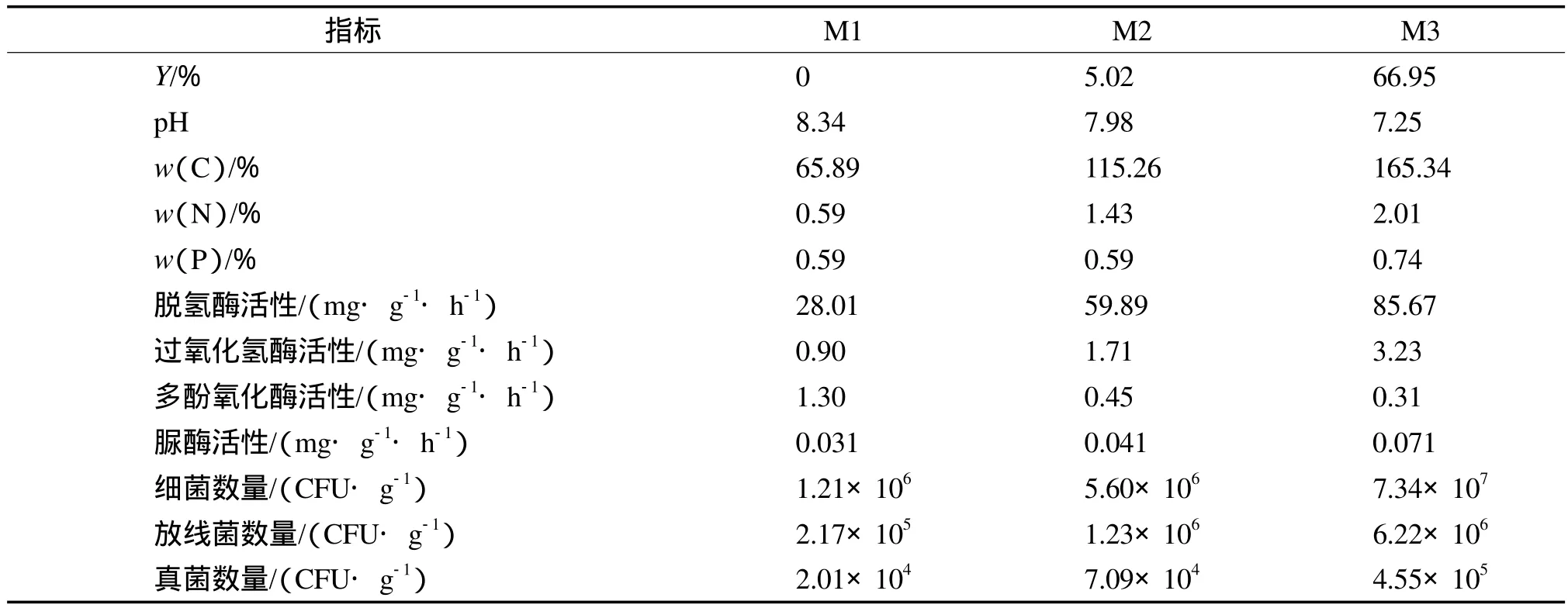
表4 经过不同处理的模拟土样的性质
由表4可见,M3的修复效果最好,石油降解率达66.95%,而M2的石油降解率仅为5.02%。由于M3在修复过程中投入了大量的营养物质,因此土样中有机质和总氮含量大幅提高;而M2的各指标变化则不如M3的明显。M3中脱氢酶和过氧化氢酶活性最高,这是由于在修复过程中土壤微生物大量繁殖,微生物参与了石油烃的降解过程,使得脱氢酶和过氧化氢酶活性提高。M3中的脲酶活性最高,说明土壤的氮元素转化能力强,有利于土壤中微生物的生长,为微生物参与石油烃的降解提供了充足的营养条件。而M2中各种酶活性的变化均不如M3中明显。M3在细菌、放线菌和真菌的数量方面均明显高于M1和M2,接近于自然界中实际的微生物数量。
3 结论
a)实验室保藏的A,B,C,D 4种高效石油降解菌均可提高微生物修复石油污染土壤的效果。单菌在40 d修复过程中的修复效果远远超出土著微生物,且4种单菌石油降解率的高低顺序为:D>C>A>B。
b)4种菌混合除油的效果最好,在最佳配比(X1=12%,X2=2%,X3=21%,X4=65%)条件下,40 d后土壤的石油降解率达54.50%。
c)菌群的最优培养条件为:混合菌接种量122.0 mL/kg、土壤含水率14%(w)、鸡粪加入量90 g/kg、麦糠加入量150 g/kg和表面活性剂加入量22 mL/kg;在此条件下,40 d后土壤的石油降解率达66.95%。
d)经混合菌修复的石油污染土壤,其肥力明显升高,脱氢酶、过氧化酶和脲酶的活性均升高,微生物数量也有明显增加。
[1] 马强,林爱军. 土壤中石油烃污染(TPH)的微生物降解与修复研究进展[J]. 生态毒理学报,2008,3(1):1-7.
[2] Harayama S. Microbial communities in oil contaminated seawater[J]. Environ Biotechnol,2004,15:205 -214.
[3] 张宝良,王宝辉,张昌兴. 土壤石油污染的生物修复技术[J]. 油气田地面工程,2007,26(3):9-14.
[4] 余萃,廖先清,刘子国. 石油污染土壤的微生物修复研究进展[J]. 湖北农业科学,2009,48(5):1260 -1263.
[5] 方开泰. 均匀设计与均匀设计表[M]. 北京:科学出版社,1994:34-35.
[6] 赵东风,吴伟林,张云波,等. 克拉玛依石油污染土壤生物修复的初步研究[J]. 石油学报,2012,28(4):696-704.
[7] Walkley A. An examination of degtjareff method for determining soil organic matter and aproposed modification of the chromic acid titration method[J]. Soil Sci,1934,37(1):29-37.
[8] Hesse P R. A Textbook of Soil Chemical Analysis[M].London:John Murray,1971:96-112.
[9] 鲁如坤. 土壤农业化学分析方法[M]. 南京:中国农业科技出版社,1999:154-170.
[10] Casida L E,Jr,Kleín D A,Santoro T. Soil dehydrogenase activity[J]. Soil Sci,1964,98(6):371 -376.
[11] Kandeler E,Gerber H. Short-term assay of soil urease activity using colorimetric determination of ammonium[J]. Biol Fertil Soil,1988,6(1):68-72.
[12] Alef K,Nannipieri P. Methods in Applied Soil Microbiology and Biochemistry[M]. London:Academic Press,1995:214-219.
[13] 关松萌. 土壤酶及其研究法[M]. 北京:科学出版社,1987:142-169.

