腹腔镜进展期胃癌根治术对患者免疫功能的影响
魏登文,刘宏斌,李洪涛,关泉林
(1.兰州大学第一临床医学院肿瘤外科,甘肃兰州 730000;2.兰州军区兰州总医院,甘肃兰州730050)
腹腔镜进展期胃癌根治术对患者免疫功能的影响
魏登文1,刘宏斌2,李洪涛2,关泉林1
(1.兰州大学第一临床医学院肿瘤外科,甘肃兰州 730000;2.兰州军区兰州总医院,甘肃兰州730050)
目的比较进展期胃癌根治术中腹腔镜与开腹手术两种术式对患者免疫功能的影响。方法对2012年6月至2013年4月兰州军区兰州总医院及兰州大学第一医院收治的100例进展期胃癌患者随机分为两组,A组(腹腔镜手术组)和B组(开腹手术组),每组各50例,比较两组术后免疫功能的变化及术中术后情况。结果两组患者均手术成功,无围手术期死亡病例,术后免疫检测显示(C3、C4、IgG、IgA、IgM),第24、72小时免疫指标变化较术前均有明显抑制,第72小时后逐渐恢复,但腹腔镜组术后变化平缓,较术前差异无统计学意义,开腹组术后免疫功能受到明显抑制。术后各时间节点两组患者CRP均升高,但开腹组升高更明显,与腹腔镜组比较,差异具有统计学意义。结论腹腔镜进展期胃癌根治术对患者术后免疫功能影响小,机体损伤小。
进展期胃癌;腹腔镜;免疫功能
目前,针对胃癌的治疗中,公认的最有效的措施仍为根治性切除,患者术后免疫功能与手术创伤的严重程度密切相关。近年来,腹腔镜手术在早期胃癌中应用的微创优势被逐渐认同[1],但目前国内外对进展期胃癌采用腹腔镜根治术的相关报道较少。在我国,临床上胃癌患者就诊时大多为进展期,且多数伴有营养不良等情况,这将进一步加重患者的免疫功能低下。本研究对100例进展期胃癌患者随机分为腹腔镜手术组及开腹手组,对两组患者进行围手术期免疫检测,分析临床资料,探讨在进展期胃癌中,腹腔镜与开腹两种胃癌根治方式对患者免疫功能的影响。
1 资料与方法
1.1 一般资料选取2012年6月至2013年4月兰州军区兰州总医院及兰州大学第一医院收治的100例进展期胃癌患者,随机将其分为腹腔镜组及开腹组,每组各50例。纳入标准:(1)进展期胃癌;(2)IV期以下;(3)ASA分级2级以下,包含2级(American Society of Anesthesiologists)[2];(4)术前未接受新辅助化疗;(5)食管下段无肿瘤侵犯;(6)既往无腹部手术史;(7)年龄小于70岁。所有患者术前经超声胃镜及病理证实为进展期胃癌,其中男性65例,女性35例;年龄22~69岁,平均(59.2±3.1)岁。两组患者的性别、年龄、肿瘤大小、TNM分期等一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 两组患者的临床资料比较(例,±S)
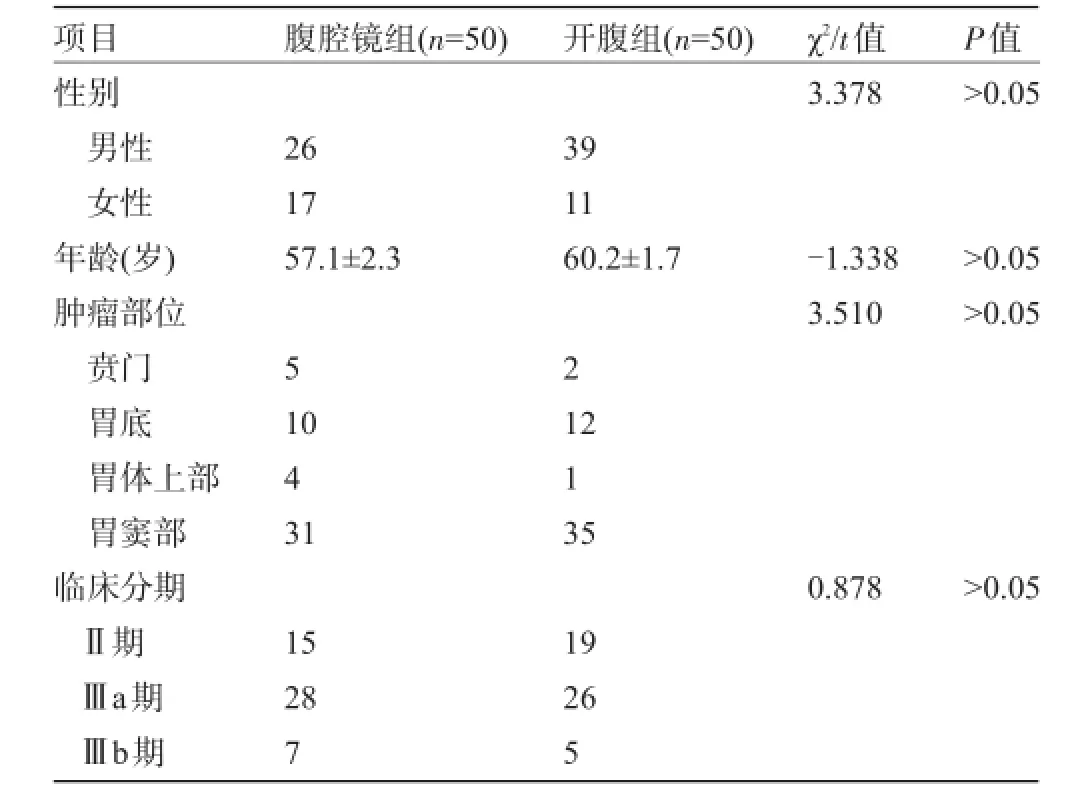
表1 两组患者的临床资料比较(例,±S)
腹腔镜组(n=50)开腹组(n=50)项目性别男性女性年龄(岁)肿瘤部位贲门胃底胃体上部胃窦部临床分期Ⅱ期Ⅲa期Ⅲb期χ2/t值3.378 P值>0.05 26 17 57.1±2.3 39 11 60.2±1.7-1.338 3.510>0.05>0.05 5 2 10 4 31 12 1 35 0.878>0.05 15 28 7 19 26 5
1.2 手术方法(1)腹腔镜组:气管插管全麻,采用5孔法操作,术者位于患者左侧,CO2气腹压力控制为12 mmHg(1 mmHg=0.133 kPa),均行D2淋巴结清扫,淋巴结清扫使用超声刀,消化道重建使用吻合器。标本经上腹部小切口取出。(2)开腹组:气管插管全麻,取上腹部正中绕脐左旁切口,均行D2淋巴结清扫,消化道重建使用吻合器。按照传统方法进行。
1.3 观察指标所有患者均于术前1 d(D0)、术后第1(D1)、3(D3)、7天(D7)采肘静脉血,检测补体C3、补体C4、免疫球蛋白IgG、免疫球蛋白IgA、免疫球蛋白IgM及C反应蛋白(CRP)值等免疫指标。
1.4 检测方法采用免疫比浊法,主要仪器为美国BECKMAN COULTER IMMAGE800特种蛋白分析仪,主要试剂盒为美国Immag Immunochemistry System Complent C3、C4、IgG、IgA、IgM、CRP。
1.5 统计学方法采用SPSS17.0软件进行统计学处理,计量资料以均数±标准差(±S)表示,组间比较采用t检验,计数比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者C3、C4水平比较两组患者术前1 d外周血C3、C4水平比较差异无统计学意义,术后两组病例C3、C4水平均有下降,但腹腔镜组C3、C4在术后各时间点监测变化较开腹组平缓,见表2、图1和图2。
表2 两组围手术期C3、C4水平比较(±S,mg/dl)
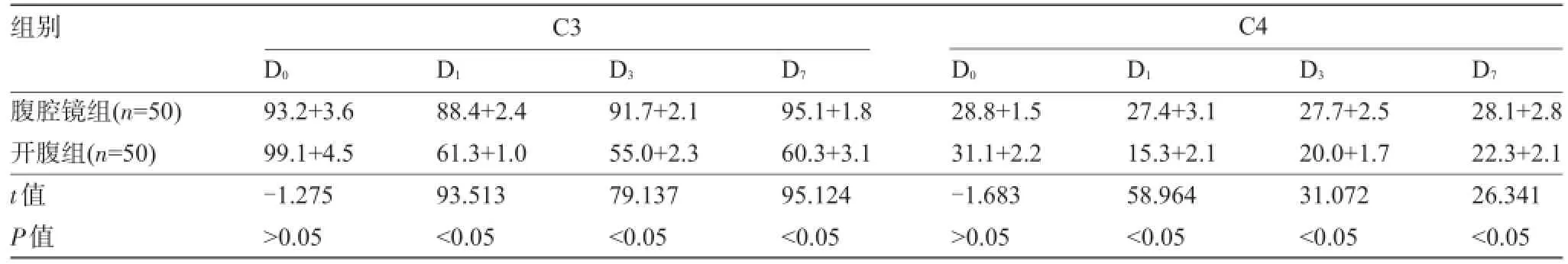
表2 两组围手术期C3、C4水平比较(±S,mg/dl)
组别C3 C4 D0D1D3D7D0D1D3D7腹腔镜组(n=50)开腹组(n=50) t值P值93.2+3.6 99.1+4.5 -1.275>0.05 88.4+2.4 61.3+1.0 93.513<0.05 91.7+2.1 55.0+2.3 79.137<0.05 95.1+1.8 60.3+3.1 95.124<0.05 28.8+1.5 31.1+2.2 -1.683>0.05 27.4+3.1 15.3+2.1 58.964<0.05 27.7+2.5 20.0+1.7 31.072<0.05 28.1+2.8 22.3+2.1 26.341<0.05

图1 两组围手术期的C3水平变化

图2 两组围手术期的C4水平变化
2.2 两组患者IgG、IgA、IgM水平比较两组术后第1天两组各项免疫指标水平均有下降,术后第3天起,两组各免疫指标均开始回升,但开腹组回升缓慢,术后第7天,腹腔镜组各免疫指标均已接近术前,见表3、图3、图4和图5。
2.3 两组患者的CRP水平比较术前两组血CRP水平差异无统计学意义,术后第1天两组患者血CRP均明显升高,术后第3天起,腹腔镜组血CRP已开始明显回落,开腹组血CRP仍处于较高水平,见表4和图6。
表3 两组患者围手术期IgG、IgA、IgM水平比较(±S,mg/dl)
组别IgGIgA IgM D0D1D3D7D0D1D3D7D0D1D3D7腹腔镜组(n=50)开腹组(n=50) t值P值817.5+10.6543.4+12.4787.7+12.11950.8+13.8182.8+13.5153.4+13.1 829.1+14.5562.3+11.0557.0+13.2600.3+13.1191.1+12.2 177.6+12.5188.1+12.8111.0+9.778.4+11.071.3+7.9119.5+10.3 149.3+17.1 -1.688>0.05 -2.813<0.05 58.341<0.05 46.152<0.05 -1.241>0.05 151.0+11.7162.3+12.7121.3+10.881.1+9.975.7+10.481.2+8.3 0.883>0.05 5.672<0.05 16.439<0.05 -1.862>0.05 -0.834>0.05 -0.573>0.05 5.642<0.05

图3 两组围手术期IgG水平变化
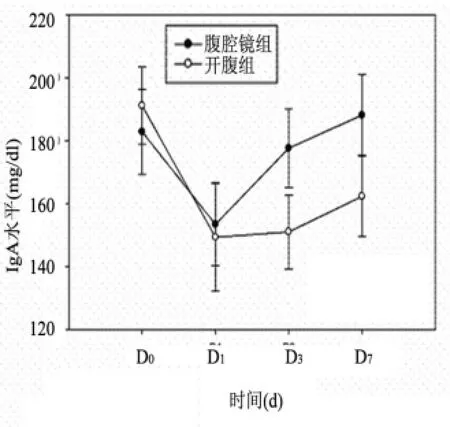
图4 两组围手术期IgA水平变化

图5 两组围手术期IgM水平变化
表4 两组患者围手术期的CRP水平比较(±S)

表4 两组患者围手术期的CRP水平比较(±S)
组别CRP(mg/dl) D0D1D3D7腹腔镜组(n=50)开腹组(n=50) t值P值0.98+0.33 0.77+0.17 0.992>0.05 6.93+1.79 7.33+3.88 -1.735>0.05 8.80+2.57 19.27+2.10 -86.413<0.05 2.70+1.09 10.65+2.57 -99.642<0.05

图6 两组围手术期的CRP水平变化
3 讨论
肿瘤的发生、发展与机体免疫功能密切相关[3],机体对肿瘤细胞的免疫作用主要由T细胞参与的细胞免疫完成[4]。但作为机体重要免疫效应系统之一的补体系统,可通过多种途径引起不同的炎症反应。补体广泛参与机体的防御反应及免疫调节,也可介导免疫病理学的损伤性反应,是体内具有重要生物学意义的效应系统和效应放大系统[5]。随着肿瘤免疫治疗研究的进展,补体在肿瘤免疫中的作用越来越被重视。有研究显示补体可通过改变肿瘤细胞微环境而促进肿瘤生长[6]。
血清免疫球蛋白是由B淋巴细胞被抗原激活后分化成熟为装细胞后而合成和分泌的,主要分布于血液、体液和黏膜分泌液中,介导体液免疫。血清中免疫球蛋白的水平通常与机体的抗感染能力、营养状态、创伤及炎症反应等因素有关。有研究显示补体与体液免疫功能可因手术创伤、应激反应而受到抑制,手术后患者体内的C3、C4、IgG、IgA、IgM水平均有不同程度的降低[7]。人类的免疫球蛋白有IgG、IgA、IgM、IgD和IgE五类,是体液免疫的主要效应分子,其中IgD和IgE在体内的含量极低,通常不作为检测对象。
C反应蛋白的升高与手术创伤、应激反应的严重程度密切相关[8],被认为是机体在遭受感染、创伤后反应最为敏感的一种急性时相蛋白,在补体的激活中发挥着重要的作用。近年来,CRP除作为反映炎症、应激反应严重程度的一种重要标志物外,Nozoe等[9]报道胃癌患者围手术期血清CRP水平的高低可以作为胃癌预后判断的一个独立指标。现阶段,在进展期胃癌的治疗措施中,根治性切除仍被公认为是首选方法。病灶的清除,降低了机体肿瘤负荷,使得肿瘤细胞直接诱导的免疫抑制得以缓解,一定程度上改善了患者的免疫状况。然而,大量炎性物质会随着手术创伤而释放,如白细胞介素-6(IL-6)、肿瘤坏死因子(TNF-α)等,诱导全身炎症反应的发生,肿瘤患者机体的免疫功能将进一步受到抑制,增加了感染和器官功能不全等并发症的发生率[10-11]。此外,肿瘤的扩散、复发及转移很大程度上与术后机体免疫功能的下降密切相关。因此,术后机体免疫功能的快速重建,对于其术后恢复及生活质量的提高均具有明显的意义[12]。
手术创伤的大小与术后恢复情况密切相关。目前,以腹腔镜技术为代表的微创外科技术已逐步应用到早期胃癌的治疗[13-16]。Kehlet[17]总结分析报道腹腔镜手术与传统开腹手术相比,炎症反应、免疫功能损害明显减轻。Wichinann等[18]研究显示患者术后的快速康复可以更好地保护细胞介导的免疫功能。但在进展期胃癌根治术中,腹腔镜技术是否能达到同样的效果,有待进一步研究。
本研究中,两组不同时间点血C3、C4水平比较显示,术后两组血C3、C4水平均有下降,提示手术创伤、应激反应对患者补体系统具有明显的抑制作用,但术后各时间点相比较,腹腔镜组术后血C3、C4水平变化较开组组小,术后各时间点相比较差异具有统计学意义,提示腹腔镜手术对术后机体补体系统抑制减轻。
两组不同时间点血IgG、IgA、IgM水平比较显示,术后两组血IgG、IgA、IgM水平均有下降,提示手术创伤对患者免疫系统具有明显的抑制作用,但术后各时间点相比较,腹腔镜组术后各时间点IgG水平均高于开腹组,术后第3天,腹腔镜组IgM均高于开腹组,术后第7天相比较,腹腔镜组IgG、IgA、IgM水平均已达到或接近术前水平,但开腹组仍处于抑制状态,两组相比较差异具有统计学意义。提示相比腹腔镜手术,传统开腹手术对患者术后免疫功能抑制时间长,而采用腹腔镜方法,患者术后免疫功能重建时间快。
两组不同时间点血CRP水平的比较显示,在术后第1天两组血清CRP均增高,提示手术创伤引起机体的炎症应激反应,第3天左右两组均达到最高值,但开腹组血CRP水平更高,两组差异具有统计学意义。腹腔镜组血CRP在术后第7天左右恢复接近术前水平,开腹组虽有回落,但回落缓慢,仍处于较高水平,差异具有统计学意义。提示进展期胃癌选用传统的开腹手术创伤大,术后炎症应激反应重,而选用腹腔方法可减轻患者的创伤,减轻围手术期炎症应激反应。
综上所述,对于进展期胃癌,采用传统的开腹胃癌根治术手术创伤大,术后炎症应激反应重,而采用腹腔镜手术方法可减轻围手术期炎症应激反应,且腹腔镜手术对患者术后早期免疫抑制减轻,体液免疫功能重建加快。
此外,腹腔镜手术需建立CO2气腹,是否会造成腹腔脱落细胞的增加,且CO2气腹对患者的血流动力学及内环境的变化具有一定的影响,能否造成肿瘤腹膜微转移及穿刺孔转移尚待进一步研究。
参考资料:
[1]Lee JH,Han HS,Lee JH.A prospective randomized study comparing open vs laparoscopy-assisted distal gastrectomy in early gastric cancer:early results[J].Surg Enosc,2005,19(2):168-173.
[2]American Society of Anesthesiologists.New classification of physicalstatus[J].Anesthesiology,1963,24:111.
[3]Na YM,Kim MY,Kim YK,et al.Exercise therapy effect on natural killer cell cytotoxic activity in stomach cancer patients after curative surgery[J].Arch Phys MedRehabil,2000,81:777-779.
[4]夏铭,杨廷旭,王伟,等.胃癌患者T细胞亚群变化的临床意义[J].临床医学,2009,29(1):105-106.
[5]林治华,万瑾,谢伟.补体系统与肿瘤免疫[J].重庆理工大学学报(自然科学),2010,24(5):33-36.
[6]Markiewski MM,DeAngelis RA,Benencia F,et al.Modulation of the antitumor immune response by complement[J].Nat Immunol, 2008,9:1225-1235.
[7]孔营,周岩冰,王东升,等.加速康复外科对胃癌手术病人体液免疫和临床指标的影响[J].肠外与肠内营养,2009,16(4):205-208.
[8]Nishiguchi K,Okuda J,Toyoda M,et al.Comparative evaluation of surgicalstress of laparoscopic and open surgeries for colorectal carcinoma[J].Dis Colon Rectum,2001,44:223-230.
[9]Nozoe T,Iguchi T,Adachi E,et al.Preoperative elevation of serum C-reactive protein as an independent prognostic indicator for gastric cancer[J].Surg Today,2011,41:510-513.
[10]江志伟,李宁.肠内免疫营养对胃癌手术病人免疫功能和急性炎性反应的调理作用[J].肠外与肠内营养,2000,7(4):200-203.
[11]Tashiro T,Yamamori H,Takagi K,et al.Changes in immune function following surgery for esophageal carcinoma[J].Nutrition, 1999,15:760-766.
[12]Muller AJ,Scherle PA.Targeting the mechanisms of tumoral immune tolerance with small-molecule inhibitors[J].Nat Rev Cancer, 2006,6(8):613-625.
[13]Kitano S,Shirashi N,Uyama I,etal.A multicenter study on oncologic outcome of laparoscopic gastrectomy for early cancer in Japan [J].Ann Surg,2007,245(1):68-72.
[14]Tanimura S,Higashino M,Fukunaga Y,et al.Laparoscopic gastrectomy for gastric cancer:experience with more than 600 cases[J]. Surg Endosc,2008,22(5):1161-1164.
[15]王家镔,黄昌明,郑朝辉,等.腹腔镜胃癌D2根治术218例疗效评价[J].中华外科杂志,2010,48(7):502-505.
[16]何庆良,王家兴,石铮,等.高龄胃癌患者腹腔镜胃切除术安全性与近期疗效[J].中国普通外科杂志,2012,21(10):1196-1200.
[17]Kehlet H.Surgical stress response:does endoscopic surgery confer an advantage[J].World J Surg,1999,23:801-807.
[18]Wichmann MW,Eben R,Angele MK,et al.Fast-track rehabilitation in elective colorectal surgery patients:a prospective clinical and immunological single-centrestudy[J].ANZ J Surg,2007,77: 502-507.
Influence of laparoscopic radical-resection on immune function in patients with advanced gastric cancer.
WEI Deng-wen1,LIU Hong-bin2,LI Hong-tao2,GUAN Quan-lin1.1.Department of Surgical Oncology,the First Affiliated Hospital of Lanzhou University,Lanzhou 730000,Gansu,CHINA;2.General Hospital of Lanzhou Command of PLA, Lanzhou 730050,Gansu,CHINA
ObjectiveTo compare the influence of laparoscopic radical-resection and laparotomy on immune function in patients with advanced gastric cancer.MethodsOne hundred patients with advanced gastric cancer from June 2012 to April 2013 in General Hospital of Lanzhou Command of PLA and the First Affiliated Hospital of Lanzhou University were randomly divided into group A(laparoscope group)and group B(laparotomy group). There were 50 patients in each group.The postoperative changes of immune function between these two groups were compared.ResultsOperations of patients in both groups were successful and there was no perioperative death case.Our data showed that the levels of C3,C4,IgG,IgA and IgM in blood were significantly inhabited 24 and 72 hours after operation.After 72 hours,the immune function gradually recovered.In laparoscope group,the immune function changed smoothly after operation and there was no statistical significance before and after the operation.The immune function was significantly inhabited in group B after operation.The levels of CRP of patients in two groups increased after surgery at different time points.Notably,we found that the increase of CRP level in group B was statisticaly significantly higher than that in group A.ConclusionLaparoscopic radical-resection has lower effect on immune function and lower body damage for patients with advanced gastric cancer.
Advanced gastric cancer;Laparoscope;Immune function
R735.2
A
1003—6350(2014)20—2989—04
10.3969/j.issn.1003-6350.2014.20.1176
2014-04-15)
国家科技部、财政部科技惠民计划(编号:2012GS620101);甘肃省科技重大专项(编号:2011GS04390)
关泉林。E-mail:guanquanlin@163.com

