人源性防御素HD-5的原核表达及抗真菌作用的初步研究
张萍萍 尹利荣△ 王 芳 孙 蓓 霍 彦
人源性防御素HD-5的原核表达及抗真菌作用的初步研究
张萍萍1尹利荣1△王 芳1孙 蓓2霍 彦3
目的 构建pQE-30Xa/HD-5原核表达载体,纯化重组蛋白并进行抗真菌活性的初步鉴定。方法以pcDNA3.1(+)/HD-5为模板,聚合酶链反应(PCR)扩增编码HD-5成熟肽的基因。构建pQE-30Xa/HD-5重组表达载体,并对重组质粒进行酶切、基因序列分析。将鉴定正确的质粒转化入大肠杆菌M15后进行异丙基-D-硫代半乳糖苷(IPTG)诱导表达,对表达产物进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定。通过镍柱亲和层析纯化蛋白并进行蛋白复性,蛋白免疫印迹(Western blot)鉴定纯化产物。以KB纸片法初步验证纯化获得的重组蛋白对白色假丝酵母菌的抑菌活性。结果成功克隆了HD-5基因并构建了重组质粒pQE-30Xa/HD-5。重组质粒在大肠杆菌M15中诱导表达出HD-5融合蛋白;Western blot分析结果显示纯化后的融合蛋白与目的蛋白相符;KB纸片法证实纯化后的融合蛋白对白色假丝酵母菌具有一定的抑菌活性。结论成功构建HD-5原核表达载体,经诱导表达后纯化获得具有良好抑菌活性的HD-5融合蛋白。
防御素类;重组融合蛋白质类;大肠杆菌;防御素-5;原核表达;亲和层析;抗真菌活性
近年来,随着广谱抗菌药物、各类激素等的广泛使用,外阴阴道假丝酵母菌病(vulvovaginal candidiasis,VVC)的发病率及复发率逐年升高,严重影响女性的身心健康。防御素因其相对分子质量小、对热稳定、抗微生物范围广、不易产生耐药性等明显优于传统抗生素的特点,成为抗生素替代的首选。防御素HD-5(human alpha-defensin 5)在女性生殖道上皮包括阴道、宫颈及输卵管的上皮细胞均有表达与分泌。其与生殖道的感染性疾病密切相关也得到了证实[1]。但HD-5的来源少,提取困难,成为HD-5进一步研究及应用的瓶颈。近年来,国内外学者虽通过真核表达体系获得HD-5蛋白,但仍存在蛋白提纯困难等问题。本研究通过原核表达体系对HD-5进行融合表达与纯化,并对融合蛋白的抗真菌活性进行初步鉴定,为获取HD-5活性蛋白提供实验基础,为HD-5的进一步研究提供条件。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株 pQE-30Xa质粒、大肠杆菌M15菌株(E.coli M15)均为天津医科大学内分泌研究所保存。pcDNA3.1(+)/HD-5为天津医科大学内分泌研究所构建并经DNA序列分析正确。标准白色假丝酵母菌株ATCC-90028由北京中原公司从ATCC购进。
1.1.2 主要试剂 KOD-Plus高保真DNA聚合酶、限制性内切酶Kpn I和HindⅢ、T4 DNA连接酶、DNA Marker DL2000 Plus购自TaKaRa公司,小鼠抗His标签抗体,辣根过氧化物酶(HRP)标记山羊抗小鼠抗体购自中杉金桥生物公司。凝胶回收试剂盒(Gel Extraction Kit)、质粒小量提取试剂盒(Plasmid Mini Kit)购自OMEGA公司,镍离子金属螯合亲和层析介质(nickel-nitrilotriacetic acid,Ni-NTA)亲和层析蛋白纯化柱料购自GeneScript公司;一步法细菌活性蛋白提取试剂盒购自上海生工生物有限公司。其余均为国产分析纯。
1.2 方法
1.2.1 编码HD-5成熟肽的基因克隆 根据GenBank上编码HD-5成熟肽的基因(NM_021010.1),采用Gene runner软件设计合成上下游引物,两端分别加入了Kpn I和HindⅢ两个酶切识别序列。阴影部分为酶切位点,引物由北京奥科鼎盛生物公司合成。上游引物(p1):5′-CGGGGTACCATGAGGACCATCGCC-3′;下游引物(p2):5′-CCCAAGCTTGCGACAGCAGAGTCT-3′。以p1、p2为引物,pcDNA3.1(+)/HD-5为模板,进行PCR扩增。PCR反应条件:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸20 s,35个循环,72℃10 min终止反应。扩增结束后以1.2%琼脂糖凝胶电泳分析PCR产物。
1.2.2 重组表达载体pQE-30Xa/HD-5的构建及鉴定 将质粒pQE-30Xa与HD-5 PCR产物分别用Kpn I和HindⅢ进行双酶切后以T4 DNA连接酶于37℃连接30 min。将连接产物转化E.coli M15,挑取氨苄青霉素(Amp)筛选的阳性克隆进行酶切鉴定及测序分析。
1.2.3 融合蛋白fHD-5的诱导表达及鉴定 将构建正确的pQE-30Xa/HD-5质粒再次转化入E.coli M15感受态细胞中,挑取阳性单菌落至加入终浓度为1 g/L的Amp+的液态培养基中,过夜培养后1∶100转接,37℃、250 r/min培养至OD600约0.5,加入终浓度为1 mmol/L的IPTG诱导培养6 h,收集菌体。通过一步法细菌活性蛋白提取试剂盒回收上清液及沉淀,进行15%SDS-PAGE电泳。以含空白pQE-30Xa质粒的E.coli M15宿主菌和未诱导的含pQE-30Xa/HD-5宿主菌为对照。
1.2.4 融合蛋白fHD-5的纯化、复性及Western blot鉴定 采用Ni-NTA亲和层析进行融合蛋白的纯化。将包涵体储备液溶于适量溶解缓冲液,去除杂质加入平衡后的层析柱中,冲洗液漂洗后,对融合蛋白进行柱上复性,复性缓冲液尿素起始浓度为6 mol/L,终止浓度为0 mol/L。最后以洗脱液进行线性洗脱,洗脱液中咪唑起始浓度为20 nmol/L,终止浓度为500 nmol/L。所有步骤均在ÄKTAprime蛋白层析纯化系统上进行。对收集液行15%SDS-PAGE检测分析。纯化蛋白行15%SDS-PAGE电泳后,湿法转至醋酸纤维素膜,封闭2 h,加入小鼠抗His标签抗体,于4℃摇床过夜,洗膜,加入HRP标记的山羊抗小鼠抗体,于37℃孵育2 h,洗膜后ECL法显色。
1.2.5 融合蛋白fHD-5抗真菌活性的检测 采用KB纸片扩散法测定纯化后的融合蛋白fHD-5的抗真菌活性。制备对数生长期的白色假丝酵母菌菌液(孢子含量105CFU/mL)。取100 μL均匀涂布于沙氏平板上。取直径1 cm的无菌滤纸片浸泡于fHD-5溶液中,制备KB纸片。将浸泡过fHD-5溶液的滤纸片平铺于涂菌的培养基上,37℃培养24 h。以浸泡PBS缓冲液的滤纸片为阴性对照组。
2 结果
2.1 编码HD-5成熟肽的基因克隆 PCR扩增出清晰目的条带,长度约250 bp与预期的人HD-5基因大小一致,见图1。

Fig.1 Recombinant plasmid confirmed by PCR图1 表达载体PCR电泳鉴定
2.2 pQE-30Xa/HD-5重组表达质粒的构建 重组质粒经限制性内切酶KpnⅠ、HindⅢ双酶切后,获得长度约3 000 bp、250 bp的2条片段,与预期相符,见图1。DNA序列分析结果证实pQE-30Xa载体中插入大小为243 bp的基因片段与HD-5基因序列一致。
2.3 融合蛋白fHD-5的诱导表达及鉴定 含重组质粒pQE-30Xa/HD-5质粒的转化菌在37℃诱导表达6 h后,其沉淀在11 ku处出现一明显的深染条带。空载体诱导表达后和重组未诱导菌在11 ku处无明显条带出现,见图2。初步证实,诱导后的重组蛋白主要以包涵体形式表达。

Fig.2 HD-5 expression was confirmed by SDS-PAGE图2 pQE-30Xa/HD-5重组质粒表达产物的SDS-PAGE鉴定
2.4 融合蛋白fHD-5纯化产物鉴定 Western blot证实纯化后的融合蛋白于11 ku处有一条清晰条带,与预期的目的蛋白相符。见图3。
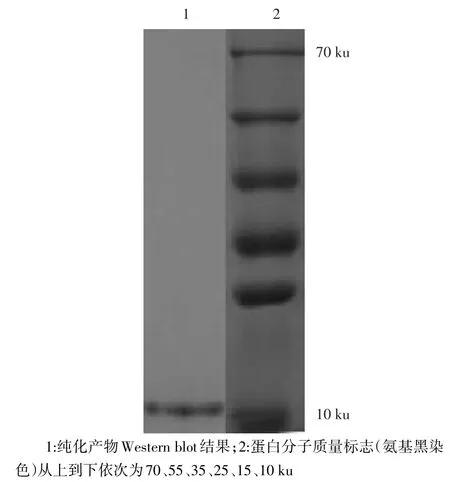
Fig.3 Purification confirmed by Western Blot图3 纯化产物Western Blot鉴定
2.5 融合蛋白fHD-5抗真菌活性的初步鉴定 浸泡过fHD-5溶液的滤纸片周围可见明显抑菌圈,而阴性对照组则无抑菌圈出现,见图4。

Fig.4 Antifungal activity examined by disk diffusion图4 KB纸片法检测fHD-5抗真菌活性
3 讨论
哺乳动物的防御素不但具有抗细菌、真菌及被膜病毒的活性,还对支原体、衣原体、螺旋体及艾滋病病毒具有杀伤作用。此外,防御素作为机体免疫防御系统的重要组成部分,在天然免疫中发挥重要作用的同时,也介导、调节着机体的获得性免疫[2]。由于HD-5的广谱抗微生物活性及其分布的特殊性,越来越多的学者认为HD-5与生殖道的感染性疾病密切相关。目前HD-5抗微生物活性的具体机制尚不明确,大多研究认为,其主要的抗微生物活性可能与其所带电荷有关,HD-5与微生物的细胞膜特异位点接触后形成电压依赖通道,使细胞离子通透性失衡,细胞内物质泄漏导致细胞死亡[3]。防御素与传统抗生素的作用机制不同,可有效避免微生物耐药性的产生,应用前景良好。
天然的防御素来源少,提取困难,使得防御素的深入研究及应用受到限制。直接从组织中提出操作困难且获量少,化学合成成本昂贵,基因工程则成为防御素合成的必然选择。鉴于防御素的独特抗菌活性,建立能够高效表达且易于快速分离纯化的基因工程表达体系,将为防御素等天然抗菌肽的自动化、产业化生产奠定基础。已有研究通过酵母表达体系成功的构建了HD-5的真核表达体系并进行相关研究[4]。真核表达系统虽然可以实现有效的转录、表达以及翻译后的后期加工过程,但表达水平一般较低,分离纯化困难,从而限制了HD-5的深入研究。
外源基因在大肠杆菌中的融合表达是目前普遍采用的一种高效表达方式。本研究采用pQE30作为HD-5的表达载体,利用载体自带的T5启动子,实现目的蛋白的高效表达。pQE30载体在重组蛋白N端融合表达有6个连续的组氨酸标签(6*His-Tag)。6*His-Tag与细菌的翻译转录机制互相兼容,利于蛋白的表达,并且对目的蛋白的理化性质及结构没有明显影响,通过His标签融合表达的蛋白可以采用固定化金属离子亲和层析纯化目的蛋白,使操作十分简便[5]。E.coli M15菌株是与pQE30表达载体相互匹配的用于表达外源蛋白的宿主菌,其基因组内插入了真核生物稀有密码子相应的tRNA基因。利用该菌株能更有效地表达目的蛋白。本研究证实,HD-5融合蛋白主要以包涵体形式表达,可以有效地防止蛋白酶对目的蛋白的溶解,降低胞内外源蛋白的浓度,有利于表达产量的提高;包涵体中杂质蛋白含量低,有利于进一步的分离纯化。同时包涵体蛋白不具有生理活性,有效降低了HD-5对宿主菌的毒性作用,有利于进一步提高表达产量。包涵体蛋白需进行变性条件下的纯化,纯化后需对蛋白进行复性。本研究通过NI-NTA亲和层析纯化目的蛋白,并进行蛋白复性后,获得了纯度较高的HD-5融合蛋白。对融合蛋白进行抗真菌活性的验证结果显示含有6*His-Tag的融合蛋白对白色假丝酵母菌具有明显的抑制作用。相关研究也证实,His-Tag的存在对抗菌肽的抑菌活性并无明显影响[6]。因此,利用该重组表达体系,可以获得具有生物活性的HD-5蛋白,还可以通过对诱导条件的不断优化,进一步提高目的蛋白的产量,进而满足HD-5深入研究的需求,并为新型抗菌药物大规模生产途径的选择提供实验基础。HD-5融合蛋白有效的抗真菌活性,更为妇科生殖道感染性疾病的治疗开拓了新的研究方向。
[1]Simms LA,Doecke JD,Walsh MD,et al.Reduced alpha-defensin expression is associated with inflammation and not NOD2 mutation status in ileal Crohn’s disease[J].Gut,2008,57(7):903-910.doi:10.1136/gut.2007.142588.
[2]Wiesner J,Vilcinskas A.Antimicrobial peptides:the ancient arm of the human immune system[J].Virulence,2010,1(5):440-464.doi: 10.4161/viru.1.5.12983.
[3]Lehrer RI,Lu W.α-Defensins in human innate immunity[J].Immunol Rev,2012,245(1):84-112.doi:10.1111/j.1600-065x.2011.01082.x.
[4]Hsu KH,Pei C,Yeh JY,et al.Production of bioactive human alphadefensin 5 in Pichia pastoris[J].J Gen Appl Microbiol,2009,55(5): 395-401.doi:10.2323/jgam.55.395.
[5]Ralph EC,Xiang LK,Cashman JR,et al.His-tag truncated butytylcholinesterase as a useful construct for in vitro characterization of wild-type and variant butyrylcholinesterases[J].Protein Expr Purif,2011,80(1):22-27.doi:10.1016/j.pep.2011.07.005.
[6]Lee KW,Han NS,Kim JH.Purification and characterization of beta-glucosidase from Weissella cibaria 37[J].J Microbiol Biotechnol, 2012,22(12):1705-1731.doi:10.4014/jmb.1206.06007.
(2013-10-09收稿 2014-03-21修回)
(本文编辑 陈丽洁)
Prokaryotic Expression and Antifungal Activity of Human α Defensin-5 Protein
ZHANG Pingping1,YIN Lirong1,WANG Fang1,SUN Bei2,HUO Yan3
1 Department of Gynecology,the Second Hospital of Tianjin Medical University,Tianjin 300211,China;2 Research Institute of Endocrinology of Tianjin Medical University;3 Department of Family Planning,the Second Hospital of Tianjin Medical University YIN Lirong,E-mail:yinlirongfk@sina.com
ObjectiveTo construct the prokaryotic expression vector for HD-5 and purify the recombinant HD-5 protein then analyze its antifungal activity.MethodsThe HD-5 gene was cloned by PCR,then was inserted into prokaryotic expression plasmid pQE-30Xa to construct pQE-30Xa/HD-5.After sequencing,pQE-30Xa/HD-5 was transformed into E.coli M15 cells.Its expression was induced by IPTG and confirmed by SDS-PAGE.The recombinant protein was purified through Ni-NTA affinity purification system.The antifungal activity was tested by disk diffusion method.ResultsHD-5 gene and pQE-30Xa/HD-5 vector were obtained successfully.E.coli M15 strains was used to express HD-5 fusion protein. After purification,the fusion protein was confirmed by Western blot.The disk diffusion test confirmed that the fusion protein can inhibit Candida albicans.ConclusionExpression vector pQE-30Xa/HD-5 was successfully constructed.The HD-5 fusion protein was expressed in E.coli successfully,which showed a certain degree of antifungal activity.
defensins;recombinant fusion proteins;Escherichia coli;human alpha defensin 5;prokaryotic expression;affinity purification;antifungal activity
R711.3,R349.65
A
10.3969/j.issn.0253-9896.2014.08.006
1天津医科大学第二医院妇科(邮编300211);2天津医科大学内分泌研究所;3天津医科大学第二医院计划生育科
△通讯作者 E-mail:yinlirongfk@sina.com

