Cox-2和HNF-3β在非小细胞肺癌中的表达及临床意义①
罗维贵,覃春艳,黄霞,邓俊华,覃雪梅,许建国
(右江民族医学院附属医院,广西 百色 533000 E-mail:luoweiguiluo@163.com)
肺癌是在临床上发病率最高的恶性肿瘤,尽管人们对其采用了积极和有效的防治措施,但其发病率及病死率依然呈现逐渐增多的趋势,为提高肺癌的早期诊断率和治疗有效率及降低病死率,寻找与肺癌发生、发展及预后的相关影响因素,特别是与肺癌相关的抑癌基因,成为其分子生物学研究的重点课题。肝细胞核因子 3β(hepatocyte nuclear factor,HNF-3βor Foxa2)作为肺癌的抑癌基因之一,近期受到广大学者的关注。而环氧化物酶-2(Cox-2)是一种诱导酶,其很少表达于正常组织,但人们发现,其参与了炎症或肿瘤的病理生理发展过程,特别是受到多种刺激因子刺激后显著表达,相关刺激因子主要包括:细胞因子、生长因子、促癌剂等。HNF-3β和Cox-2在非小细胞肺癌(NSCLC)中的发生发展关系及相互作用,迄今未见相关文献报道。本研究旨在探讨 HNF-3β和Cox-2在NSCLC中表达及其临床意义,以期为肺癌的靶向治疗提供临床依据。
1 资料与方法
1.1 病例资料 选取2006年10月~2012年10月在我院心胸外科手术切除的60例经病理确诊为NSCLC组织标本为实验组,并以与其相应的距离癌组织5cm以上的50例正常肺组织标本为对照组,60例患者术前均未进行化疗、放疗或靶向治疗。在实验组中,男性为38例,女性为22例,年龄40~75岁,平均年龄为56.3岁;其中鳞癌20例,腺癌28例,腺鳞癌12例;临床分期Ⅰ~Ⅱ期患者45例,Ⅲ期患者15例;有淋巴结转移26例,无淋巴结转移34例。60例NSCLC中,获随访者46例,随访率76.67% (46/60),随访时间5个月~5年,平均随访35.7个月。
1.2 方法 手术后所有新鲜标本均即时用10%多聚甲醛溶液固定,用石蜡包埋制作保存,组织蜡块进行4μm厚连续切片后固定于载玻片上。切片厚度4μm分别行HE染色和免疫组化染色。取已知阳性的切片做对照模板,用PBS代替做阴性对照模板。兔抗人Bcl-2单克隆抗体(SP21)和兔抗人HNF-3β单克隆抗体及相应试剂盒、DAB酶底物显色试剂盒由福州迈新生物技术开发有限公司提供,操作步骤均严格按照说明书进行操作。
1.3 结果判定标准 将染色为棕黄色和棕褐色颗粒作为Cox-2和HNF-3β阳性信号标准。判定方法为于高倍显微镜下(10×40)随机选取10个不同视野,各计数100个癌细胞,免疫组化染色结果采用双盲方法测定。根据阳性细胞所占的百分率分为4级:<5%为0分;5%~24%为1分;25%~50%为2分;>50%为3分。显色度按细胞着色计分:无着色为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分。取两者评分之和的数值作为结果判定,0分为(-),<4分为(+),>4分为(++)。
1.4 统计学方法 应用SPSS 16.0软件包进行统计,Cox-2和 HNF-3β的表达、与临床病理参数的关系等计数资料,采用χ2检验,采用Spearman进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 Cox-2和 HNF-3β的表达 在NSCLC和癌旁正常组织中,Cox-2蛋白阳性(见图1)表达率分别为78.33%(47/60)和18.00%(9/50);HNF-3β阳性(见图2)表达率分别为35.00% (21/60)和84.00%(42/50)。Cox-2在 NSCLC高表达,正常肺组织中低表达,而HNF-3β则与之相反,两者阳性表达率之间比较,差异具有统计学意义(P<0.05),见表1。
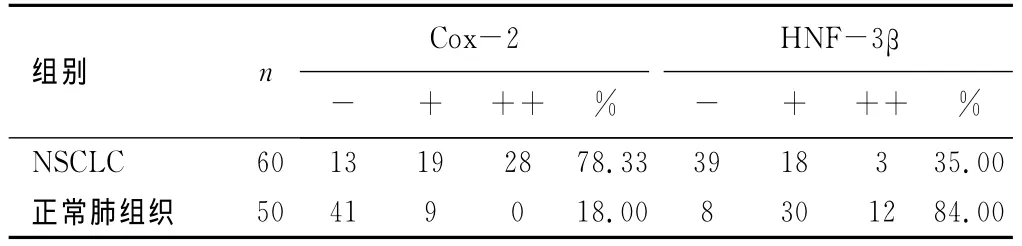
表1 NSCLC及癌旁正常肺组织中Cox-2和HNF-3β蛋白表达 (n)
2.2 NSCLC组织中Cox-2和HNF-3β的表达与临床、病理特征的关系 Cox-2和HNF-3β的表达与性别、年龄、肿瘤大小、组织学类型无关(P>0.05)。Cox-2的阳性表达率与临床分期、淋巴结转移、病理分级呈显著相关性,差异有统计学意义(P<0.05),但与分化程度无相关性,差异无统计学意义(P>0.05);HNF-3β阳性表达率与临床TNM分期、分化程度、病理分级、淋巴结转移之间比较,差异有统计学意义,呈明显负相关(P <0.05),见表2。
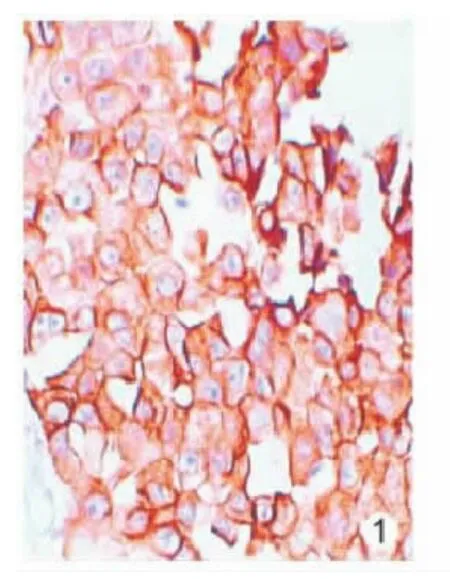
图1 Cox-2在肺癌组织中的表达

图2 HNF-3β蛋白在肺癌组织中的表达

表2 NSCLC中Cox-2和HNF-3β蛋白表达与临床病理特征的关系
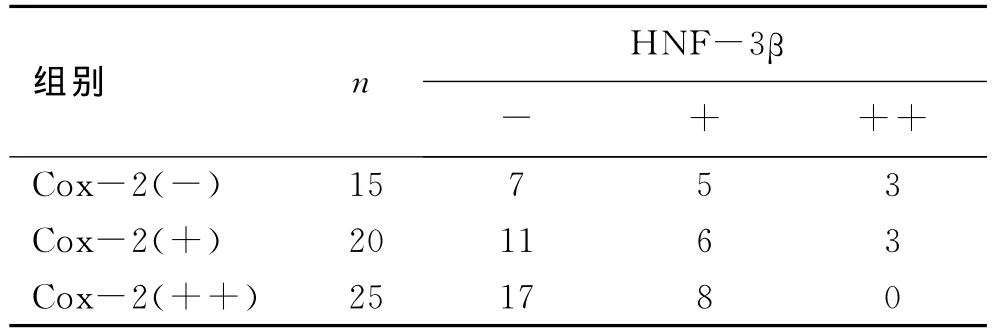
表3 Cox-2和 HNF-3β蛋白在NSCLC中表达的相互关系
2.4 Cox-2和HNF-3β表达与NSCLC患者生存率的关系 在NSCLC患者中,获随访的46例其术后1、3和5年生存率分别为77.78%(14/18)、44.44%(8/18)和22.22%(4/18),而Cox-2表达弱阳性和阴性的28例患者其1、3和5年生存率分别为89.29%(25/28)、75.00%(21/28)和 53.57%(15/28),Cox-2强阳性者1、3、5年生存率显著下降(P <0.05)。46例获随访的NSCLC患者中,6例HNF-3β强阳性,其1、3和5年生存率均为98%,HNF-3β表达阴性的40例患者,其1、3和5 年 生 存 率 分 别 为 82.50% (33/40)、47.50% (19/40)和30.00%(12/40),呈显著下降(P <0.05)。
3 讨论
Cox-2是一种诱导型酶,其可以诱导花生四烯酸转化为前列腺素环内过氧化物(PGG2),并经一系列过程,最终将PGG2转化成为另一种产物PGH2。Cox-2在正常组织中很少表达,可在多种恶性肿瘤中高表达,并在多种因子刺激下开始产生,研究发现,Cox-2在肿瘤的细胞增殖、肿瘤血管形成及肿瘤的远处浸润及转移过程中起到了促进作用。Richardsen等[1]研究提示,在原发性前列腺癌组织中Cox-2呈明显高表达状态。Singh B等[2]研究表明Cox-2在乳腺癌的发生发展起到一定的促进作用。赵晓鸿等[3]通过免疫组化检测Cox-2、原癌基因c-fos编码产物(c-Fos蛋白)、原癌基因c-jun编码产物(c-Jun蛋白)以及活性T细胞核因子3(nuclear factor of activated Tcells3,NFAT3)在159例NSCLC中的表达情况,结果发现在NSCLC组织中Cox-2的表达与转录因子NFAT3和c-Fos的表达明显相关,这提示NFAT3和c-Fos可能对Cox-2的表达起到了共同调节的作用。Baratelli等[4]在NSCLC中的研究也发现,TGF-β在PGE2的促进下将纯化的CD4+转化为调节T细胞表型,而PGE2在相应组织中的表达受到Cox-2的调控,这说明Cox-2在肿瘤的免疫介导中起抑制作用。Luo等[5]在84例NSCLC患者手术后标本中Cox-2的表达研究表明:在NSCLC中,Cox-2可上调VEGF和MVD在NSCLC的表达,同时还提示,加入PKC抑制剂后,可明显降低了A549、A431和H460中的VEGF的表达,而加入PKC激活剂后则能增强VEGF的表达,因此我们得出:在NSCLC中,Cox-2能够介导的VEGF的上调,而PKC路径在此过程中起到了非常重要的作用。其VEGF的表达均明显下调,说明可调控VEGF的表达,从而促进肿瘤血管的生成。本研究结果显示,Cox-2和HNF-3β的表达与性别、年龄、肿瘤大小、组织学类型无关。在正常组织中仅2例Cox-2表达为(+),阳性率为10%;60例NSCLC组织中43例表现为阳性,阳性率为71.67%。Cox-2的阳性表达率与临床分期、淋巴结的转移、病理分级呈显著相关性,且在Ⅲ~Ⅳ期、有淋巴结转移、病理分级Ⅲ级病例中明显高表达于Ⅰ~Ⅱ期、无淋巴结转移、病理分级Ⅰ~Ⅱ级的病例,Cox-2的表达明显影响着患者术后生存期的长短,NSCLC患者中,其恶性程度越高,Cox-2的阳性表达则明显增强。Cox-2影响了NSCLC的发生、发展和预后,其机制可能是Cox-2促进肿瘤血管的形成,提供了肿瘤生长所需营养的途径,并参与了肿瘤的远处转移。
HNF-3β是HNF-3家族三个成员之一,它具有一个翼旋(wingedhelix)区,该区为一高度保守的DNA结合区,是以单体的形式结合[6]。相关体外的肿瘤细胞培养实验发现,在鳞癌、腺癌、NSCLC等大多数肿瘤细胞系中,其相关肿瘤细胞内HNF-3β呈现低表达状态,在加入HNF-3β后,肿瘤细胞明显增殖变慢、凋亡,这表明了HNF-3β是一种很强的肺癌抑制因子[7]。研究发现,在肿瘤发生、发展后期,TGF-β1可以促进细胞分化、转化及促血管内皮细胞生长,从而促进了肿瘤血管生成、肿瘤细胞浸润、转移和免疫抑制作用。使其与肺癌,尤其是NSCLC的发生、进展、淋巴结转移等有密切的关系,但其具体机制尚未完全明确[8]。提示HNF-3β能够抑制肺癌形成过程中的上皮—间充质转分化过程,阻碍了肺癌的形成、增殖、扩散的作用[9]。本研究提示,HNF-3β在正常肺组织及NSCLC中的阳性表达率分别为83.3%和36%,其阳性表达与TNM分期、组织病理类型、淋巴结转移相关,HNF-3β在TNM分期Ⅲ~Ⅳ期、腺癌及有淋巴结转移的组织中,表达阳性率降低,提示HNF-3β在NSCLC侵袭、转移中起一定抑制作用。在随访的46例NSCLC患者中我们发现:HNF-3β表达低下的患者,其总体无瘤生存期比 HNF-3β高表达者相对缩短,这表明了HNF-3β的表达可能与NSCLC患者的临床预后存在一定的关系,能够作为一种有待于开发利用于肺癌分期及临床预后的标志物。
综上所述,在NSCLC中Cox-2与HNF-3β的表达呈现负相关性,其中Cox-2的高表达、HNF-3β的低表达,两者在NSCLC的发生、发展过程中起了重要作用,并且与预后明显相关,在基础研究和临床工作中检测Cox-2和HNF-3β对促进NSCLC患者的生物学行为研究和预测临床预后有重要意义。为进一步探讨NSCLC发病机制以及探寻NSCLC治疗新途径提供实验依据。
[1]Richardsen E,Uglehus RD,Due J,et al.Cox-2is overexpressed in primary prostate cancer with metastatic potential and may predict survival.A comparison study between Cox-2,TGF-β,IL-10and Ki67[J].Cancer Epidemiology,2010,34(3):316-322.
[2]Singh B,Cook KV,Vincent L,et al.Role of Cox-2in tumorospheres derived from a breast cancer cell line[J].Journal of Surgical Research,2011,168(1):e39-49.
[3]赵晓鸿,陈照丽,赵守华,等.Cox-2及其转录因子NFAT3和c-Fos在非小细胞癌中的表达及意义[J].中国肺癌杂志,2010,13(11):1035-1040.
[4]Baratelli F,Lee JM,Hazra S,et al.PGE2contributes to TGF-βinduced T regulatory cell function in human non-small cell lung cancer[J].Am Transl Res,2010,2(4):356-367.
[5]Luo Honghe,Chen Zhenguang,Jin Hui,et al.Cyclooxygenase-2up-regulates vascular endothelial growth factor via a protein kinase C pathway in non-small cell lung cancer[J].Clinical Cancer Research,2011,30(1):6.
[6]Lee CS,Sund NJ,Behr R,et al.Foxa2is required for the differentiation of pancreatic alpha-cells[J].Dev Biol,2005,278(2):484-495.
[7]Qi J,Nakayama K,Cardiff RD,et al.Siah2-dependent concerted activity of HIF and FoxA2regulates formation of neuroendocrine phenotype and neuroendocrine prostate tumors[J].Cancer Cell,2010,18(1):23-38.
[8]Xu CC,Wu LM,Sun W,et al.Effects of TGF-βsignaling blockade on human A549lung adenocarcinoma cell lines[J].Mol Med Report,2011,4(5):1007-1015.
[9]Tang Y,Shu G,Yuan X,et al.FOXA2functions as a suppressor of tumor metastasis by inhibition of epithelial-to-mesenchymal transition in human lung cancers[J].Cell Res,2011,21(2):316-326.

