α,β-不饱和酰胺TRPV1抑制剂的Topomer CoMFA模型
戴 康,方 华,温 超,徐 晖
(中南民族大学 药学院,武汉 430074)
瞬时感受器电位香草酸1(TRPV1)是一个新的镇痛药物分子靶点,主要存在于背根神经节和三叉神经节的较小直径细胞的细胞膜或胞内细胞器膜上,是一种非选择性阳离子通道.克隆的TRPV1可被多种伤害性刺激激活,故TRPV1被认为是一种多信号探测和感受多种疼痛刺激的整合器[1].主要包括3个方面:芳香草醛化合物、伤害性热刺激和氢离子[2, 3].
治疗疼痛多应用TRPV1激动剂,激活TRPV1通道后,引起Ca2+内流,导致初级感觉神经元兴奋[4],长期使用能导致神经元脱敏,阻断痛觉的传递[5-7].但这种镇痛机制有很多副作用,如辣椒素与TRPV1结合后,神经细胞内的Ca2+大量内流,导致细胞膜破坏,使线粒体膜通透性发生改变,使神经细胞凋亡[8],故TRPV1阻断剂近年来受到重视.经典的TRPV1阻断剂包括:Capsazepine、RTX和钌红.小分子TRPV1阻断剂有硫脲类、尿素类、肉桂酰胺类、氨基化合物、甘氨酰胺类、卤化辣椒碱和吡啶基哌嗪类[9].但这些TRPV1阻断剂均存在着一个共同的问题,很多候选药物都会引发高热反应,甚至影响记忆等大脑机能.故寻找一种无毒高效的新的TRPV1抑制剂显得尤为重要.
本文利用Topomer CoMFA设计的α,β-不饱和酰胺TRPV1抑制剂有效解决了这个问题.利用第二代CoMFA 方法Topomer CoMFA来研究α,β-不饱和酰胺TRPV1抑制剂的3D-QSAR模型.与传统的CoMFA方法相比,Topomer CoMFA不需要手动分子叠合,每个模型中分子叠合都是客观的,增强了模型之间的可比性,提高了CoMFA的重现性,并大大提高了计算效率[10].
1 数据描述
本文研究了42个α,β-不饱和酰胺类TRPV1抑制剂,其中34个选为训练集,8个选为测试集(带*的化合物).其中用训练集建立3D-QSAR模型,测试集测试模型的外部稳定性.α,β-不饱和酰胺类TRPV1抑制剂的活性数据和化合物的结构见表1.
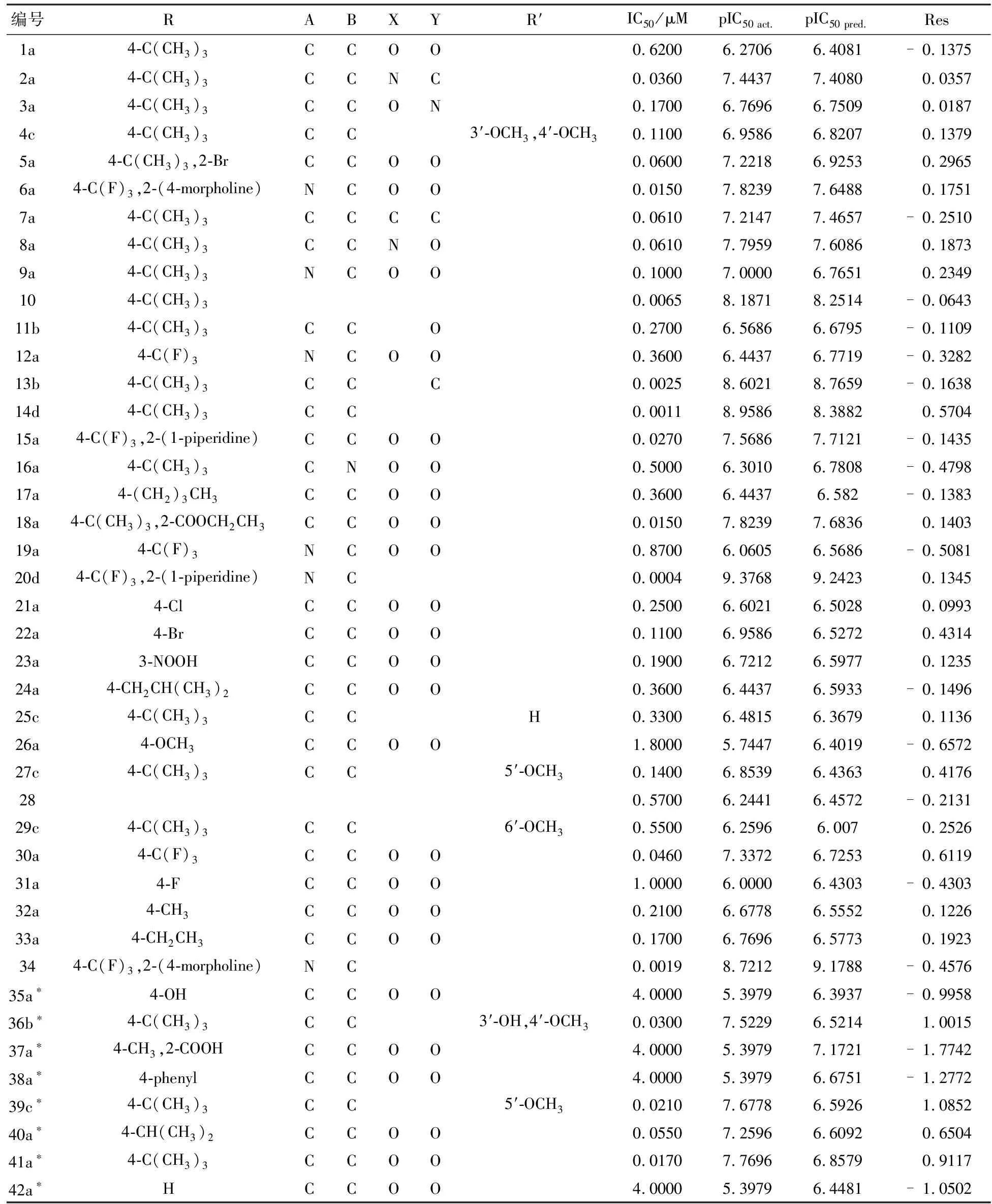
表1 化合物的结构和生物活性数据
*测试组
2 模型建立
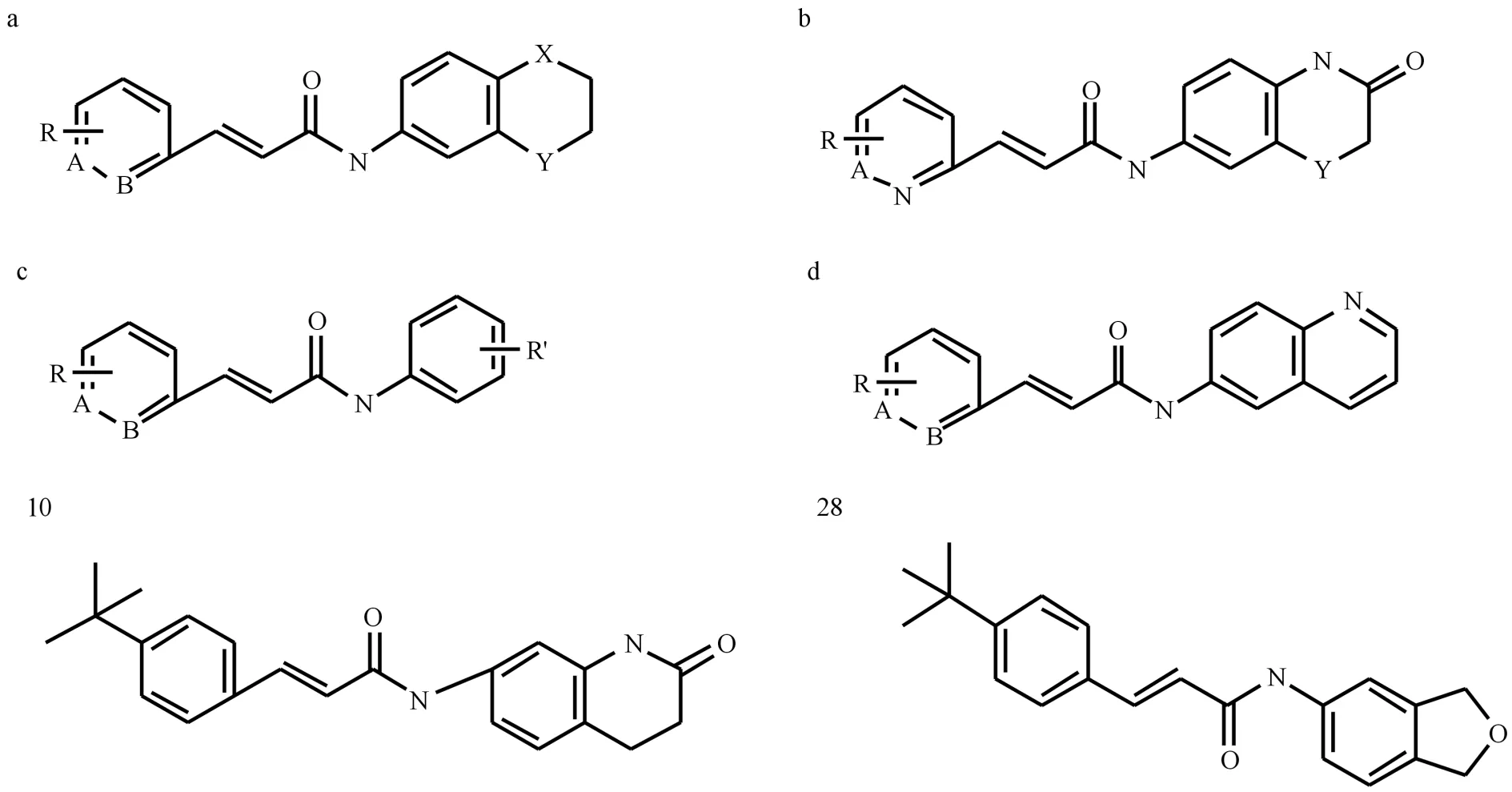
本文利用SYBYL-X软件对对34个训练集化合物进行切割,随机选择1个化合物结构作为模板,切割酰胺键,生成R1基团和R2基团(见图1).Sybyl软件会自动识别并切割剩下的化合物并计算R1基团和R2基团周围的分子场,以立体场和静电场性质为自变量,化合物活性为因变量,采用最小偏二乘法建立化合物立体场特征和活性的关系生成3D-QSAR模型.其中交叉验证相关系数q2为0.702,非交叉验证相关系数r2为0.881,表明该模型有较好的拟合与内部预测能力.
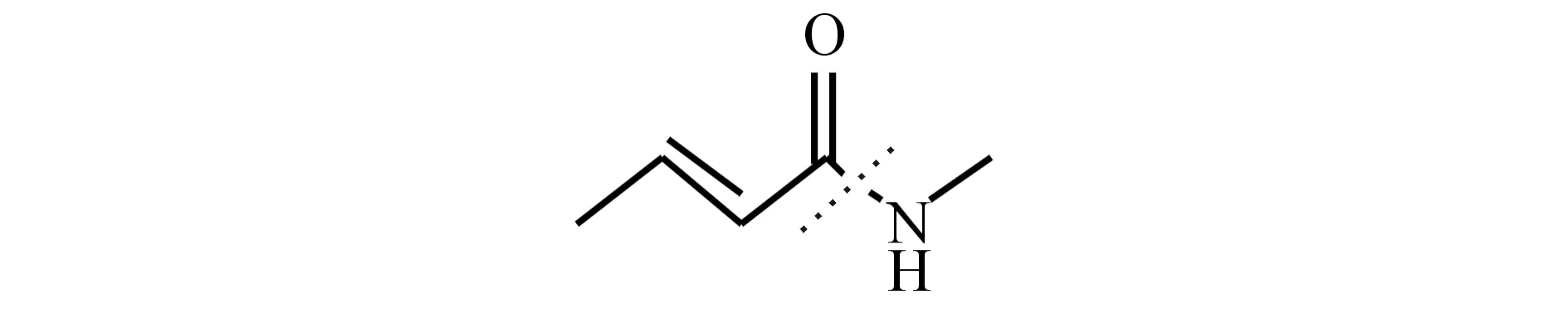
图1 分子的切割方式Fig.1 The cuting way of the molecular
3 结果与讨论
为测试该模型的稳定性和外部预测能力,对8个测试集化合物进行了活性预测.其结构活性数据见表1,线性相关回归图见图2,由图2和表1可见测试集圆点分布在回归线两侧,说明该模型有较好的外部预测能力.
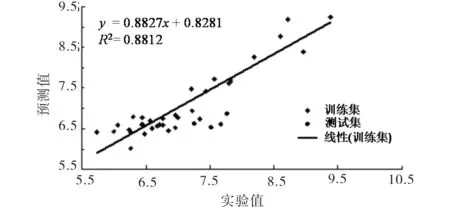
图2 42个化后物的实验值和预测值的散点图Fig.2 The scatter plots of the experimental value and predicted value of 42 chemical compounds
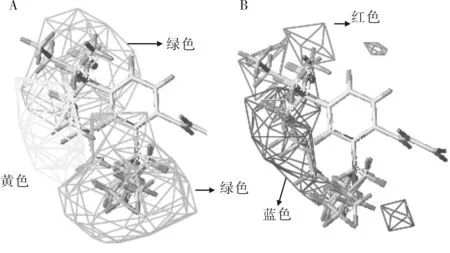
图3 R1的立体场和静电场对化合物活性的影响Fig.3 The effect of steric and electrostatic field of R1 on the activity of the compound

图4 R2的立体场和静电场对活性的影响Fig.4 The effect of steric and electrostatic field of R2 on the activity of the compound
图3和图4分别是R1和R2的立体场和静电场对活性的影响,左边绿色部分表示增大取代基的体积有利于增加活性,黄色部分表示减小取代基体积有利于增加活性;右边蓝色区域有正电性基团活性会增加,红色区域有负电性基团活性会增加.
图3A中R1基团的苯环的2、4位处于绿色区域,3号位处于黄色区域,那么在2、4号位引入大体积的取代基有利于增加活性,而在3号位减小取代基体积有利于提高活性.表1中活性5a>1a,22a>21a,1a>42a均能验证这一点,5a中因为比1a在2位多了一个溴取代而活性增强;22a的溴取代比21a的氯取代基体积稍大,因而活性也略强;1a中叔丁基4位有取代而42a中没取代因而活性增强.在图3B中,2′号到4′号位之间的区域处于蓝色区域,应该引入正电性取代基,而在2′号、4′号区域部分处于红色区域,应该引入负电性取代基.表1中活性15a>16a,36b>35a,15a>12a均可以验证这一点.
图4C中R2基团的苯环2、4号位上并的环上的取代基处于绿色区域,增加取代基的体积有利于增加活性,而在垂直于该环的平面的取代基在黄色区域,缩小取代基的体积有利于增加活性,表1中活性4c>1a,36b>1a均能很好地证明这一点;图4D中该环靠近酰胺键端两处处于红色区域,引入负电性取代基有利于增加活性,远离酰胺键端处于蓝色区域,引入正电性取代基有利于增加活性,表1中活性8a>2a,因8a结构中苯并六元环上靠近酰胺端是氧取代,引入了电负性基团,而活性10远远大于11b,都与这点相符.预测结果表明整体而言R2基团的贡献大于R1基团.
综上所述,在R1基团的苯环4号位引入三氟化碳基团与图中连接苯环处为蓝色区域,而该处的3个取代基处于红色区域相符,能够增强药物的活性,在R2基团的苯并六元环上靠近酰胺键端引入酰胺键有利于增强药物的活性.
参 考 文 献
[1] Caterina M J, Schumacher M A, Tominaga M, et al. The capsaicin receptor: a heat-activated ion channel in the pain pathway[J]. Nature, 1997, 389(6653): 816-824.
[2] Liu D L, Wang W T, Xing J L, et al. Research progress in transient receptor potential vanilloid 1 of sensory nervous system[J]. Neurosci Bull, 2009, 25(4): 221-227.
[3] 陈 敏, 张陆勇, 严 明. 辣椒素受体研究进展[J].中国临床药理学与治疗学,2006,11(2): 126-130.
[4] 刘悦雁, 解 敏, 黄 擎, 等.辣椒素通过钙信号抑制感觉神经元的电压门控性钙离子通道[J].安徽医科大学学报, 2009, 44(1): 1-5.
[5] Wachtel R E. Capsaicin[J]. Reg Anesth Pain Med, 1999, 24(4): 361-363.
[6] 郭 峰, 姜晓钟. 辣椒素的作用机制及其镇痛应用[J]. 第二军医大学学报, 2002, 23(1): 96-98.
[7] 朱洁平, 刘悦雁. 辣椒素与疼痛研究综述[J].卫生职业教育,2010, 28(16): 155-159.
[8] Olah Z, Szabo T,Karai L,et al. Ligand-induced dynamic membrane changes and cell deletion conferred by vanilloid receptor 1[J]. J Biol Chem,2001,276(14): 11021-11030.
[9] 王 乐,曹 宇. TRPV1 阻断剂的研究进展[J]. 国际病理科学与临床杂志200828(3): 220-224.
[10] Cramer R D. Topomer CoMFA: a design methodology for rapid lead optimization[J]. J Med Chem,2003,46(3): 374-388.

