文蛤的生物沉积和呼吸排泄过程及其在双台子河口水层-底栖系统中的耦合作用
张安国,袁秀堂,侯文久,陈卫新,赵 凯,巴福阳,张作振
(1. 国家海洋环境监测中心,大连 116023;2. 辽宁医学院畜牧兽医学院水产养殖教研室,锦州 121001;3. 宁波大学海洋学院,宁波 315211;4. 辽宁省盘山县海洋与渔业局,盘锦 124010)
文蛤的生物沉积和呼吸排泄过程及其在双台子河口水层-底栖系统中的耦合作用
张安国1, 2,3,袁秀堂1,*,侯文久2,陈卫新4,赵 凯4,巴福阳4,张作振4
(1. 国家海洋环境监测中心,大连 116023;2. 辽宁医学院畜牧兽医学院水产养殖教研室,锦州 121001;3. 宁波大学海洋学院,宁波 315211;4. 辽宁省盘山县海洋与渔业局,盘锦 124010)

文蛤;生物沉积;呼吸;排泄;水层-底栖耦合;双台子河口

河口为咸淡水交汇混合区,河水携带大量泥沙入海,在入海口形成大面积浅滩;同时,河水携带大量营养盐及有机质入海,河口水域营养充足,因而,河口滩涂生境埋栖性贝类资源丰富[7]。双台子河口位于辽东湾顶部,滩涂面积达6.7万hm2,占整个辽东湾滩涂面积的56%,是我国北方滩涂埋栖性贝类的主要栖息地之一,在环渤海经济圈中具有举足轻重的地位。
文蛤(Meretrixmeretrix),又名短文蛤(Meretrixpetechialis,Lamarck,1818)[8],属软体动物门(Mollusca),双壳纲(Bivalvia)。文蛤被誉为“天下第一鲜”,深受国内外消费者欢迎,是出口创汇的重要水产品之一。文蛤属于广温、广盐性滩涂埋栖性双壳贝类,地理分布较广,在日本、朝鲜和中国沿海分布较多[9]。文蛤在我国南北沿海均有分布,尤以河口滩涂生境丰度较高,如辽宁双台子河口和辽河口、山东黄河口、江苏长江口、广西北海湾等地,其中在辽宁双台子河口潮间带及潮下带滩涂中尤为丰富,为该河口滩涂生境主要优势种之一[10]。
目前,关于文蛤生理生态方面的研究报道较少,且这些研究大多是在实验室条件下开展的[11- 16],尚未见文蛤生物沉积及呼吸排泄等主要生理生态过程的现场研究。本文采用生物沉积物捕集器和封闭式代谢瓶法在双台子河口周年现场研究了二龄和三龄文蛤的生物沉积速率、耗氧率、排氨率和排磷率等主要生理生态过程的季节变化。实验利用生物沉积物捕集器及呼吸瓶现场研究贝类生理生态学的优点在于:1)能较好反映自然海区颗粒物丰度和水流等环境条件;2)实验中测定生物沉积速率及呼吸排泄速率时中为埋栖性贝类文蛤提供原栖息地细沙作为埋栖物,更符合其在自然条件下的生理特性;3)具有完整的较长时间尺度性,因而受贝类偶然摄食行为的变化影响小[17]。上述实验方法优点使我们能更精确掌握文蛤主要生理生态过程的季节变化规律和特点,有助于准确评价双台子河口埋栖性双壳贝类优势种在河口水层-底栖系统中耦合作用中所扮演的生态角色。
1 研究海域与研究方法
1.1 研究海域及实验地点
研究区域位于我国渤海北部双台子河口的盘山海域(图1)。该实验海域的滩涂底质以泥沙质及泥质为主,海水中有机颗粒物丰富,是文蛤生长繁殖的主要场所。实验地点位于双台子河口滩涂高潮线附近面积6 hm2、水深1.5—2.0 m的池塘中。该池塘通过潮水沟渠与河口海域相通,并根据当地潮汐规律定时纳入新鲜的海水,保证池塘中海水水质条件与自然海区水质条件基本一致。
1.2 实验文蛤的选择与处理
分别于2010年7月(夏季)、10月(秋季)、12月(冬季)及2011年4月(春季)进行实验。每次实验前从河口滩涂中挖取文蛤,挑选体质健康的个体带回实验场地暂养24 h,供生物沉积和呼吸排泄实验所用。

图1 双台子河口实验地点Fig.1 Experimental sites in Shuangtaizi Estuary
1.3 实验池塘环境因子和海水颗粒物的测定
实验期间(5—7d)每间隔1—2 d用多参数水质仪(YSI6600V2)测定实验池塘的水温、盐度及叶绿素a(Chl a)含量;同时取实验池塘水样过滤,以测定水体的总悬浮颗粒物(TPM)、颗粒有机质(POM)、颗粒有机碳(POC)、颗粒有机氮(PON)和颗粒有机磷(POP),实验用事先于450 ℃下灼烧过6 h并称量的GF/F滤膜(直径47 mm)两张分别过滤250—500 mL水样,用蒸馏水脱盐并将滤膜在65 ℃条件下干燥24 h后,称量以测定TPM;其中一张以传统的灰化(450 ℃,6 h)前、后的质量差法测定POM;另外一张用Elementar Vario Macro CHN 型元素分析仪测定POC和PON,分析前将滤膜放在干燥器中用浓盐酸烟雾去除碳酸盐[18]。另外两张以改进的灰化法[19]分别测定滤膜上的总磷(TP)和无机磷(IP)含量,从而求得POP。取每次水样测定数据的平均值作为实验点该季节上述各指标的背景值。
1.4 文蛤生物沉积速率的现场测定
为充分考虑埋栖性贝类的生态习性,准确测定实验文蛤的生物沉积速率,本实验采用埋栖性贝类生物沉积物捕集器(图2)收集文蛤的生物沉积物。该捕集器由内直径为19 cm的PVC 圆柱筒制成,分为A、B 两部分,高度分别为30和40 cm;A 部分内部均匀分散地垂直装有4个PVC圆管(深5 cm,底部密封),圆管顶部距A 外壁顶部5 cm。使用时,首先将A与B 连在一起,圆管内放满细砂(细砂提前用淡水淘洗,烘干后经60目筛网滤掉更细的颗粒后经450 ℃灼烧6 h、再冲洗和烘干)。实验时将文蛤垂直插入圆管的细砂中,文蛤的进出水管一端朝上,每个圆管放1个实验文蛤。文蛤产生的生物沉积物将落于PVC圆桶B的底部。实验共使用9个捕集器,其中3个放置二龄文蛤,3个放置三龄文蛤,另外3个不放文蛤作为对照。将生物沉积物捕集器固定于铁架上,将铁架捆绑结实后,轻置于实验池塘底部。5 d 后将捕集器取出,带回实验室,取出文蛤个体,检查和记录死亡情况,之后测量其壳高(H,mm),取出其软体组织于65 ℃条件下干燥24—36 h 后,测量其软体干重(DM,g)。实验所用贝类为壳高(36.36 ± 0.23)mm、湿重(23.41 ± 0.47)g、软体干重(0.58 ± 0.02)g的二龄文蛤,和壳高(46.60 ± 0.70)mm、湿重(45.85 ± 1.80)g、软体干重(1.45 ± 0.11)g的三龄文蛤个体。

图2 生物沉积物捕集器示意图Fig.2 Sketch map of sediment trap
待捕集器静置3—5 h 后,用虹吸法吸除上清海水,将A、B两部分的沉积物用毛刷搅拌均匀后用60目筛绢网过滤。将所得沉积物收集至烧杯中。用蒸馏水脱盐、烘干(65 ℃,72—96 h)、称量,干燥保存待测。沉积物中有机物(OM)百分含量通过传统的灰化(450 ℃,6 h)前后的质量差法测定;沉积物中有机碳(OC)和有机氮(ON)百分含量用Elementar Vario Macro CHN 型元素分析仪测定,分析前需对磨成粉末状的沉积物样品进行预处理:用1 mol/L 的HCl浸泡18 h,并在65 ℃下烘干24 h[20]。沉积物中有机磷(OP)百分含量通过改进的灰分法[19]分别测定沉积物中总磷(TP)和无机磷(IP)的含量求得。
生物沉积速率通过方程Rb=(Dt-Dc)/T/N计算。式中,Rb(g-1个-1d-1)为生物沉积速率;Dt(g)和Dc(g)分别为实验组和对照组所收集的沉积物干重;T为时间(d);N为实验用文蛤个数。
1.5 呼吸排泄速率的现场测定

耗氧率
RO= [(Ct0-Ct1)×Vr]/[N×(t1-t0)]
式中,Ct0、Ct1(mg/L)分别指实验开始和结束时代谢瓶中溶解氧的浓度;Vr是代谢瓶中海水的体积(代谢瓶体积去除细砂和实验文蛤的体积);N是代谢瓶内实验文蛤的个数;t0和t1分别是实验开始和结束的时间。
排氨率(或排磷率)
RN(或RP)= [(Ct1-Ct0)×Vr]/[N×(t1-t0)]

1.6 双台子河口文蛤丰度和生物量的调查
分别于2011年7月(夏季)、10月(秋季)、2012年5月(春季)于大潮期对双台子河口滩涂文蛤资源量进行了调查分析。现场调查布设3个断面,每个断面以低潮为基点向岸边辐射,均匀布设4个站位(图1),每个站位随机选取3个取样点,每个取样点面积为10 m2,取样点深度约为20 cm。将每个取样点内文蛤全部取出,统计每个取样点内文蛤个体数。依据文蛤贝壳表面的生长轮和透光观察到的明暗带来推算其龄期[21]。将调查得到的所有文蛤测量壳高,然后称湿重(WM,g)后取出其软体组织,于65℃条件下干燥36—48 h后测量其软体干重(DM,g)。根据以上参数计算文蛤单位面积密度(个/m2)和单位个体软体干重(g/个),从而估算双台子河口滩涂生境文蛤丰度和生物量。
1.7 数据标准化和统计分析
为消除文蛤的规格差异对实验参数(Rb、RO、RN、RP)的影响,将所得数据进行标准化处理。所用公式[22]
Ys= (Ws/We)b×Ye
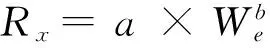
应用SPSS13.0软件包对实验数据进行单因素方差分析(one-way ANOVA),并结合Duncan法进行多重比较,并以P= 0.05作为差异显著的标准。
2 结果与分析
2.1 实验池塘环境因子季节变化特征
如表1 所示,实验池塘海水温度季节变化显著(P<0.05)。春季水温为12.0 ℃,夏季达到最高值(28.2 ℃),随后逐渐降低,秋季达到16.8 ℃,冬季降至-0.2 ℃。海水盐度变化较小,范围为19—23 psu;海水中叶绿素a(Chl a)含量在冬季达到最低,夏季达到最高,变化范围为5.0—20.0 μg/L;海水中总悬浮物浓度(TPM)和颗粒有机质(POM)含量均较高,分别为31.9—55.6 mg/L、8.6—15.0 mg/L;总悬浮物中颗粒有机碳(POC)和颗粒有机氮(PON)含量均在夏季达到最高,变化范围分别为0.93—3.13 mg/L、0.24—0.66 mg/L;颗粒有机磷(POP)含量变化较大,为29.59—203.01 μg/L。

表1 实验池塘环境因子及海水颗粒物季节变化
Chl a: 叶绿素a, Chlorophyll a; TPM: 总悬浮颗粒物, Total particulate matter; POM: 颗粒有机质, Particulate organic matter; POC: 颗粒有机碳, Particulate organic carbon; PON:颗粒有机氮, Particulate organic nitrogen; POP:颗粒有机磷, Particulate organic phosphorus
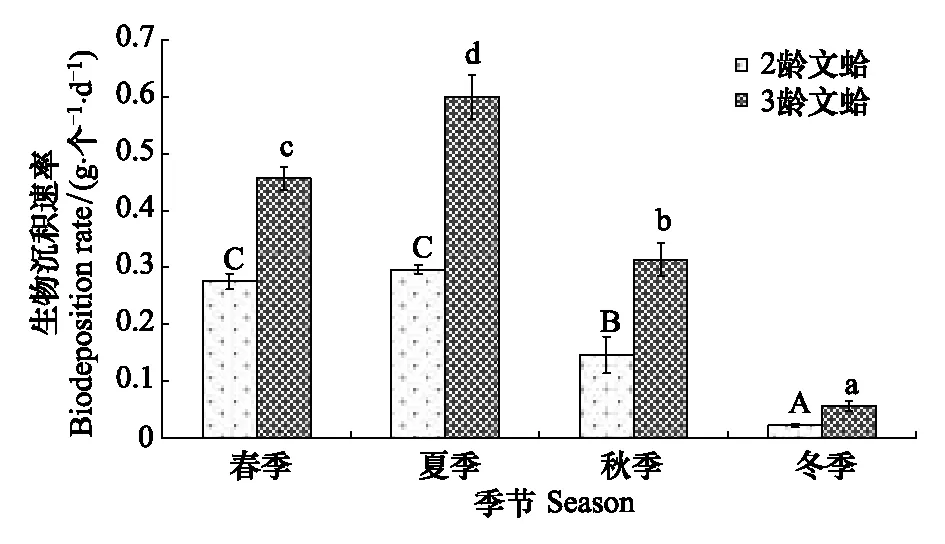
图3 文蛤生物沉积速率季节变化Fig.3 Seasonal variations in the biodeposition rates of Meretrix meretrix(mean±SE)图中数值为平均值±标准误,样本量为3; 同实验季节不同字母表示差异显著
2.2 文蛤的生物沉积速率季节变化
文蛤的生物沉积速率季节变化表现为夏季最高,春季次之,秋季再次,冬季最低(图3)。同一季节,文蛤的单位个体生物沉积速率表现为二龄<三龄。二龄与三龄文蛤的生物沉积速率周年变化分别为0.02—0.30 g-1个-1d-1(年均值为0.19 g-1个-1d-1)、0.06—0.60 g-1个-1d-1(年均值为0.36 g-1个-1d-1)。Duncan氏多重比较表明,二龄文蛤个体在春季与夏季的生物沉积速率差异不显著(P>0.05),但显著高于秋季及冬季(P<0.05)。冬季文蛤生物沉积速率显著低于秋季(P<0.05)。三龄文蛤个体在春季、夏季、秋季及冬季间的生物沉积速率均有显著差异(P<0.05),夏季时的生物沉积速率显著高于其它3个季节(P<0.05),冬季时的生物沉积速率显著低于春季及秋季(P<0.05)。方差分析显示,季节、规格及两者交互作用对文蛤生物沉积速率均有显著影响(P<0.05)。相关性分析显示,文蛤的生物沉积速率与温度、POM及Chl a均呈明显的正相关关系(r= 0.831,P<0.05;r= 0.597,P<0.05;r= 0.730,P<0.05),与盐度呈负相关关系(r= -0.707,P<0.05),与TPM相关性不显著(r= 0.420,P>0.05)。
2.3 文蛤的耗氧率季节变化
文蛤的耗氧率季节变化见图4。结果表明,二龄与三龄文蛤的耗氧率均在夏季达到最高,冬季最低。二龄、三龄文蛤的耗氧率分别为0.45—16.64 mg-1个-1d-1(年均值为7.50 mg-1个-1d-1)、1.03—30.51 mg-1个-1d-1(年均值为14.99 mg-1个-1d-1)。在同一季节,文蛤的单位个体耗氧率总体表现为二龄<三龄。双因素方差分析显示,季节、规格及两者交互作用对文蛤耗氧率影响显著(F=102.68,P<0.05;F=72.66,P<0.05;F=9.44,P<0.05)。Duncan 氏多重比较表明,二龄与三龄文蛤个体在夏季的耗氧率均显著高于其他三个季节(P<0.05);冬季时的耗氧率均显著低于春季及秋季(P<0.05);春季与秋季之间的耗氧率均差异不显著(P>0.05)。
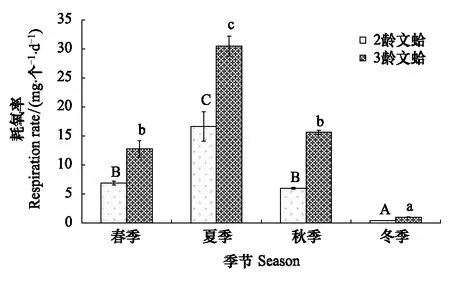
图4 文蛤耗氧率季节变化Fig.4 Seasonal variations in the oxygen consumption rates of Meretrix meretrix(mean±SE)图中数值为平均值±标准误,样本量为3; 同实验季节不同字母表示差异显著
2.4 文蛤的排氨率季节变化
文蛤的排氨率季节变化如图5所示,二龄与三龄文蛤的排氨率均在夏季达到最高,冬季最低。在同一季节,文蛤的单位个体排氨率表现为二龄<三龄。二龄、三龄文蛤的排氨率分别为0.001—0.14 mg-1个-1d-1(年均值为0.047 mg-1个-1d-1)、0.002—0.28 mg-1个-1d-1(年均值为0.099 mg-1个-1d-1)。双因素方差分析显示,季节、规格及两者交互作用对文蛤排氨率影响显著(F=576.65,P<0.05;F=193.91,P<0.05;F=65.32,P<0.05)。单因素方差分析表明,二龄文蛤个体在春季与秋季的排氨率之间差异不显著(P>0.05),三龄文蛤个体在不同季节之间的排氨率均有显著的差异(P<0.05)。两种龄期文蛤个体在夏季的排氨率均显著高于其它3个季节(P<0.05),冬季时的排氨率均显著小于春季及秋季(P<0.05)。
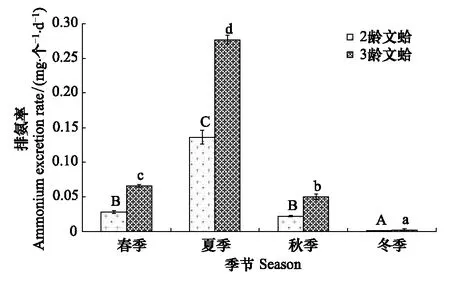
图5 文蛤排氨率季节变化Fig.5 Seasonal variations in the ammonium excretion rates of Meretrix meretrix(mean±SE)图中数值为平均值±标准误,样本量为3; 同实验阶段不同字母表示差异显著
2.5 文蛤的排磷率季节变化
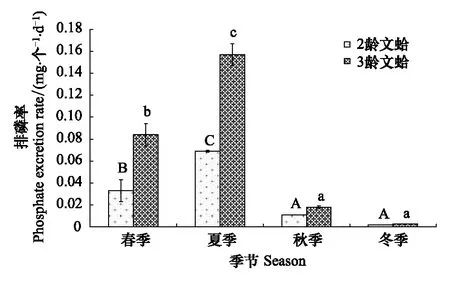
图6 文蛤排磷率季节变化Fig.6 Seasonal variations in the phosphate excretion rates of Meretrix meretrix(mean±SE)图中数值为平均值±标准误,样本量为3; 同实验阶段不同字母表示差异显著
文蛤的排磷率季节变化见图6。结果表明,二龄与三龄文蛤的排磷率均在夏季最高,春季次之,秋季再次,冬季最低。在同一季节,就单位个体而言,文蛤的排磷率变化表现为二龄<三龄。二龄、三龄文蛤的排磷率分别为0.002—0.069 mg-1个-1d-1(年均值为0.029 mg-1个-1d-1)、0.003—0.16 mg-1个-1d-1(年均值为0.066 mg-1个-1d-1)。双因素方差分析显示,季节、规格及两者交互作用对文蛤排磷率有显著影响(F=176.61,P<0.05;F=100.60,P<0.05;F=29.49,P<0.05)。Duncan 氏多重比较表明,二龄与三龄文蛤在秋季与冬季时的排磷率均差异不显著(P>0.05),但均显著低于其它两个季节(P<0.05)。两种规格文蛤个体在夏季的排磷率均显著高于春季(P<0.05)。
2.6 双台子河口文蛤资源量调查结果
双台子河口滩涂春季、夏季及秋季文蛤分布密度分别为0.65、0.78、0.59 个/m2,年均值为0.67 个/m2。单位个体的软体干重分别为2.24、6.60、1.96 g/个,年均值为3.6 g/个(表2)。对该河口文蛤种群结构的分析结果表明,二龄和三龄个体在整个种群中占比例较大,其中二龄个体50%左右,三龄个体接近30%;而一龄个体和四龄个体均低(图7)。
表2 双台子河口滩涂春季、夏季及秋季时文蛤的分布密度及软体干重
Table 2 Density and soft tissue dry mass ofMeretrixmeretrixin the Shuangtaizi Estuary in spring, summer and autumn

季节Season分布密度Density/(个/m2)软体干重Drymassofsofttissue/(g/个)春季Spring0.652.24夏季Summer0.786.60秋季Autumn0.591.96
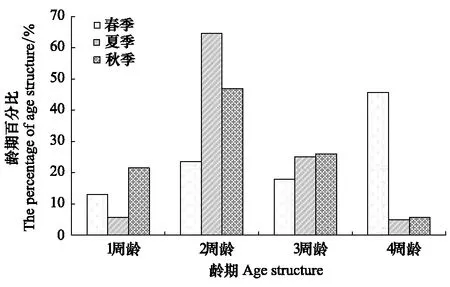
图7 不同季节文蛤种群年龄结构百分比Fig.7 The age structure of Meretrix meretrix population among different seasons
3 讨论
3.1 文蛤生物沉积速率季节变化及其影响因素
贝类的生物沉积在沿岸自然海区生态系统的物质循环中起着重要作用。尽管关于双壳贝类生物沉积速率的现场研究已有诸多报道,如栉孔扇贝(Chlamysfarreri)[22- 23]、虾夷扇贝(Patinopectenyessoensis)[24]、海扇贝(Placopectenmagellanicus)[25]、菲律宾蛤仔(Ruditapesphilippinarum)[26- 27]、太平洋牡蛎(Crassostreagigas)[28- 29]、斑马纹贻贝(Dreissenapolymorpha)[30]、厚壳贻贝(Mytiluscrassitesta)[31]等,但目前为止尚未见文蛤生物沉积速率现场研究的报道。本研究表明,双台子河口文蛤生物沉积速率呈现出明显的季节变化,这可能是由水温、海水中颗粒物浓度以及实验贝类的龄期等因素造成的。
温度是影响贝类生物沉积速率的重要环境因子之一[24,28,30]。双壳贝类处于适宜的温度范围内,其滤水活动增强,必然导致其生物沉积速率的增加;超出适温范围,其生物沉积速率会降低。适合文蛤生长的水温为5.5—32 ℃,最适水温15—27 ℃[9,21]。本实验观察到,春季和秋季时,实验池塘水温分别为12 ℃和17 ℃,文蛤处于比较适宜的环境中,生理代谢处于较高的水平,其摄食率不断升高,其生物沉积速率也处于较高值。夏季时,海水温度达到一年中最高值(均值为28.2 ℃),文蛤的摄食活动依然旺盛,从而导致其生物沉积速率在夏季达到最大值。这也表明夏季时水温28.2 ℃尚未达到文蛤的最高耐受温度,这与其他学者的研究结果基本一致[11,13]。冬季时,由于实验池塘水温降至-0.2 ℃,海水温度超出了文蛤的适温范围,低温制约了文蛤的滤水及摄食能力,文蛤活动显著减弱,其生物沉积速率也大大降低。
除温度影响生物沉积速率变化外,贝类个体的不同龄期也会导致生物沉积速率的变化。本研究发现,文蛤的生物沉积速率变化与实验贝类龄期有关:就单位个体而言,在同一季节,文蛤生物沉积速率表现为三龄>二龄,类似现象也出现在其它双壳贝类中,如栉孔扇贝[22]、虾夷扇贝[24]、太平洋牡蛎[29]、厚壳贻贝[31]等。许多研究表明,饵料的数量和质量会显著影响双壳贝类的生物沉积速率[23,28],双壳贝类能够在水体中颗粒物浓度较高或质量较差时调整其滤食率,从而改变其生物沉积速率[32]。文蛤生物沉积速率与海水中颗粒有机质(POM)呈明显的正相关关系也证实了贝类生物沉积率的季节变化与海水中饵料浓度有关。
综上,双台子河口海水中饵料的浓度及实验贝类龄期直接影响文蛤的生物沉积作用,而温度则通过影响海水环境中浮游植物的生长繁殖间接制约文蛤的生物沉积速率。
3.2 文蛤呼吸排泄速率季节变化及其影响因素
呼吸与排泄是贝类新陈代谢的基本生理活动,它既反映了贝类的生理状态,也反映了环境条件对贝类生理活动的影响。本研究中双台子河口文蛤耗氧率的季节变化为0.45—30.51 mg-1个-1d-1。由于国内外关于埋栖性双壳贝类耗氧率的现场研究报道较少,王晓宇等[5]现场研究了胶州湾菲律宾蛤仔呼吸排泄作用的季节变化,结果表明菲律宾蛤仔耗氧率的季节变化为0.02—0.56 mg-1个-1h-1,即0.50—13.49 mg-1个-1d-1。
排氨率及排磷率是反映海洋贝类新陈代谢水平的重要指标。关于埋栖性双壳贝类排氨率及排磷率的现场研究报道较少,仅见于庄河海域和胶州湾海域菲律宾蛤仔排氨率及排磷率的现场研究[5,27]。现场研究结果显示,庄河海域菲律宾蛤仔排氨率及排磷率变化分别为0.02—0.26 mg-1个-1d-1、0.01—0.39 mg-1个-1d-1;胶州湾菲律宾蛤仔排氨率变化为0.08—1.69 μmol/ind/h,即0.03—0.73 mg-1个-1d-1,排磷率变化为0.02—0.25 μmol/ind/h,即0.03—0.57 mg-1个-1d-1。本研究中双台子河口文蛤排氨率及排磷率周年变化分别为0.001—0.28 mg-1个-1d-1、0.002—0.16 mg-1个-1d-1。由于物种差异、实验贝类个体大小有异及实验海区环境条件的不同,难以比较二者耗氧率、排氨率及排磷率大小。
本研究结果表明,文蛤呼吸排泄速率的季节变化显著(P<0.05),表现为夏季最高,冬季最低,类似的季节变化规律也出现在菲律宾蛤仔[5,27]、Spisulasubtruncata[33]等埋栖性双壳贝类中。文蛤呼吸排泄速率呈现明显的季节变化趋势,这是因为文蛤的生长具有季节节律性,4—10月是其主要生长期,此时海区水温逐渐升高,夏季达到最高,海水中TPM和Chl a含量也达到最高值,表明文蛤的食物可获得性增强,致使文蛤的生长速率和生理代谢速率加快。本研究还发现,在同一季节,就单位个体而言,文蛤的耗氧率、排氨率及排磷率均表现为二龄<三龄。与文蛤相似,菲律宾蛤仔[27]、硬壳蛤(Mercenariamercenaria)[34]等埋栖性双壳贝类也表现出类似的规律。这可能是由于不同龄期贝类的生理代谢速率有所差异,且随着年龄增长而增加,从而表现出三龄个体的呼吸排泄速率大于二龄个体。
3.3 文蛤在双台子河口水层-底栖系统中的耦合作用


总之,文蛤通过滤食和生物沉积作用增加悬浮颗粒物从水柱到底部环境的通量;通过生物沉积物及其矿化作用对滩涂底质物理化学环境构成造成冲击;通过N、P排泄作用加速营养盐的循环,从而影响水层中的物理化学环境。文蛤的生物沉积及呼吸排泄等主要生理生态过程在整个河口水层-底栖系统耦合作用中扮演着重要生态角色。
[1] Davenport J, Smith R J J W, Packer M. MusselsMytilusedulis: significant consumers and destroyers of mesozooplankton. Marine Ecology Progress Series, 2000, 198: 131- 137.
[2] Mazzola A, Sara G. The effect of fish farming organic waste on food availability for bivalve molluscs (Gaeta Gulf, Central Tyrrhenian, MED): stable carbon isotopic analysis. Aquaculture, 2001, 192(2- 4): 361- 379.
[3] Cockcroft A C. Nitrogen excretion by the surf zone bivalvesDanaxSerraandD.sordulus. Marine Ecology Progress Series, 1990, 60: 57- 65.
[4] Zhou Y, Yang H S, Zhang F S. Nitrogen and phosphorus excretions by marine bivalves and the ecological effects. Journal of Fishery Sciences of China, 2003, 10(2): 165- 168.
[5] Wang X Y, Zhou Y, Yang H S.Insitustudy of respiration and excretion of the manila clamRuditapesphilippinarumin the Jiaozhou Bay. Oceanologia et Limnologia Sinica, 2011, 42(5): 722- 727.
[6] Smaal A C, Vonck A P M A. Seasonal variation in C, N and P budgets and tissue composition of the musselMytilusedulis. Marine Ecology Progress Series, 1997, 153: 167- 179.
[7] Compilation Committee of China′s Bay Records. China′s Bay Records, the Fourteenth Fascicules (Important Estuary). Beijing: Ocean Press, 1998: 432- 480.
[8] Zhang S P, Wang H X, Xu F S. Taxonomic study onMeretrix(Bivalvia, veneridae) from China seas. Acta Zootaxonomica Sinica, 2012, 37(3): 473- 479.
[9] Wang R C, Wang Z P, Zhang J Z. Marine Shellfish Aquaculture. Qingdao: Qingdao Ocean University Press, 1993: 322- 324.
[10] Chen Y, Jiang J Y, Li S L, Li K W, Wang Z S, Liu X F, Geng Z F, Song Y G. The biological resources survey of mudflat clams and other major creatures in Panjin Geligang and Xiaohe. Hebei Fisheries, 2012, (1): 46- 49.
[11] Tang B J, Liu B Z, Yang H S, Xiang J H. Oxygen consumption and ammonia-N excretion ofMeretrixmeretrixin different temperature and salinity. Chinese Journal of Oceanology and Limnology, 2005, 23(4): 469- 474.
[12] Fan J X. Studies on Metabolism ofMeretrixmeretrixLinnaeus [D]. Ningbo: Ningbo University, 2010.
[13] Fan J X, Lin Z H, Xiao G Q, Chai X L, Zhao Y Q, Lu R M, Zhang J M. Effects of starvation on oxygen consumption and ammonia excretion rates of three different sizesMeretrixmeretrixLinnaeus. Marine Sciences, 2009, 33(10): 73- 76.
[14] Feng J B, Wang M Z, Chen H C, Chen X L, Sun J M, Li J L. Effects of temperature and body size on oxygen consumption rate ofMeretrixmeretrix. Journal of Shanghai Fisheries University, 2004, 13(2): 126- 129.
[15] Zhuang S H, Wang Z Q. Influence of size, habitat and food concentration on the feeding ecology of the bivalve,MeretrixmeretrixLinnaeus. Aquaculture, 2004, 241(1- 4): 689- 699.
[16] Zhuang S H, Liu X M. The influence of fresh weight and water temperature on metabolic rates and the energy budget ofMeretrixmeretrixLinnaeus. Marine Biology, 2006, 150(2): 245- 252.
[17] Zhou Y, Yang H S. Biodeposition method used in bivalval physio-ecological studies. Chinese Journal of Ecology, 2002, 21(6): 74- 76.
[18] Grasshoff K, Ehrhardt M, Kremling K. Methods of Seawater Analysis. Weiheim: Verlag Chemie, 1983.
[19] Zhou Y, Zhang F S, Yang H S, Zhang S M, Ma X N. Comparison of effectiveness of different ashing auxiliaries for determination of phosphorus in natural waters, aquatic organism and sediment by ignition method. Water Research, 2003, 37(16): 3875- 3882.
[20] Yu W Q, Zhong S J. Freeze-drying pretreatment improves organic carbon determinations of marine sediments. Acta Scientiae Circumstantiae, 2007, 27(5): 861- 867.
[21] He C B, Chen H D. Study on the growth and ecological characteristics ofMeretrixmeretrixcultivated on tidal flat. Journal of Fisheries Science, 1997, 16(5): 17- 20.
[22] Zhou Y, Yang H S, Zhang T, Liu S L, Zhang S M, Liu Q, Xiang J H, Zhang F S. Influence of filtering and biodeposition by the cultured scallopChlamysfarrerion benthic-pelagic coupling in a eutrophic bay in China. Marine Ecology Progress Series, 2006, 317: 127- 141.
[23] Zhou Y, Yang H S, Zhang T, Qin P B, Xu X L, Zhang F S. Density-dependent effects on seston dynamics and rates of filtering and biodeposition of the suspension-cultured scallopChlamysfarreriin a eutrophic bay (northern China): an experimental study in semi-in situ flow-through systems. Journal of Marine System, 2006, 59(1- 2): 143- 158.
[24] Yuan X T, Zhang M J, Liang Y B, Liu D, Guan D M. Self-pollutant loading from a suspension aquaculture system of Japanese scallop (Patinopectenyessoensis) in the Changhai sea area Northern Yellow Sea of China. Aquaculture, 2010, 304(1- 4): 79- 87.
[25] Cranford P J, Armsworthy S L, Mikkelsen O A, Milligan T G. Food acquisition responses of the suspension-feeding bivalvePlacopectenmagellanicusto the flocculation and settlement of a phytoplankton bloom. Journal of Experimental Marine Biology and Ecology, 2005, 326(2): 128- 143.
[26] Han J, Zhang Z N, Yu Z S, Widdows J. Differences in the benthic-pelagic particle flux (biodeposition and sediment erosion) at intertidal sites with and without clam (Ruditapesphilippinarum) cultivation in eastern China. Journal of Experimental Marine Biology and Ecology, 2001, 261(2): 245- 261.
[27] Yuan X T, Zhang S L, Liu S X, Liang B, Liang Y B, Zhang G F. Self-pollution inRuditapesphilippinarumbottom-cultured area of Zhuanghe coast. Chinese Journal of Applied Ecology, 2011, 22(3): 785- 792.
[28] Mitchell I M.Insitubiodeposition rates of pacific oysters (Crassostreagigas) on a marine farm in Southern Tasmania (Australia). Aquaculture, 2006, 257(1- 4): 194- 203.
[29] Wang J, Jiang Z H, Chen R S. Study on biodeposition by oysterCrassostreagigas. Journal of Fisheries of China, 2005, 29(3): 344- 349.
[30] Lauringson V, Mälton E, Kotta J, Kangur K, Orav-Kotta H, Kotta I. Environmental factors influencing the biodeposition of the suspension feeding bivalveDreissenapolymorpha(Pallas): comparison of brackish and freshwater populations. Estuarine Coastal and Shelf Science, 2007, 75(4): 459- 467.
[31] Wang J, Jiang Z H, Chen R S. Assimilation efficiency and biodeposition of musselMytiluscrassitesta. Journal of Fishery Sciences of China, 2005, 12(2): 150- 155.
[32] Hawkins A J S, Bayne B L, Bougrier S, Heral M, Iglesias J I P, Navarro E, Smith R F M, Urrutia M B. Some general relationships in comparing the feeding physiology of suspension feeding bivalve molluscs. Journal of Experimental Marine Biology and Ecology, 1998, 219(1- 2): 87- 103.
[33] Rueda J L, Smaal A C. Variation of the physiological energetics of the bivalveSpisulasubtruncata(dacosta, 1778) within an annual cycle. Journal of Experimental Marine Biology and Ecology, 2004, 301(2): 141- 157.
[34] Wen H X, Zhang T, Yang H S, Liu B Z, Zhou Y, Mao Y Z, Zhang F S. Effect of temperature on respiration and excretion of hard clamMercenariamercenaria(Linnaeus, 1758). Oceanologia et Limnologia Sinica, 2004, 35(6): 549- 554.
[35] Zhou X. AninsituStudy on Effect of the Bottom-Cultured ClamRuditapesphilippinarumon Ecological Environment in Jiaozhou Bay, China [D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2006.
参考文献:
[4] 周毅, 杨红生, 张福绥. 海水双壳贝类的N、P排泄及其生态效应.中国水产科学, 2003, 10(2): 165- 168.
[5] 王晓宇, 周毅, 杨红生. 胶州湾菲律宾蛤仔(Ruditapesphilippinarum)呼吸排泄作用的现场研究. 海洋与湖沼, 2011, 42(5): 722- 727.
[7] 中国海湾志编纂委员会. 中国海湾志, 第十四分册(重要河口). 北京: 海洋出版社, 1998: 432- 480.
[8] 张素萍, 王鸿霞, 徐凤山. 中国近海文蛤属(双壳纲, 帘蛤科)的系统分类学研究. 动物分类学报, 2012, 37(3): 473- 479.
[9] 王如才, 王昭萍, 张建中. 海水贝类养殖学. 青岛: 青岛海洋大学出版社, 1993: 322- 324.
[10] 陈 远, 姜靖宇, 李石磊, 李可闻, 王志松, 刘项峰, 耿志孚, 宋永刚. 盘锦蛤蜊岗、小河滩涂文蛤及其相关资源调查报告. 河北渔业, 2012, (1): 46- 49.
[12] 范建勋. 文蛤能量代谢的研究 [D]. 宁波: 宁波大学, 2010.
[13] 范建勋, 林志华, 肖国强, 柴雪良, 赵一强, 陆荣茂, 张炯明. 饥饿对3种不同规格文蛤耗氧率和排氨率的影响. 海洋科学, 2009, 33(10): 73- 76.
[14] 冯建斌, 王美珍, 陈汉春, 陈贤龙, 孙建苗, 李家乐. 温度和规格对文蛤耗氧率的影响. 上海水产大学学报, 2004, 13(2): 126- 129.
[17] 周毅, 杨红生. 应用于贝类生理生态学研究的生物沉积法. 生态学杂志, 2002, 21(6): 74- 76.
[20] 于雯泉, 钟少军. 海洋沉积物有机碳分析方法中干燥预处理过程人为误差的发现及意义. 环境科学学报, 2007, 27(5): 861- 867.
[21] 赫崇波, 陈洪大. 滩涂养殖文蛤生长和生态习性的初步研究. 水产科学, 1997, 16(5): 17- 20.
[27] 袁秀堂, 张升利, 刘述锡, 梁斌, 梁玉波, 张国范. 庄河海域菲律宾蛤仔底播增殖区自身污染. 应用生态学报, 2011, 22(3): 785- 792.
[29] 王俊, 姜祖辉, 陈瑞盛. 太平洋牡蛎生物沉积作用的研究. 水产学报, 2005, 29(3): 344- 349.
[31] 王俊, 姜祖辉, 陈瑞盛. 厚壳贻贝的同化率及其生物沉积作用. 中国水产科学, 2005, 12(2): 150- 155.
[34] 文海翔, 张涛, 杨红生, 刘保忠, 周毅, 毛玉泽, 张福绥. 温度对硬壳蛤Mercenariamercenaria(Linnaeus, 1758)呼吸排泄的影响. 海洋与湖沼, 2004, 35(6): 549- 554.
[35] 周兴. 菲律宾蛤仔(Ruditapesphilippinarum)对胶州湾生态环境影响的现场研究 [D]. 青岛: 中国科学院海洋研究所, 2006.
Influence of biodeposition, respiration, and excretion of the buried clamMeretrixmeretrixon the pelagic-benthic coupling in Shuangtaizi Estuary
ZHANG Anguo1,2,3, YUAN Xiutang1,*, HOU Wenjiu2, CHEN Weixin4, ZHAO Kai4, BA Fuyang4, ZHANG Zuozhen4
1NationalMarineEnvironmentalMonitoringCenter,StateOceanicAdministration(SOA),Dalian116023,China2CollegeofAnimalHusbandryandVeterinary,LiaoningMedicalUniversity,Jinzhou121001,China3SchoolofMarineScience,NingboUniversity,Ningbo315211,China4PanshanMarineFisheriesBureau,Panjin124010,China
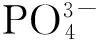
Meretrixmeretrix; biodeposition; respiration; excretion; pelagic-benthic coupling; Shuangtaizi Estuary
海洋公益性行业科研专项经费项目(201305043, 200805069); 国家海洋局近岸海域生态环境重点实验室开放基金(201311); 锦州市科学技术计划项目 (13A1E14)
2013- 02- 26; 网络出版日期:2014- 03- 14
10.5846/stxb201302260306
*通讯作者Corresponding author.E-mail: xtyuan@nmemc.gov.cn
张安国,袁秀堂,侯文久,陈卫新,赵凯,巴福阳,张作振.文蛤的生物沉积和呼吸排泄过程及其在双台子河口水层-底栖系统中的耦合作用.生态学报,2014,34(22):6573- 6582.
Zhang A G, Yuan X T, Hou W J, Chen W X, Zhao K, Ba F Y, Zhang Z Z.Influence of biodeposition, respiration, and excretion of the buried clamMeretrixmeretrixon the pelagic-benthic coupling in Shuangtaizi Estuary.Acta Ecologica Sinica,2014,34(22):6573- 6582.

