不同Bt蛋白对棉铃虫存活率和生长发育的影响
路献勇, 张 帅, 吕丽敏, 雒珺瑜, 王春义, 崔金杰
中国农业科学院棉花研究所,棉花生物学国家重点实验室,河南 安阳 455000
自1990年国外首次用农杆菌介导法获得Cry1Ab、Cry1Ac转基因棉花植株以来(Perlaketal.,1990),编码Cry1Ac蛋白的基因已成功应用于植物基因工程,并培育出了转基因抗虫棉用于大规模生产。中国研究人员也于1993年将Cry1Ac基因导入到中国主产棉区的数个栽培品种中,获得了第1代单价抗虫棉(郭三堆等,1999)。目前中国主要以种植转单价Bt基因的抗虫棉花为主,由于转入的Bt基因类型单一,长期种植容易导致棉铃虫HelicoverpaarmigeraHübner对Cry1Ac基因的抗性增加,因此,为了延缓靶标害虫对Cry1Ac蛋白的抗性,培育叠加基因的抗虫棉花品种受到广泛重视。目前,转Cry1Ac+Cry2Ab基因棉已在美国、澳大利亚、墨西哥等国家商业化种植,我国也培育出了转双价基因Cry1Ac+Cry2Ab的抗虫棉(雒珺瑜等,2011)。为了揭示不同Bt蛋白的抗虫效果,本文研究了Cry1Ac、Cry1Ab、Cry2Ab、Cry1Ah、Cry2Aa和Cry1Ca 6种Bt蛋白对棉铃虫幼虫室内种群存活率、体重和生长发育的影响,期望为新一代转基因抗虫棉花的培育提供依据,为新型转基因棉花材料的抗虫性鉴定和安全评价提供参考。
1 材料与方法
1.1 供试棉铃虫
室内敏感品系:2005年6月采自河南省安阳县白壁镇中国农业科学院棉花研究所棉田第2代,在室内不用任何药剂处理,连续用人工饲料饲养70代。
1.2 供试Bt蛋白
Cry1Ac、Cry1Ab、Cry2Ab、Cry1Ah、Cry2Aa和Cry1Ca 6种Bt蛋白均由中国农业科学院植物保护研究所中保科农公司(北京)提供。
1.3 棉铃虫人工饲料
采用卓乐姒等(1981)的棉铃虫人工饲料配方经稍微改进。人工饲料配方如下:黄豆粉200 g,玉米粉300 g,小麦粉300 g,抗坏血酸10 g,酵母粉80 g,甲醛10 mL,36%乙酸60 mL,苯甲酸钠9 g,琼脂35 g,水2000 mL。成虫期饲喂10%的蜂蜜水。养虫室每月用紫外灯消毒1次,棉铃虫蛹用甲醛消毒15 min,以防止棉铃虫遭受核角体病毒的侵染。
在配制饲料过程中,当饲料内的温度降到55~60 ℃时,取不同浓度的Bt蛋白分别加到不同处理的人工饲料中,每个处理的饲料量为100 g;用搅棒迅速搅匀,待饲料凝固后放入4 ℃冰箱备用。使用前切成1 g左右的块状,分别放入24孔培养板中用于饲养棉铃虫幼虫,培养板表面覆盖白布以防止幼虫逃逸。
1.4 生物测定方法
1.4.1 不同Bt蛋白对棉铃虫初孵幼虫的毒力测定 测定包括预备试验和正式试验2个部分。预备试验共设置5个质量浓度梯度,将供试幼虫的死亡率控制在10%~90%范围内;其中Cry1Ab、Cry1Ac和Cry2Ab的浓度梯度为1.0、0.5、0.1、0.01和0.001 μg·g-1;Cry1Ah、Cry2Aa和Cry1Ca的质量浓度梯度为20.0、5.0、2.0、1.0和0.5 μg·g-1。正式试验共设置7个浓度梯度,其中Cry1Ac、Cry1Ab和Cry2Ab的浓度梯度为1.0、0.5、0.2、0.1、0.05、0.01和0.001 μg·g-1;Cry1Ah、Cry2Aa和Cry1Ca的浓度梯度为20.0、10.0、5.0、2.5、1.25、0.625和0.3125 μg·g-1。均用5 mL的Na2CO3溶液作为对照。
毒力测定前先用pH 9.5的Na2CO3溶液对毒蛋白进行稀释,然后将稀释后的Bt毒蛋白混入饲料中(Beegleetal.,1990)。测定时在饲料中接入孵化后1日龄幼虫(24 h±2 h),在温度(27±1) ℃、湿度(75±5)%、光周期(光照/黑暗)14/10以及合适的光强条件下饲养。每处理24头幼虫,重复6次。饲养7 d后记录幼虫存活数,计算校正死亡率。用SPSS 19.0软件进行Probit回归分析,计算LC50值(贾春生,2006)。
1.4.2 不同Bt蛋白对棉铃虫幼虫生长发育的影响 配制饲料前用pH 9.5的Na2CO3溶液分别将6种蛋白稀释成100 μg·mL-1,配制饲料时取稀释好的Bt蛋白溶液5 mL混入100 g饲料,使其在饲料中的浓度为1.0 μg·g-1,对照仅混入5 mL的Na2CO3。
测定设初孵幼虫、1龄幼虫和2龄幼虫3组试验。每组试验设6种Bt蛋白和对照共7个处理,每处理32头幼虫,重复3次。测定时在饲料中接入幼虫,放置在与1.4.1相同的条件下饲养。初孵幼虫和1龄幼虫饲养7 d后,分别记录幼虫死亡率,并用电子天平(精确到0.00001 g)称取所有活虫体重,计算体重抑制率。
体重抑制率(%)=(对照组平均体重-处理后平均体重)/对照组平均体重×100。
2龄幼虫饲养3、5、7和9 d后分别称取幼虫体重,每天记录幼虫发育天数、化蛹数、蛹重、蛹期天数和羽化数,直至羽化完成。试验数据用SAS 8.1软件分析。
2 结果与分析
2.1 不同Bt蛋白对棉铃虫初孵幼虫的毒力测定
由表1可知,不同Bt蛋白对棉铃虫的毒力效应不同,用Bt蛋白连续饲喂7 d后的致死中浓度(LC50)依次为Cry1Ab>Cry1Ac>Cry2Ab>Cry2Aa>Cry1Ah。
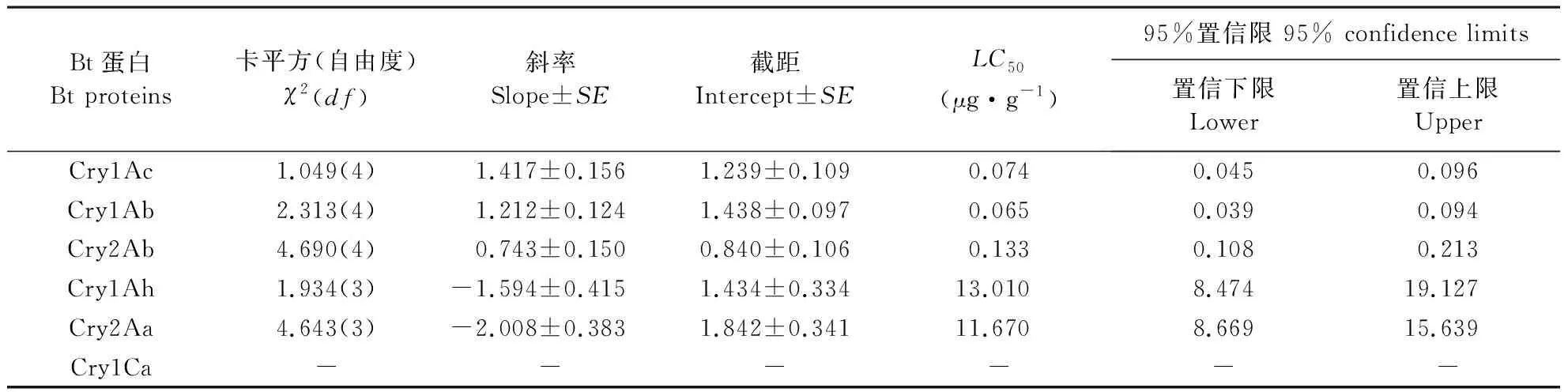
表1 不同Bt蛋白处理的棉铃虫初孵幼虫的致死中浓度(LC50)和线性回归方程参数Table 1 Mean lethal concentrations (LC50)and probit regression line parameters of Bt proteins against the newly hatched larvae of cotton bollworm (H.armigera)
2.2 不同Bt蛋白对棉铃虫低龄幼虫校正死亡率和体重抑制率的影响
棉铃虫初孵幼虫和1龄幼虫取食含不同Bt蛋白饲料7 d后,不同处理间的校正死亡率有极显著差异(初孵幼虫,df=5,F=341.81,P<0.0001;1龄幼虫,df=5,F=329.02,P<0.0001)。不同处理间的体重抑制率也有极显著差异(初孵幼虫,df=5,F=337.50,P<0.0001;1龄幼虫,df=5,F=57.84,P<0.0001)。Cry1Ac和Cry1Ab蛋白对棉铃虫初孵幼虫的校正死亡率极显著高于Cry2Ab蛋白,与Cry2Ab蛋白相比,Cry1Ah和Cry2Aa蛋白处理的棉铃虫初孵幼虫的校正死亡率显著降低,Cry1Ca处理下,初孵幼虫死亡率极显著低于另外5种蛋白。而对于1龄棉铃虫则略有不同,Cry1Ab蛋白显著高于其余5种蛋白,Cry1Ac和Cry2Ab蛋白极显著高于Cry1Ah、Cry2Aa和Cry1Ca,而Cry1Ah蛋白极显著高于Cry2Aa,Cry1Ca蛋白极显著低于Cry2Aa。Cry1Ac、Cry1Ab和Cry2Ab处理的初孵幼虫体重抑制率极显著高于Cry1Ah和Cry2Aa蛋白处理,而Cry1Ca处理下的棉铃虫体重抑制率则极显著低于Cry1Ah和Cry2Aa蛋白;6种蛋白处理的1龄幼虫的体重抑制率的多重比较结果与初孵幼虫相同(图1)。
2.3 不同Bt蛋白处理棉铃虫2龄幼虫后的体重变化
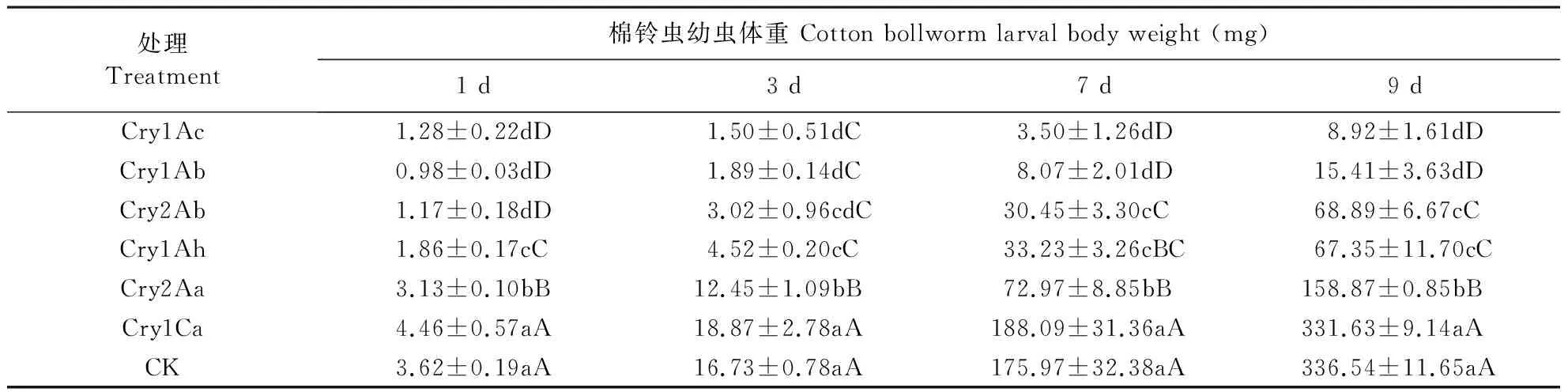
棉铃虫2龄幼虫取食含不同Bt蛋白的饲料后,不同处理间幼虫体重有极显著性差异(1 d,df=6,F=175.29,P<0.0001;3 d,df=6,F=94.77,P<0.0001;7 d,df=6,F=66.42,P<0.0001;9 d,df=6,F=924.33,P<0.0001)。多重比较结果表明,对照和Cry1Ca处理之间棉铃虫的体重在1、3、7和9 d均没有显著差异;Cry1Ac、Cry1Ab处理下的2龄幼虫仅在9 d后体重极显著高于Cry2Ab蛋白;而Cry1Ah处理下的幼虫体重仅在7 d后显著低于Cry2Aa,而在1、3和9 d后均是极显著低于该蛋白。与Cry2Ab相比,Cry1Ah处理下的幼虫体重仅在1 d后极显著增加,其他时间段均没有显著差异(表2)。
2.4 不同Bt蛋白处理棉铃虫2龄幼虫后的生物学参数差异
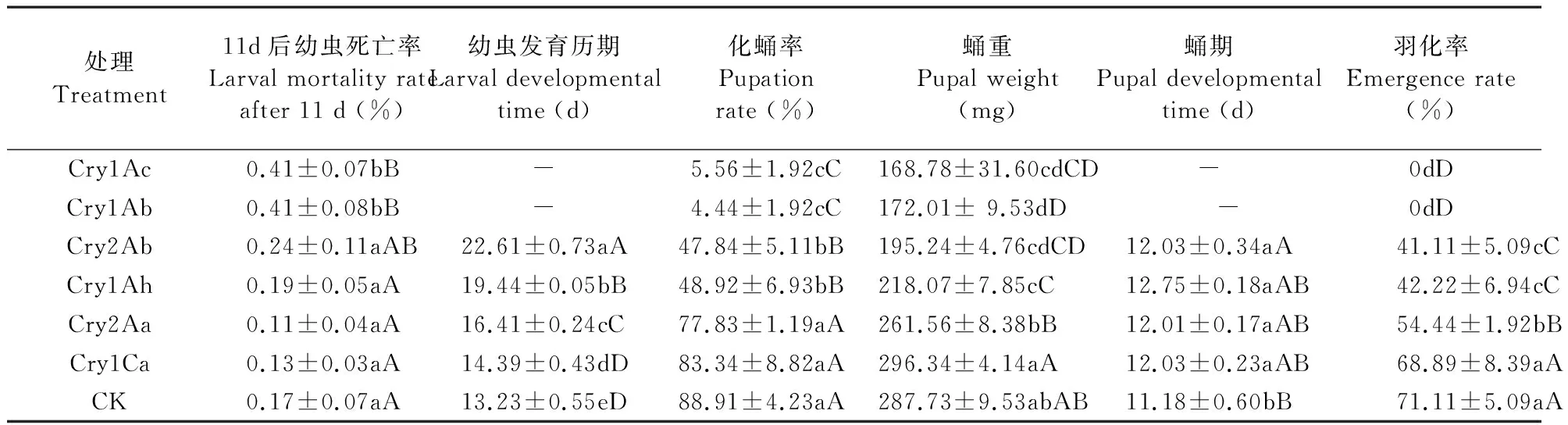
棉铃虫2龄幼虫取食含不同Bt蛋白的饲料后,不同处理间除了蛹期显著差异外,其他生物学参数均为极显著差异(11 d后幼虫死亡率,df=6,F=9.47,P=0.0006<0.001;幼虫发育历期,df=4,F=183.54,P<0.0001;化蛹率,df=6,F=97.92,P<0.0001;蛹重,df=6,F=27.92,P<0.001;蛹期,df=4,F=6.41,P=0.0129<0.05;羽化率,df=6,F=107.37,P<0.0001)。Cry1Ac和Cry1Ab蛋白处理下11 d后棉铃虫的死亡率显著高于其他4种蛋白,差异不显著。用Cry1Ac和Cry1Ab蛋白处理的棉铃虫无法完成整个幼虫发育历期,而用Cry1Ah、Cry2Aa、Cry2Ab、Cry1Ca和对照处理的棉铃虫幼虫发育历期均有显著差异,幼虫发育历期的顺序为CK 图1 1.0 μg·g-1不同Cry蛋白对棉铃虫初孵幼虫和1龄幼虫校正死亡率和体重抑制率的影响Fig.1 Abbott-corrected mortality rates and weight inhibition rates caused by active Cry proteins against the newly hatched and first-instar larvae of cotton bollworm (H.armigera) fed with 1.0 μg of toxin /g food图中数据为平均数±标准误;柱子上不同字母表示数据经Duncan氏法多重比较差异显著,大写字母表示差异极显著(P<0.01),小写字母表示差异显著(P<0.05)。The data in the figure are mean±SE, and bars with the different letters above are significantly different by Duncan′s multiple ranging test. Capital letters show highly extremely significant differences (P<0.01), and small letters, show significant differences (P<0.05). 处理Treatment棉铃虫幼虫体重 Cotton bollworm larval body weight (mg)1 d3 d7 d9 dCry1Ac1.28±0.22dD1.50±0.51dC3.50±1.26dD8.92±1.61dDCry1Ab0.98±0.03dD1.89±0.14dC8.07±2.01dD15.41±3.63dDCry2Ab1.17±0.18dD3.02±0.96cdC30.45±3.30cC68.89±6.67cCCry1Ah1.86±0.17cC4.52±0.20cC33.23±3.26cBC67.35±11.70cCCry2Aa3.13±0.10bB12.45±1.09bB72.97±8.85bB158.87±0.85bBCry1Ca4.46±0.57aA18.87±2.78aA188.09±31.36aA331.63±9.14aACK3.62±0.19aA16.73±0.78aA175.97±32.38aA336.54±11.65aA 表中不同字母表示数据经Duncan氏法多重比较差异显著,大写字母表示差异极显著(P<0.01),小写字母表示差异显著(P<0.05)。Different letters represent significant differences among treatments when using a Duncan′s multiple ranging test. Capital letters show highly significant differences (P<0.01) and small letters, significant differences (P<0.05). 表3 1.0 μg ·g-1的6种Bt蛋白分别处理棉铃虫2龄幼虫后生物学参数的显著差异Table 3 Responses of cotton bollworm fed with 1.0 μg of the six types of Bt proteins /g food 表中不同字母表示数据经Duncan氏法多重比较差异显著,大写字母表示差异极显著(P<0.01),小写字母表示差异显著(P<0.05)。Different letters represent significant differences among treatments when using a Duncan′s multiple ranging test. Capital letters show highly significant differences (P<0.01) and small letters, significant differences (P<0.05). 本文系统测定了Cry1Ac、Cry1Ab、Cry2Ab、Cry1Ah、Cry2Aa和Cry1Ca 6种蛋白对棉铃虫幼虫的毒力,国内外也有一些文献报道了Cry蛋白对棉铃虫毒力(韩岚岚等,2008;Leeetal.,1996; Chakrabartietal.,1998; Kaliaetal.,2005; Li & Bouwer,2012)。 在澳大利亚,已报道只有Cry1Ab、Cry1Ac、Cry2Aa和Cry2Ab蛋白能够在可接受的剂量下杀死棉铃虫,而Cry1Ca被认为对棉铃虫是无毒的(Liaoetal.,2002)。在印度,Cry1Ac对棉铃虫幼虫的毒力最大,Cry1Ab和Cry1Aa次之(Kaliaetal.,2005)。在南非,Cry1Ac和Cry2Aa对棉铃虫的毒力最大,Cry1Ab次之,Cry1Aa毒性较小(Li & Bouwer,2012)。在中国,Cry1Ac被认为是对棉铃虫幼虫毒力最强的Cry蛋白,Cry2Ab次之,此外,Cry1Ah对棉铃虫幼虫也有一定的杀虫活性,但由于纯化时易形成寡聚体导致其杀虫活性不很稳定(韩岚岚等,2008; 周子珊等,2011)。而本试验中测得的LC50显示,Cry1Ab和Cry1Ac对棉铃虫幼虫的毒力最强,Cry2Ab次之,Cry1Ah和Cry2Aa对棉铃虫幼虫毒性较低。由此可见,不同国家和地区的棉铃虫种群对同一Bt毒素的敏感性存在差异,其原因可能是长时间的地理隔离。 估算棉铃虫田间种群抗性基因频率时,一般采用Wuetal.(1999)确定的1.0 μg·mL-1饲料为诊断浓度。李海强等(2012)对新疆北部地区转Bt基因棉外源蛋白的表达量进行了测定,发现4个品种苗期叶片的Bt(Cry1Ac)蛋白含量平均为1.0 μg·g-1左右时,对当地棉铃虫有较好的控制作用。本试验以相同质量浓度(1.0 μg·g-1)的6种Bt蛋白分别对棉铃虫初孵幼虫、1龄幼虫和2龄幼虫进行处理,发现Cry1Ab和Cry1Ac对3种发育状态下的棉铃虫幼虫毒性均是最强,用这2种蛋白对2龄幼虫连续处理,棉铃虫羽化率为0,不能完成整个生长发育。Cry2Ab对2龄前的幼虫控制效果较好,但对2龄幼虫控制较差;而Cry1Ah和Cry2Aa对2龄前的棉铃虫毒力接近,LC50几乎相近,但两者对2龄幼虫控制效果却相差很大,可能是由于Cry1Ah蛋白纯化过程中形成了寡聚体,杀虫活性不稳定引起的(周子珊等,2011)。 为了阻止或推迟靶标害虫对Cry1Ac蛋白抗性的产生,人们提出了多基因策略,即将多个Bt基因同时转入植物中用来控制农田害虫,Cry1Ac和Cry2Aa、Cry1Ac和Cry2Ab可被同时转入植物中控制棉铃虫,因为这2个蛋白可使用不同的受体结合位点(Cacciaetal.,2010;Gahanetal.,2005)。对Cry1Ac产生抗性的棉铃虫品系,对Cry2Aa和Cry2Ab是敏感的(Akhursttetal.,2003)。而对Cry2Ab产生抗性的棉铃虫品系,则被认为对Cry2Aa也有抗性,但对Cry1Ac敏感(Mahonetal.,2007)。尽管Cry2Ab、Cry2Aa和Cry1Ah对棉铃虫幼虫的毒性不如Cry1Ab和Cry1Ac,但是仍然可以作为控制中国棉铃虫幼虫的替代策略。 郭三堆, 崔洪志, 夏兰芹. 1999. 双价抗虫转基因棉花研究. 中国农业科学, 32(3): 3-9. 韩岚岚, 宋福平, 张杰. 2008. 苏云金芽孢杆菌杀虫晶体蛋白对棉铃虫活性分析. 东北农业大学学报, 39(8): 21-24. 贾春生. 2006. 利用SPSS软件计算杀虫剂的LC50. 昆虫知识, 43(3): 414-417. 李海强, 李号宾, 王冬梅. 2012. 转基因抗棉铃虫抗草甘膦棉花对棉铃虫的抗虫性及对二种地老虎幼虫生长发育的影响. 应用昆虫学报, 49(4): 882-888. 雒珺瑜, 崔金杰, 辛惠江. 2011. 转Cry1Ac+Cry2Ab基因棉花对天敌生长发育的影响. 中国棉花, 38(12): 11-12. 周子珊, 束长龙, 梁革梅, 苍晶,宋福平,张杰. 2011. Cry1Ah蛋白活性片段在溶液中的单体和寡聚体杀虫活性分析. 植物保护, 37(3): 48-51. 卓乐姒, 黄月兰, 杨家荣. 1981. 棉铃虫人工饲料的研究. 昆虫学报, 24(1): 108-110. Akhurstt R J, James W and Bird L J. 2003. Resistance to the Cry1Ac delta-endotoxin ofBacillusthuringiensisin the cotton bollworm,Helicoverpaarmigera(Lepidoptera : Noctuidae).JournalofEconomicEntomology, 96: 1290-1299. Beegle C C, Hickle L A and Fitch W L. 1990. Bioassay methods for quantification ofBacillusthuringiensisdelta-endotoxins∥Hickle L A and Fitch W L.AnalyticalChemistryofBacillusthuringiensis. Washington, DC: American Chemical Society, 14-21. CacciaA S, Hemandez-rodriguez C S and Mahon R J. 2010. Binding site alteration is responsible for field-isolated resistance toBacillusthuringiensisCry2A insecticidal proteins in twoHelicoverpaspecies.PLoSONE, 5: e9975. Chakrabarti S K, Mandaokar A and Kumar P A. 1998. Efficacy of lepidopteran specific delta-endotoxins ofBacillusthuringiensisagainstHelicoverpaarmigera.JournalofInvertebratePathology, 72: 336-337. Gahan L J, Ma Y T and Coble M L M. 2005. Genetic basis of resistance to Cry1Ac and Cry2Aa inHeliothisvirescens(Lepidoptera: Noctuidae).JournalofEconomicEntomology, 98: 1357-1368. Lee M K, Curtiss A and Alcantara E. 1996. Synergistic effect of theBacillusthuringiensistoxins CryIAa and CryIAc on the gypsy moth,Lymantriadispar.AppliedandEnvironmentalMicrobiology, 62: 583-586. Liao C Y, Heckel D G and Akhurst R. 2002. Toxicity ofBacillusthuringiensisinsecticidal proteins forHelicoverpaarmigeraandHelicoverpapunctigera(Lepidoptera : Noctuidae), major pests of cotton.JournalofInvertebratePathology, 8: 55-63. Li H and Bouwer G. 2012. Toxicity ofBacillusthuringiensisCry proteins toHelicoverpaarmigera(Lepidoptera: Noctuidae) in South Africa.JournalofInvertebratePathology, 109:110-116. Mahon R J, Olsen K M and Downes S. 2007. Frequency of alleles conferring resistance to the Bt toxins Cry1Ac and Cry2Ab in Australian populations ofHelicoverpaarmigera(Lepidoptera : noctuidae).JournalofEconomicEntomology, 100: 1844-1853. Perlak F J, Deaton R W and Armstrong T A. 1990. Insect resistant cotton plants.Bio-Technology, 8: 939-943. Wu K, Guo Y and Lv N. 1999. Geographic variation in susceptibility ofHelicoverpaarmigera(Lepidoptera: Noctuidae) toBacillusthuringiensisinsecticidal protein in China.JournalofEconomicEntomology, 92: 273-278.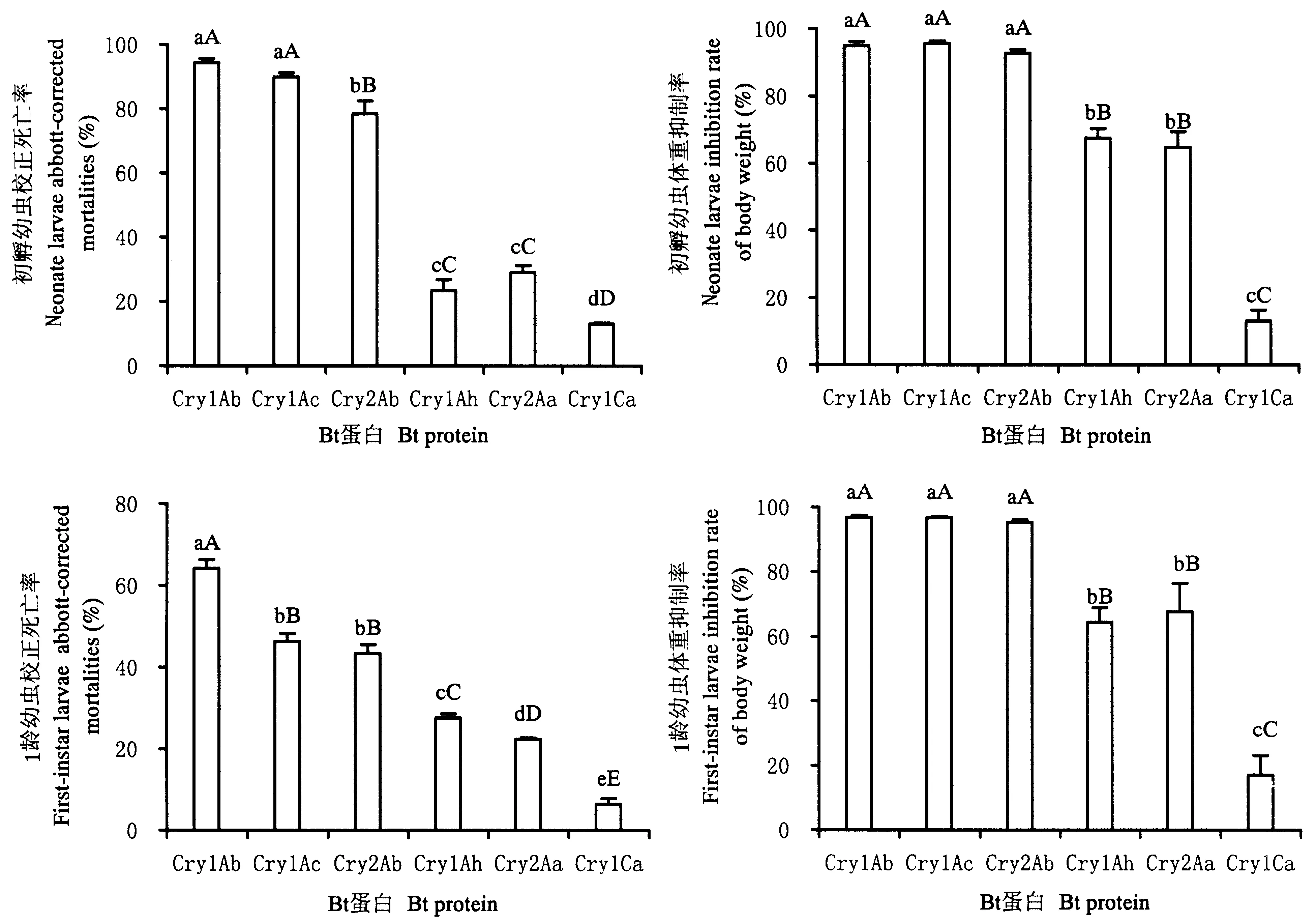
3 讨论

