萘酰亚二胺-多胺缀合物与DNA作用的光谱研究
田智勇, 王玉霞, 赵中华, 赵 瑾,2, 王超杰,2
(1.河南大学 化学生物学研究所,河南 开封 475004;2.河南大学 天然药物与免疫工程重点实验室,河南 开封 475004)
萘酰亚二胺-多胺缀合物与DNA作用的光谱研究
田智勇1, 王玉霞1, 赵中华1, 赵 瑾1,2, 王超杰1,2
(1.河南大学 化学生物学研究所,河南 开封 475004;2.河南大学 天然药物与免疫工程重点实验室,河南 开封 475004)
在人体生理条件下(pH =7.4),采用紫外光谱法和荧光光谱法研究了萘酰亚二胺-多胺缀合物(1)与鲱鱼精DNA的作用.研究发现DNA的加入使化合物1的紫外吸收光谱发生减色效应且出现红移现象,提示化合物1与DNA 发生强烈的嵌插作用.采用变温荧光光谱法研究发现荧光淬灭机制为静态淬灭,根据荧光数据计算出不同温度下的结合常数、结合位点数及热力学参数,发现化合物与DNA作用力类型主要是氢键.
萘酰亚二胺;多胺缀合物;DNA;光谱法
许多分子能与DNA分子发生相互作用,进而影响DNA的复制,因此研究小分子与DNA的作用,对于从分子水平上了解抗癌药物作用机理以及以DNA为靶点的药物分子设计具有重要意义[1].
多胺,一般指含三个或三个以上自由氮原子的有机化合物,最简单的是腐胺(putrescine, Put)、亚精胺(spermidine, Spd)和精胺(spermine, Spm). 多胺在正常生理环境下多以正离子的形式与DNA结合而具有对DNA嵌入能力[2-3],而通过考察药物与DNA相互作用的光谱学现象,可以确定药物与DNA的作用方式,有助于从分子水平上了解药物的作用机理,进而为开发新的抗癌药物提供理论依据.
1,8-萘酰亚胺类化合物具有良好的平面刚性结构,有利于分子同DNA的结合特别是嵌入能力从而发挥抗肿瘤活性,作为代表性萘酰亚胺类化合物氨萘非特 (Amonafide)已经处入III期临床试验阶段[4].
我们前期工作发现萘酰亚胺-多胺缀合物(包括萘酰亚二胺)具有良好的抗肿瘤活性、对DNA有嵌入作用,并能够引起肿瘤细胞凋亡[4-8],初步发现萘酰亚胺-多胺作用引起的荧光淬灭机制为静态淬灭[7].但对于萘酰亚二胺-多胺缀合物与DNA作用的尚未研究.因此本文利用紫外光谱和荧光光谱研究了萘酰亚二胺-多胺缀合物(1,图1)与鲱鱼精DNA作用特征.
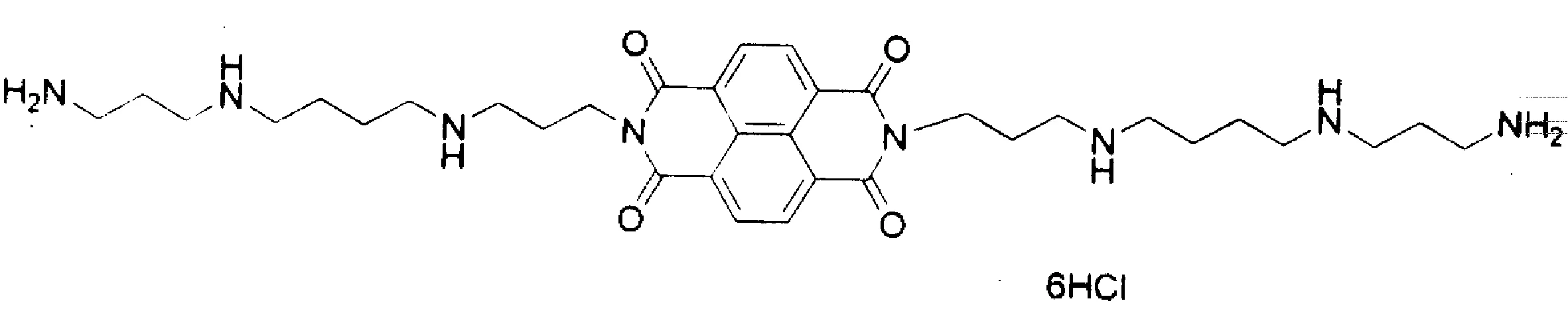
图1 萘酰亚二胺-多胺缀合物结构(1)Fig.1 Structure of naphthaliimide-polyamine conjugate
1 实验部分
1.1仪器与试剂
Cary Eclipse型荧光分光光度计(美国VARIAN公司),UV-540紫外分光光度计(美国UNICAM公司).
实验中所用化合物1由本实验室合成,结构经过1H NMR、13CNMR,MS,元素分析等确认.鲱鱼精 DNA(超纯,10g/瓶)、溴化乙锭(EB)购自北京拜尔迪生物技术有限公司.
1.2紫外光谱和荧光光谱研究
1.2.1 样品配制 Tris-HCl缓冲溶液配制:称取三羟甲基氨基甲烷(Tris)12.11 g,用蒸馏水稀释至800-900mL,用20%的盐酸水溶液调节pH=7.4,配成Tris-HCl缓冲液1000mL.
化合物1溶液配制:称取化合物适量,用Tris-HCl缓冲液配成浓度为2.0×10-4mol·L-1的溶液50mL.
鲱鱼精DNA溶液配制:称取鲱鱼精DNA15.8mg用Tris-HCl缓冲液配制50mL溶液,经紫外光谱测定其在266nm处的吸收度,依据Lambert定律,计算鲱鱼精DNA溶液浓度为22.82×10-5mol·L-1.存储于冰箱(4°C),使用时间最长不超过3天.
溴化乙锭溶液配制:称取溴化乙锭(EB)3mg,用Tris-HCl缓冲液配制成浓度为1.57×10-5mol·L-1的溶液50mL.
1.2.2 紫外光谱研究 量取化合物1溶液2ml,分别加入鲱鱼精DNA溶液0.0、0.1、0.2、0.3、0.6、0.9、1.2、1.5、1.8、2.1、2.7、3.0mL混合均匀,然后分别用Tris-HCl缓冲溶液稀释至5mL,摇匀、静置半小时进行紫外光谱测定,则溶液中DNA浓度分别为:0.0,4.56×10-6,9.13×10-6,13.69×10-6,27.4×10-6,41.08×10-6,54.77×10-6,68.46×10-6,82.15×10-6,95.84×10-6,109.54×10-6,123.23×10-6和136.92×10-6mol·L-1,化合物1的浓度为80.0×10-6mol·L-1.
1.2.3 荧光光谱研究 量取化合物1溶液2ml,分别加入鲱鱼精DNA溶液0.0、0.1、0.2、0.3、0.6、0.9、1.2、1.5、1.8、2.1、2.7、3.0mL混合均匀,然后分别用Tris-HCl缓冲溶液稀释至5mL,摇匀、静置半小时进行荧光测定,测定时温度分别为25、30、37°C.溶液中DNA浓度分别为:0.0,4.56×10-6,9.13×10-6,13.69×10-6,27.4×10-6,41.08×10-6,54.77×10-6,68.46×10-6,82.15×10-6,95.84×10-6,109.54×10-6,123.23×10-6和136.92×10-6mol·L-1,化合物1的浓度为80.0×10-6mol·L-1.
量取鲱鱼精DNA 0.3ml、EB缓冲溶液0.5mL,分别与0.0、0.1、0.2、0.3、0.6、0.9、1.2,、1.5、1.8、2.1、2.7、3.0mL化合物1溶液混合,然后分别用Tris-HCl缓冲溶液稀释至5mL,摇匀、静置半小时进行荧光测定,测定时温度分别为25、30、37°C.样品中1浓度分别为:0.0、4×10-6、8×10-6、12×10-6、24×10-6、36×10-6、48×10-6、60×10-6、72×10-6、84×10-6、96×10-6、108×10-6、120×10-6mol·L-1,DNA和EB浓度分别为13.7×10-6和15.7×10-6mol·L-1.
3 结果与讨论
3.1紫外光谱法研究萘酰亚二胺-多胺缀合物(1)与鲱鱼精DNA的相互作用
图2为实验测得的萘酰亚二胺-多胺缀合物(1)与鲱鱼精DNA相互作用的紫外吸收光谱.从图2 可以看出, 化合物在362和384nm处有两个吸收峰,这与萘酰亚胺-多胺缀合物的UV有所不同,这可能与萘酰亚二胺比萘酰亚胺多一个环有关[9].并且随着DNA 的不断加入, 化合物(1)的最大吸收峰强度逐渐减小且出现红移现象.萘酰亚二胺-多胺缀合物紫外吸收峰主要来源于萘环生色团的π-π*跃迁[10-11].当萘酰亚二胺与DNA相互靠近发生结合时, 其平面生色团与DNA的碱基之间的电子云相互交叠发生了π电子共轭, 使萘环生色团π-π*跃迁的能量降低, 从而引起的最大吸收峰强度逐渐减小和红移现象.当小分子以嵌入方式结合于 DNA 双螺旋碱基对之间时, 其吸收光谱表现为减色效应且出现红移现象.因此, 可初步判断萘酰亚二胺-多胺缀合物与DNA之间的相互作用以嵌入方式为主.
利用紫外吸收光谱所得数据, 还可以依据下面的公式[12]计算化合物1与DNA相互作用的表观结合常数,即:
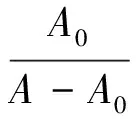
(1)
式中,A0和A分别表示加入DNA前后药物的吸光度,εG和εH-G分别表示药物及其与DNA形成的复合物的摩尔吸收系数.以A0/(A-A0)-1/cDNA作图,能够得到一条结合曲线.其斜率与截距的比值即为药物与DNA的表观结合常数. 将试验数据代入方程(1)并进行线性拟合,由直线的斜率与截距, 求得化合物1与 DNA相互作用的表观结合常数为1.275×104(图3).
3.2荧光光谱研究
3.2.1 荧光淬灭方式的判断 为了深入考察化合物1与DNA作用情况,采用化合物(浓度不变,主体)与鲱鱼精DNA(浓度变化,客体)直接作用和化合物(浓度变化,客体)与DNA-EB(溴化乙锭)复合物(浓度不变,主体)作用,化合物与DNA作用结果见图4-5.

图2 化合物1与鲱鱼精DNA作用紫外光谱图Fig.2 UV absorption spectra of the interaction between compound 1 and herring sperm DNA.Numbers 1-13 indicated the DNA concentration: 0.0, 4.56×10-6, 9.13×10-6, 13.69×10-6, 27.4×10-6, 41.08×10-6, 54.77×10-6, 68.46×10-6, 82.15×10-6, 95.84×10-6, 109.54×10-6, 123.23×10-6 and 136.92×10-6mol·L-1, respectively. Compound 1 applied was 80×10-6mol·L-1.
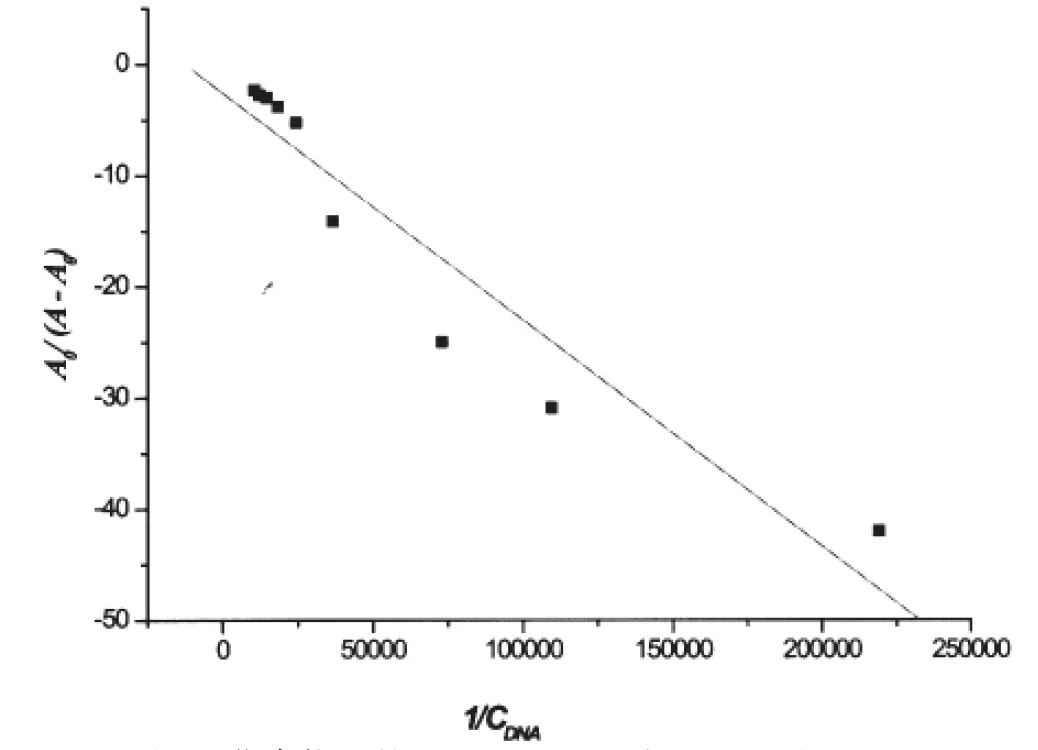
图3 化合物1的A0/(A-A0)对1/cDNA图Fig.3 Plot of A0/(A-A0)versus 1/cDNA of the interaction between compound 1 and herring sperm DNA(10-6mol·L-1).
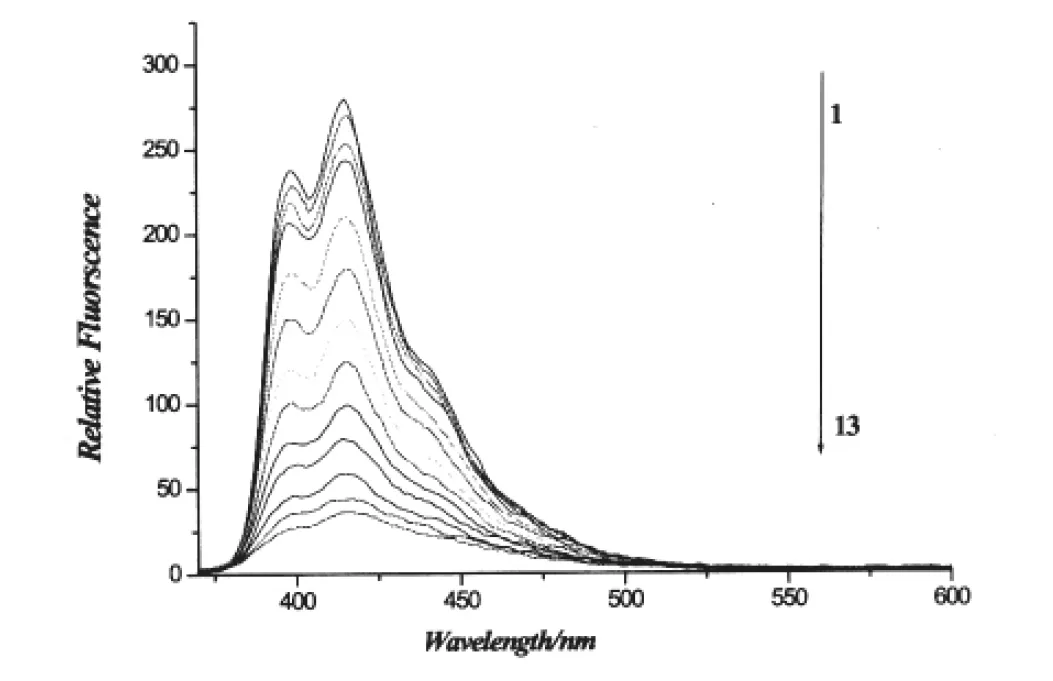
图4 化合物1与鲱鱼精DNA作用荧光光谱图Fig.4 Fluorescence spectroscopy of the interaction between compound 1 and herring sperm DNANumbers 1-13 indicated the DNA concentration: 0.0, 4.56×10-6, 9.13×10-6, 13.69×10-6, 27.4×10-6, 41.08×10-6, 54.77×10-6, 68.46×10-6, 82.15×10-6, 95.84×10-6, 109.54×10-6, 123.23×10-6 and 136.92×10-6mol·L-1, respectively. Compound 1 applied was 80×10-6mol·L-1. Scan condition of compound 1: EX =360nm, EM=370-710 nm; Slits of both EX and EM were 5 nm.

图5 化合物1与鲱鱼精DNA-EB作用荧光图Fig.5 Fluorescence spectroscopy of compound 1 with herring sperm DNA-EB.Numbers 1-13 indicated the 1 concentration: 0.0, 4×10-6, 8×10-6, 12×10-6, 24×10-6, 36×10-6, 48×10-6, 60×10-6, 72×10-6, 84×10-6, 96×10-6, 108×10-6 and 120×10-6 mol·L-1, respectively. DNA and EB applied were 13.7×10-6 and 15.7×10-6mol·L-1, respectively. Scan condition: EX=510nm, EM=520-800 nm; Slits of both EX and EM were 10 nm and 5 nm, respectively.
从图4中可以看出,化合物1最大发射波长在416nm处,此外在400nm处也有一个峰.当化合物1中加入DNA溶液后,引起荧光淬灭.从图5中也可以看出,当DNA-EB复合物溶液中加入化合物1后,引起荧光淬灭,这是因为DNA在260nm左右有微弱荧光,与溴化乙锭(EB)形成复合物后, 其混合溶液在600nm左右处出现明显的荧光, 当结合能力比EB更强的嵌入剂加入后, 会与体系中的EB争夺与DNA上的结合点位置, 使体系中EB被置换出来, 从而产生荧光淬灭现象.荧光淬灭作用因淬灭机制不同而分为动态淬灭和静态淬灭.判断化合物1与DNA作用引起荧光淬灭机制, 对药物与DNA结合模式至关重要.
化合物与DNA作用的动态淬灭过程反映了化合物与DNA的激发态分子之间碰撞所发生的相互作用过程. 这个过程是用Stern-Volmer方程来进行描述的, 即:
F0/F=1+KSVc
(2)
其中F0和F分别为客体和主体作用前后的荧光强度,Ksv为动态淬灭常数, 用来衡量主体的淬灭速率,c表示客体的浓度.以F0/F对c作图,可以得到药物的Stern-Volmer淬灭曲线[12-15],结果见图6-7.
根据分别在25,30,37°C时获得的主体与客体作用的荧光光谱数据,分别做出3个不同温度下的Stern-Volmer曲线,然后对实验数据进行线性拟合,即得KSV的值,结果见表1-2.
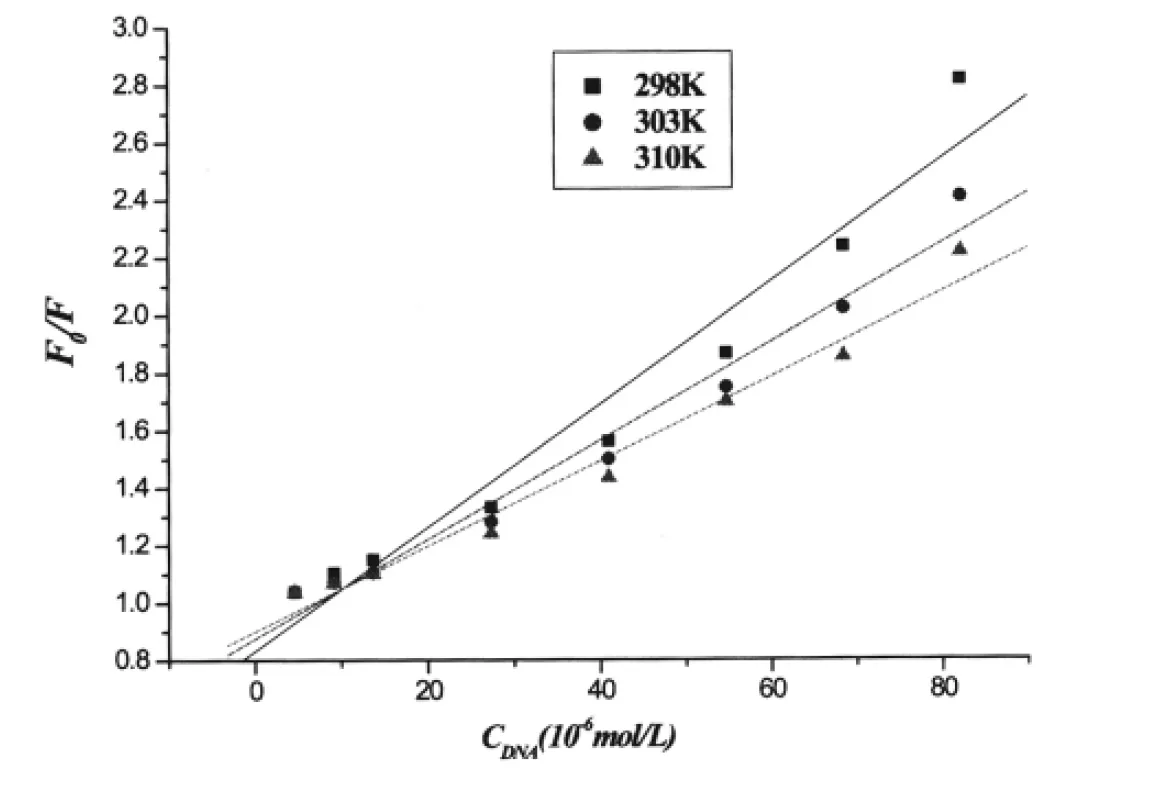
图6 化合物1与鲱鱼精DNA在不同温度下作用的Stern-Volmer淬灭曲线图Fig.6 Stern-Volmer plot of fluorescence quenching of compound 1 by herring sperm DNA at different temperatures

图7 化合物1与鲱鱼精DNA-EB在不同温度下作用的Stern-Volmer淬灭曲线图Fig.7 Stern-Volmer plot of fluorescence quenching of herring sperm DNA-EB by compound 1 at different temperatures
一般来讲, 动态淬灭作用的速率常数(Kq)值一般都小于 2.000 ×1010L·mol-1[16],但表1和2中的Kq值远大于2.000×1010L·mol-1,这可以初步判断样品对DNA-EB的淬灭方式为静态淬灭.据文献[17]报道温度升高将增加分子扩散系数,从而增加发生碰撞淬灭的可能性,如果是动态淬灭,则 KSV应随温度的升高而增大,同时温度升高将导致配合物的稳定性降低,从而减小形成配合物的可能性.表1和2中的KSV随温度的升高到而减小,则表明样品对DNA-EB的淬灭方式不是动态淬灭,而是静态淬灭[18].

表1 不同温度下 DNA 猝灭化合物(1)的动态猝灭常数Table 1 Dynamic quenching constant of compound 1by DNA at different temperature
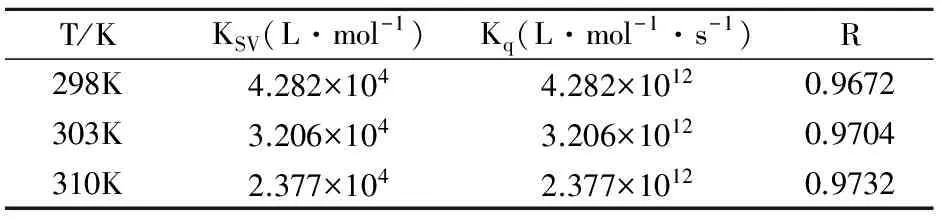
表2 不同温度下化合物(1)猝灭DNA-EB的动态猝灭常数Table 2 Dynamic quenching constant of DNA-EB complexby compound 1 at different temperature
3.2.2 化合物与DNA结合方式判定 由于是静态淬灭过程, 荧光强度与淬灭剂的关系符合以下方程[11-12]:
log[(F0-F)/F]=logK+nlog[Q]
(3)
其中F0和F分别是客体加入主体前后的荧光强度,K为化合物与DNA的结合常数,n为结合位点数,[Q]是客体的总的浓度所以根据此方程,以log[(F0-F)/F]对log[Q]作图,然后对实验数据进行线性拟合,由直线的截距和斜率可求得主体与客体分子的在不同温度下的结合常数K和结合位点数n,结果见表3-4和图8-9.
利用以下公式计算化合物与DNA作用的热力学函数[12-14,19-20],焓变ΔH°、熵变ΔS°和吉布斯自由能变ΔG°的数值,即:
ln(K2/K1)=(1/T1-1/T2)ΔH°/R
(5)
ΔG°=-RTlnK=ΔH°-TΔS°
(6)
其中,R为气体常数,T为温度,K为结合常数.当温度变化不大时,焓变ΔH°可以看作是一个常数,结果见表3-4.
表3-4中数据ΔH°<0,则表明样品与DNA的结合是放热的.由Ross等[12-14,21]总结出的判断生物大分子与小分子结合力类型的热力学规律可以用来判断结合力类型:疏水作用力其热力学特征为ΔH°>0和ΔS°>0;氢键或者范德华力其热力学特征为ΔH°<0和ΔS°<0;静电作用力其热力学特征为ΔH°<0.结合表3中数据均小于0,由此可判断样品与DNA的结合是焓熵协同驱动过程,而且它们之间的结合力类型以氢键为主.Takenaka等[22]研究发现,氢键作用是药物与DNA发生嵌入结合的显著特征,所以这更进一步证明样品与DNA的结合方式是嵌入.

图8 不同温度下化合物1与鲱鱼精DNA的log[(F0-F)/F]对log[Q]图Fig.8 Plot of log[(F0-F)/F] versus log[Q] of the interaction between compound 1and herring sperm DNA at different temperatures
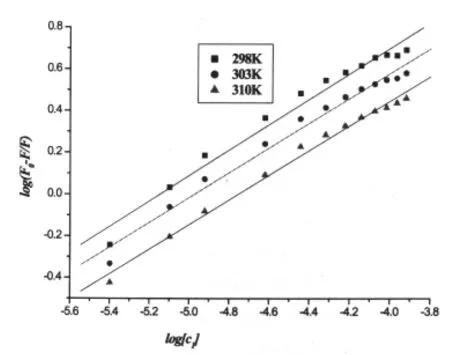
图9 不同温度下化合物1与鲱鱼精DNA-EB的log[(F0-F)/F]对log[Q]图 Fig.9 Plot of log[(F0-F)/F] versus log[Q] of the interaction between compound 1 and herring sperm DNA-EB at different temperatures
由此可推断,样品与DNA相互作用的过程是放热的焓熵协同驱动过程,当样品与DNA相互作用时,样品的平面萘环结构插入DNA的双螺旋结构的碱基对之间,且相互作用力类型为氢键.

表4 化合物1与鲱鱼精DNA在不同温度下作用的结合常数及热力学参数Table 4 Binding constants and thermodynamicparamenters of the interaction between compound 1and herring sperm DNA at different temperatures

表5 化合物1与鲱鱼精DNA-EB在不同温度下作用的结合常数及热力学参数Table 5 Binding constants and thermodynamic paramentersof the interaction between compound 1 andherring sperm DNA-EB complex at different temperatures
4 结论
4.1本文首次采用紫外光谱和荧光光谱研究萘酰亚二胺-多胺缀合物与DNA及DNA-EB复合物作用.
4.2紫外光谱研究结果表明:萘酰亚二胺-多胺缀合物与DNA之间的相互作用以嵌入方式为主.
4.3荧光光谱研究结果表明:萘酰亚二胺-多胺缀合物与DNA及其DNA-EB之间作用模式属于嵌入结合,也就是说样品的平面萘环结构插入DNA的双螺旋结构的碱基对之间.此过程是放热的焓熵协同驱动过程.萘酰亚胺-多胺缀合物与DNA及其DNA-EB之间作用引起的荧光淬灭机制属于静态淬灭.
[1] KARIGIANNIS G, PAPAIOANNOU D. Structure, biological activity and synthesis of polyamine analogues and conjugates[J]. Eur J Org Chem, 2000,2000(10):1841-1863.
[2] RODRIGUEZ L, ALVES S, LIMA J C, et al. Supramolecular interactions of hexacyanocobaltate (III)with polyamine receptors containing a terminal anthracene sensor[J]. J Photochem And Photobiol, 2003,159(3):253-258.
[3] CULLIS P M, GREEN R E. Merson-Davies L, et al. Probing the mechanism of transport and compart-mentalisation of polyamines in mammalian cells[J]. Chem Biol, 1999,6(10):717-729.
[4] WANG Y-X, ZHANG X-B, ZHAO J, et al. Nonhematotoxic naphthalene diimide modified by polyamine: synthesis and biological evaluation[J]. J Med Chem, 2012,55(7):3502-3512.
[5] TIAN Z-Y, XIE S-Q, DU Y-W, et al. Synthesis, cytotoxicity and apoptosis of naphthalimide polyamine conjugates as antitumor agents[J]. Eur J Med Chem, 2009,44(1):393-399.
[6] TIAN Z Y, XIE S Q, MEI Z H, et al. Conjugation of substituted naphthalimides to polyamines as cytotoxic agents targeting the Akt/mTOR signal pathway[J]. Org Biomol Chem, 2009,7(19):4551-4560.
[7] 田智勇,苏雷朋,谢松强,等.萘酰亚胺-多胺缀合物合成、生物活性和荧光光谱研究[J].有机化学,2013,33(7):1512-1521.
[8] 梅子厚,田智勇,马红霞,等.萘酰亚胺-多胺缀合物的合成及体外抗癌活性[J].药学学报,2009,44(7):754-757.
[9] McMasters S, KELLY LA. Ground-state interactions of spermine-substituted naphthalimides with mono-nucleotides[J]. J Phys Chem B, 2006(3),110:1046-1055.
[10] LONG E C, BARTON, J K. On demonstrating DNA intercalation [J]. Acc Chem Res, 1990,23(9):271-273.
[11] TYSOE S A, MORGAN R J, BAKER A D, et al. Spectroscopic investigation of differential binding modes of Δ- and Λ-Ru(bpy)2(ppz)2+with calf thymus DNA[J]. J Phys Chem, 1993,97(5):1707-1711.
[12] 吕娟,王公轲,张贵生,等.光谱法研究柔红霉素衍生物DNR-D3与DNA相互作用[J].光谱学与光谱分析,2010,30(5):1324-1328.
[13] SUN Y, WEI S, YIN C, et al. Synthesis and spectroscopic characterization of 4-butoxyethoxy-N-octadecyl-1,8-naphthalimide as a new fluorescent probe for the determination of proteins[J]. Bioorg & Med Chem Lett, 2011,21(12):3798-3804.
[14] 于岚岚,杨冉,白希希,等.喜树碱与DNA相互作用的光谱学研究[J].发光学报,2011,32(11),1997-1203.
[15] 高峰,周建庆,王伦,等.酚藏花红与DNA作用的光谱研究[J].安徽师范大学学报:自然科学版,2006,29(2):143-147.
[16] LAKOWICZ J R. Principles of fluorescence spectroscopy. Sspringer: New York, USA, 2006. p. 97-155.
[17] ASHOKA S, SEETHARAMAPPA J, KANDAGAL P B, et al. Investigation of the interaction between trazodone hydrochloride and bovine serum albumin[J]. J Lumin, 2006,121(11):179-186.
[18] HU Y J, LIU Y, ZHANG L X, et al. Study of interaction between colchicines and bovine serum albumin by fluorescence quenching method[J]. J Mol Struct, 2005,750(1-3):174-178.
[19] KLOTZ I M, URQUHART J M. The binding of organic ions by proteins. Effect of temperature[J]. J Am Chem Soc, 1949,71(3),847-851.
[20] Bi S-Y, QIAO C-Y, SONG D-Y, et al. Study of interactions of flavonoids with DNA using acridine orange as a fluorescence probe[J]. Sens Actuators B, 2006,119(1):199-208.
[21] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981,20 (11):3096-3102.
[22] TAKENAKA S, IHARA T, TAKAGI M. Bis-9-acridinyl derivative containing a viologen linker chain: electrochemically active intercalator for reversible labelling of DNA[J]. J Chem Soc Chem Commun, 1990,23(21):1485-1487.
SpectroscopicStudyontheInteractionBetweenNaphthaliimide-PolyamineConjugatesandDNA
TIAN Zhi-yong1, WANG Yu-xia1, ZHAO Zhong-hua1, ZHAO Jin1,2, WANG Chao-jie1,2
(1. Institute of Chemical Biology, Henan University, Kaifeng 475004, China; 2. The Key Laboratory of Natural Medicine and Immuno-Engineering, Henan University, Kaifeng 475004, China)
The interaction of naphthaliimide-polyamine conjugate with herring sperm DNA was studied by UV spectrum and fluorescence spectrum under physiological conditions ( pH=7.4). The hypochromicities and red shifts were observed from the absorption titration experiments. These results indicated that compound 1 intercalated into the DNA. Through the fluorescence quenching data measured at different temperatures (25, 30 and 37°C)revealed that the quenching mechanism was a static type. Meanwhile, the obtained binding constant and thermodynamic parameters on compound-DNA interaction showed that the type of interaction force of compound 1 and DNA was mainly hydrogen bond.
naphthaliimide; polyamine conjugate; DNA; spectroscopic methods
2014-04-10
河南省科技厅项目(132102310026、112300410181);河南省教育厅项目(14A350004).
田智勇(1968-),男,副教授,博士,药物化学.
田智勇,王玉霞,赵中华,赵瑾,等.萘酰亚二胺-多胺缀合物与DNA作用的光谱研究[J].安徽师范大学学报:自然科学版,2014,37(4):357-362.
O657.3
A
1001-2443(2014)04-0357-05
——勇敢者的游戏

