不同碳氮源对一株产油小球藻油脂积累的影响
金 虹, P.K.Andy Hong, Diana Bao, 吕海棠, 李文林, 马明英
(1.青海大学 化工学院,青海 西宁 810016;2. 犹他大学 土木与环境工程系,美国 盐湖 84112)
不同碳氮源对一株产油小球藻油脂积累的影响
金 虹1, P.K.Andy Hong2, Diana Bao2, 吕海棠1, 李文林1, 马明英1
(1.青海大学 化工学院,青海 西宁 810016;2. 犹他大学 土木与环境工程系,美国 盐湖 84112)
以蛋白核小球藻(Chlorellapyrenoidosa)为研究对象,考察了不同碳源及氮源对小球藻生物量和油脂产率的影响,确定了最佳碳源和氮源的添加量.结果表明,蛋白核小球藻最优碳源是葡萄糖,最优氮源是尿素;当葡萄糖浓度为30mg/L、尿素浓度为1.5mg/L时,小球藻生物量和油脂产率达到8783.9mg/L和126.3mg/L/d,比优化前分别提高了37.9%和125%.这为今后培养小球藻,提高其生物量和油脂产率奠定了一定的理论基础.
蛋白核小球藻;碳源;氮源;生物量;油脂产率
随着全球经济的发展,开发可持续生产的化石燃料替代燃料成为未来燃料发展的主导方向,而生物燃料是化石燃料替代燃料的首选之一.在目前人类开发的生物燃料中,生物柴油占有重要地位,但生物柴油商业化的主要障碍是原料供应的不足.所以,为促进生物柴油工业化的可持续发展,需要加快开发新的、非食用性、产量更高、生产周期更短、生产成本更低、土地使用更少的原料[1].而藻类的高生产率、高油脂含量及不会占用人类食物和生产用地等特点都显示出藻类生物质有被用于生物燃料生产的巨大潜力[2-5].但微藻培养的成功与否,需要考虑各种影响微藻生物质产率的因素.如营养物质、温度、pH、光照强度等等.据研究[6-7],微藻在异养或外源性碳源提供化学能条件下生存时,细胞通常储存油滴,同时,氮也是微藻生物质生产的重要营养物质,而碳氮源的数量、可利用性和类型都会在不同程度影响微藻的生物质量和油脂积累[8-9].本研究从不同碳氮源类型、浓度及碳氮源优化环境观察对小球藻生物质量和油脂产率的影响.
1 材料与方法
1.1藻种及培养基
蛋白核小球藻(Chlorellapyrenoidosa),中国科学院青岛生物能源研究所赠送,经BG11培养基培养后,其生物量和油脂产率分别可达6372mg/L、71.4mg/L/d、油脂含量达到16.8%.
培养基:BG11培养基及添加不同碳源、氮源的BG11培养基.
1.2培养方法
取对数生长期的种子培养液以10%(V/V)接种量接种于各相应培养基,试验在装有300mL培养基的500mL三角瓶中进行,每个样品做3个平行.置于光照培养箱中培养,光照周期为16:8h,培养温度与光照强度分别为:28℃、3500lx,每天摇瓶3-5次,随机变换三角瓶的位置.同时,定期取样镜检,确定小球藻正常生长及有无杂菌污染.
1.3分析方法
1.3.1 生物量的测定 用移液器移取3mL待测藻液于1cm比色皿中,以无菌培养基为空白对照,每天定时用紫外可见分光光度仪测定藻液在750nm处的吸光值[10],每个样品测定3次,结果取平均值,绘制生长曲线.指数生长末期收获,于5000r/min离心10min,弃上清液,灭菌蒸馏水清洗藻泥,重复3次.经真空冷冻干燥,用精密分析天平称量藻粉重量,并计算单位体积生物量.
1.3.2 总脂含量的测定 将冷冻干燥藻粉与石英砂按重量1:3比例混合,置于研钵中充分研磨后,加入氯仿甲醇混合剂(氯仿∶甲醇∶水的体积比为1:2:0.8)振荡5min,静置15min后6000 r/min离心2min,收集上层提取液.下层沉淀再重复上述操作2次,合并3次提取液,加入氯仿,使氯仿、甲醇、水的最终体积比为1:1:0.9,振荡30s后静置分层,收集氯仿层,旋转蒸发至恒重,称取油脂重量[9],并计算油脂含量和油脂产率.
油脂含量=所得油脂重量/藻粉重量×100%
油脂产率=藻粉重量×油脂含量/T(T为培养天数).
所得数据经SPSS16.0软件和Excell2007处理后作图.
2 结果与分析
2.1不同碳源对蛋白核小球藻生长速率及油脂产率的影响
将蛋白核小球藻接种在浓度分别达到15g/L的可溶性淀粉、葡萄糖、蔗糖、醋酸钠的BG11液体培养基中.其生长情况如图1所示,小球藻在几种环境中均可以生长,而且各平行环境之间的生长无显著差异(P>0.05).但在添加葡萄糖的环境中迟缓期更短,对数期更长,其吸光度值增加更快,在对数生长末期其吸光值增长至2.63,明显高于其他几个环境.经过测定生物量和油脂产率,在添加葡萄糖的环境中其生物量和油脂产率均为最高,分别为8274.6mg/L和119.7mg/L/d,醋酸钠环境中最低,分别为6432.6mg/L和74.4 mg/L/d,且差异性显著.但该小球藻在四种添加碳源的环境中油脂产率均有不同程度的提高.可见,添加一定种类和浓度的碳源有利于小球藻油脂的积累.这与贺国强[11]等的研究结果一致.见图2所示.本实验选择葡萄糖作为该小球藻的最佳碳源.

图1 蛋白核小球藻在不同碳源环境中的生长曲线Figure 1 Growth curves of Chlorella pyrenoidosa and lipid productivity of with different carbon sources
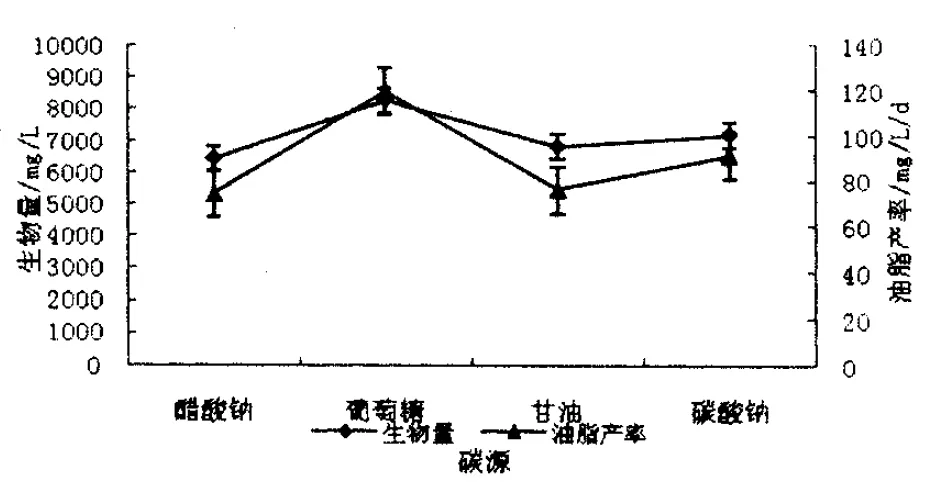
图2 蛋白核小球藻在不同碳源环境中的生物量和油脂产率Figure 2 The biomass Chlorella pyrenoidosa under different carbon sources
2.2不同氮源对蛋白核小球藻生长速率及油脂产率的影响

图3 蛋白核小球藻在不同氮源环境中的生长曲线Figure 3 Growth curves of Chlorella pyrenoidosas with different nitrogen sources
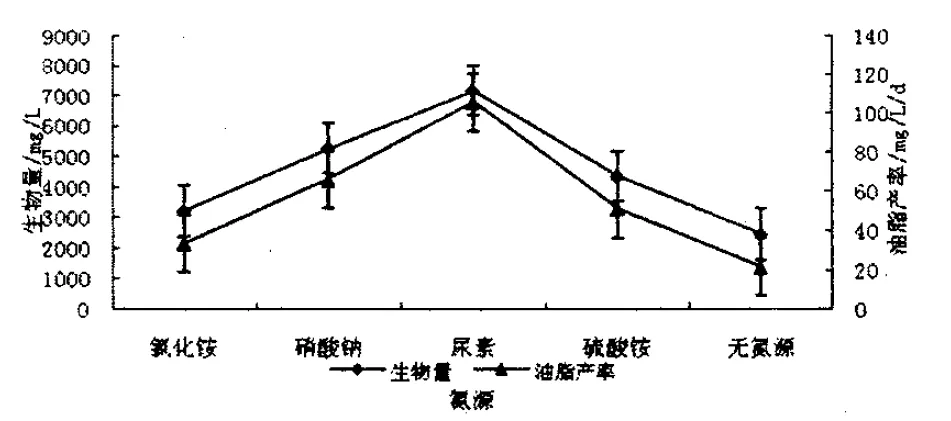
图4 蛋白核小球藻在不同氮源环境中的生物量和油脂产率Figure 4 The biomas and lipid productivity of Chlorella pyrenoidosa under different nitrogen sources
将蛋白核小球藻分别接种在使氮元素浓度为0.25g/L即氯化铵、硝酸钠、硫酸铵、尿素浓度分别达到0.95g/L、0.25g/L、1.35g/L、0.5g/L的BG11培养基中,并与未加任何氮源的条件比较,其生长情况如图3所示,蛋白核小球藻在四种条件中的生长情况均好于未加氮源的环境,且各平行实验间无显著差异(P>0.05),但小球藻在尿素环境中生长最好,在培养末期吸光度值最高达到2.18,而氯化铵环境才达到1.02,而且尿素环境中颜色更绿,细胞密度更大,细胞活力更强.说明氮源是微藻生长所必需的,但微藻对不同氮源的吸收及利用程度不同[12].同时从生物量和油脂产率来看,在添加尿素的环境中,其生物量和油脂产率分别达到7168.4mg/L和105.6mg/L/d,明显高于添加氯化铵的3216.7mg/L、33.6 mg/L/d,同时也高于添加硝酸钠和硫酸铵及未添加氮源的培养环境,且差异性显著.如图4所示.所以,选择尿素为该小球藻的最佳氮源.
2.3不同碳氮组合对蛋白核小球藻生长速率及油脂产率的影响

图5 蛋白核小球藻在不同碳氮组合下的生物量和油脂产率Figure 5 The biomass and lipid productivity of Chlorella pyrenoidosa with different combination of carbon and nitrogen sources
根据以上实验结论,以BG11培养基为基础,对葡萄糖和尿素进行3个水平组合的兼养培养.结果如图5所示.随着葡萄糖和尿素浓度的增加该小球藻生物量也逐渐增加,当葡萄糖、尿素浓度分别达到30mg/L和1.5mg/L时,生物量达到最大的8783.9mg/L,油脂产率也达到最大为126.3mg/L/d,生物量和油脂产率分别比其自养环境提高37.9%和125%.各平行实验间无显著差异(P>0.05).这与微藻在兼养条件下较自养时可积累更多的油脂的研究结果一致[13].但葡萄糖和尿素浓度比例继续增加,生物量和油脂产率均有下降,且差异性显著.所以,添加一定的葡萄糖有利于小球藻生物量和油脂的积累,但过高或过低的碳氮源浓度都不利于小球藻的生长和油脂积累.
3 结论
本实验探讨了碳源和氮源对一株蛋白核小球藻生物量和油脂产率的影响.实验结果表明,该小球藻不仅对不同的碳源、氮源吸收和利用程度不同,而且碳氮源浓度的不同也影响其生物量和油脂产率.其最佳碳源是葡萄糖,最佳氮源是尿素,当葡萄糖和尿素的浓度分别为30mg/L和1.5mg/L时,其生物量和油脂产率均达到最高的8783.9mg/L和126.3mg/L/d,分别比未添加外援性碳源、氮源的BG11基础培养条件提高37.9%和125%.所以,选择和添加一定种类和浓度的外源性碳源和氮源,有利于小球藻生物量的提高和油脂的积累.
[1] MATA T M,MARTINS A A, CAETANO S N. Microalgae for biodiesel production and other ppplications:a review[J]. Renew Sust Energy Rev,2010,(14):217-232.
[2] BOROWITZKA,M A. Commercial production of microalgae: ponds,tanks, tubes and fermenters[J]. Journal of Biotechnology,1999,(70):313-321.
[3] CRONAR N J, FALLOWFIELD H J. Effect of nutrient loading and retention tune on performance of high rate algal ponds[J]. Journal of Applied Phycology,1997,(9):301-309.
[4] BOROWITZKA M A. Algal biotechnology products and processes matching science and economies[J]. Journal of Applied Phycology,1992,(4):267-279.
[5] GINZBURG B. Liquid fuel(oil)from halophilic algae: a renewable source of nonpolluting energy[J]. Renewable Energy,1993,(3):249-252.
[6] RATLEDGE C. Fatty acid biosynthesis in microorganisms being used for single cell oil production[J]. Biochimie,2004,86:807-815.
[7] SCHENK P, THOMAS-Hall, SR, STEPHENS E. Second generation biofoels:high efficiency microalgae for biodiesel production[J]. Bioenerg Res,2008,(0 l),20-43.
[8] HSIEH CH, WU WT. Cultivation of microalgae for oil production with a cultivation strategy of urea limitation[J]. Bioresour Technol,2009,100(17):3921-3926.
[9] CONVERTI A, CASAZZA A A, ORTIZ E Y, et al. Effect of temperature and nitrogen concentration on the growth and lipid content of nannochloropsis oculata and chlorella vulgaris for biodiesel production[J]. Chem Engiproc,2009,48(6):1146-1151.
[10] 王俊彩.富油微藻的筛选及其培养条件的优化研究[D].青岛:中国海洋大学,2012:18-19.
[11] HE Guoqiang, DENG Zhiping, TAO Li, et al. Screen and fermentation optimization of microalgaes with high lipid productivity[J]. Journal of Agricultural Biotechnology,2010, 18 (6):1046-1053.
[12] ZHANG C, ZHOU J Z. Absorption kinetics ofPseudonitzschiapungens, and its proliferation characteristics under nitrogen and phosphorus limits condition[J]. Marine and Limnology,1997,28(6):599-603.
[13] GUI L, SHI X M, LI L, et al. Comparision of diffent culture methods forChlorellapyrenoidosa, Journal of Henan University of Technology[J]. Natural Science Edition, 2005,26(5):52-55.
EffectofDifferentCarbonandNitrogenSourcesonLipidAccumulationofChlorellaPyrenoidosawithLipidProduction
JIN Hong1, P.K.Andy Hong2, Diana Bao2, LV Haitang1, LI Wen-ling1, MA Ming-ying1
(1.Chemical Engineering College, Qinghai University,Xining 810016,China; 2.Department of Civil and Environmental Engineexing, University of Utah, Salt Lake 84112, USA)
This paper, taking Chlorella pyrenoidosa as research object,discussed the effects of different carbon and nitrogen sources on the biomass and oil production rate ofChlorellapyrenoidosaand determined the add content of optimal carbon sources and nitrogen sources. The results showed that, the optimal carbon source and nitrogen source ofChlorellapyrenoidosawere glucose and urea. The biomass and oil productivity ofChlorellapyrenoidosaattained maximums of 8783.9mg/L and 126.3mg/L/d respectively,when glucose and urea concentration were 30g/L and 1.5g/L respectively. The biomass and oil productivity ofChlorellapyrenoidosawere increased 37.9% and 125% respectively than those before optimization. This study may provide a theoretical basis for culturing chlorella and improving the biomass and oil productivity ofChlorellapyrenoidosa.
Chlorellapyrenoidosa; carbon sources; nitrogen sources; biomass; oil productivity
2014-03-26
青海省科技厅国际科技合作项目(2011-GH-1215).
金虹(1966-)女,辽宁人,教授,从事微生物学及生物化学方面的教学与研究工作.
金虹,P.K.Andy Hong,Diana Bao,等.不同碳氮源对一株产油小球藻油脂积累的影响[J].安徽师范大学学报:自然科学版,2014,37(4):363-365.
Q93-3
A
1001-2443(2014)04-0363-03

