Livin和PTEN基因在喉鳞状细胞癌中的表达及其相关性的研究
黄方名 王文忠 李东海
现在恶性肿瘤对人类的威胁日益突出,目前肿瘤已成为目前死亡常见原因之一。在中国,头颈癌的发病率在10%左右,其中喉癌占头颈癌的13.9%,占全身恶性肿瘤的5.7%~7.6%,近年来喉癌的发病率有明显增高的趋势。其病理类型以鳞状细胞癌为主,占93%~98%,男性较女性多见,约为7~10∶1,年龄以40~60岁最多。由于其原发灶部位特殊、隐蔽,临床上又与患者呼吸、吞咽、发音等重要生理活动密切相关,因此给肿瘤早期发现、治疗和患者预后带来了挑战[1]。
1 材料与方法
1.1 临床资料
62例喉癌患者均为蚌埠医学院附属医院及我院2008年6月-2012年12月收治的且病历资料完整的喉鳞状细胞癌患者,并且在术前未行相关的放、化疗。男性58例,女性4例,年龄52~70岁,平均58.2岁,>55岁组42例,≤55岁组20例。标本分为喉癌组(喉原发鳞状细胞癌)62例和癌旁组18例(癌旁1.0~2.0 cm,术后病理检查证实为正常喉组织)。临床TNM分期按国际抗癌协会(UICC)2002年标准:Ⅰ期7例,Ⅱ期19例,Ⅲ期29例,Ⅳ期7例。肿瘤原发于声门上型26例,声门型32例,声门下型4例。病理组织学分化程度:Ⅰ级19例,Ⅱ级37例,Ⅲ级6例。淋巴结转移分期:N0期39例、N1期20例、N2期3例;所有患者未见远处转移。
1.2 标本采集
标本均取自蚌埠医学院附属医院病理科收集的喉鳞状细胞癌及癌旁正常喉组织(术后病理检查证实)石蜡包埋标本。所有标本离体后均用10%甲醛溶液固定,石蜡包埋。每例标本连续切4 μm厚,供HE染色及免疫组化使用。
1.3 试剂与方法
兔抗人Livin多克隆抗体(北京中杉生物工程有限公司);鼠抗人PTEN单克隆抗体(clone 6H2.1 美国Dako North公司);S-P-plus-kit (链霉素抗生物素蛋白过氧化物酶免疫组化试剂盒)。采用免疫组化法。
1.4 统计学方法
实验数据均应用SPSS17.0 for Windows软件包处理,根据资料性质采用χ2检验、两个独立样本的比较采用Wilcoxon秩和检验、相关分析Spearman秩和相关分析,P<0.05为有统计学意义。
2 结果
2.1 Livin蛋白在LSCC和癌旁喉组织中的表达
62例LSCC中livin阳性表达35例,阳性表达率为72.58%。癌旁喉组织中livin染色主要定位于骨骼肌细胞及血管平滑肌细胞细胞核。18例癌旁喉组织中无livin阳性表达者,两组比较,差异具有显著性(P<0.05) (表1)。

表1 Livin基因在LSCC和癌旁喉组织中的表达情况/例
2.2 Livin表达与LSCC临床病理特征的关系
Livin阳性表达率随LSCC病理分级、 临床分期的升高而升高。Ⅰ级、Ⅱ级和Ⅲ级LSCC中其阳性表达率分别为47.40%、81.10%、100.00%。TNM分期(UICC,2002)Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期中其阳性表达率分别为42.90%、63.20%、79.30%、100.00%。淋巴结转移分级N0、N1、N2LSCC中其表达阳性率分别为59.00%、95.00%、100.00%,差异有统计学意义(P<0.05);声门型、声门上型、声门下型LSCC中其阳性表达率分别为75.00%、69.20%、75.00%,三者间差异无统计学意义(P>0.05);男性LSCC中其阳性表达率为74.1%,女性为50.00%,两者比较差异无显著性(χ2=1.114,P>0.05);年龄≤55岁者其阳性表达率为65.00%,>55岁者其阳性表达率为76.20%,两者比较差异无显著性(χ2=1.102,P>0.05)(表2)。
2.3 PTEN在LSCC和癌旁喉组织中的表达
62例LSCC中PTEN阳性表达37例,阳性表达率为59.70%,18例癌旁喉组织中PTEN阳性表达17例,阳性表达率为94.40%,两者比较,差异具有显著性(P<0.05)(表3)。
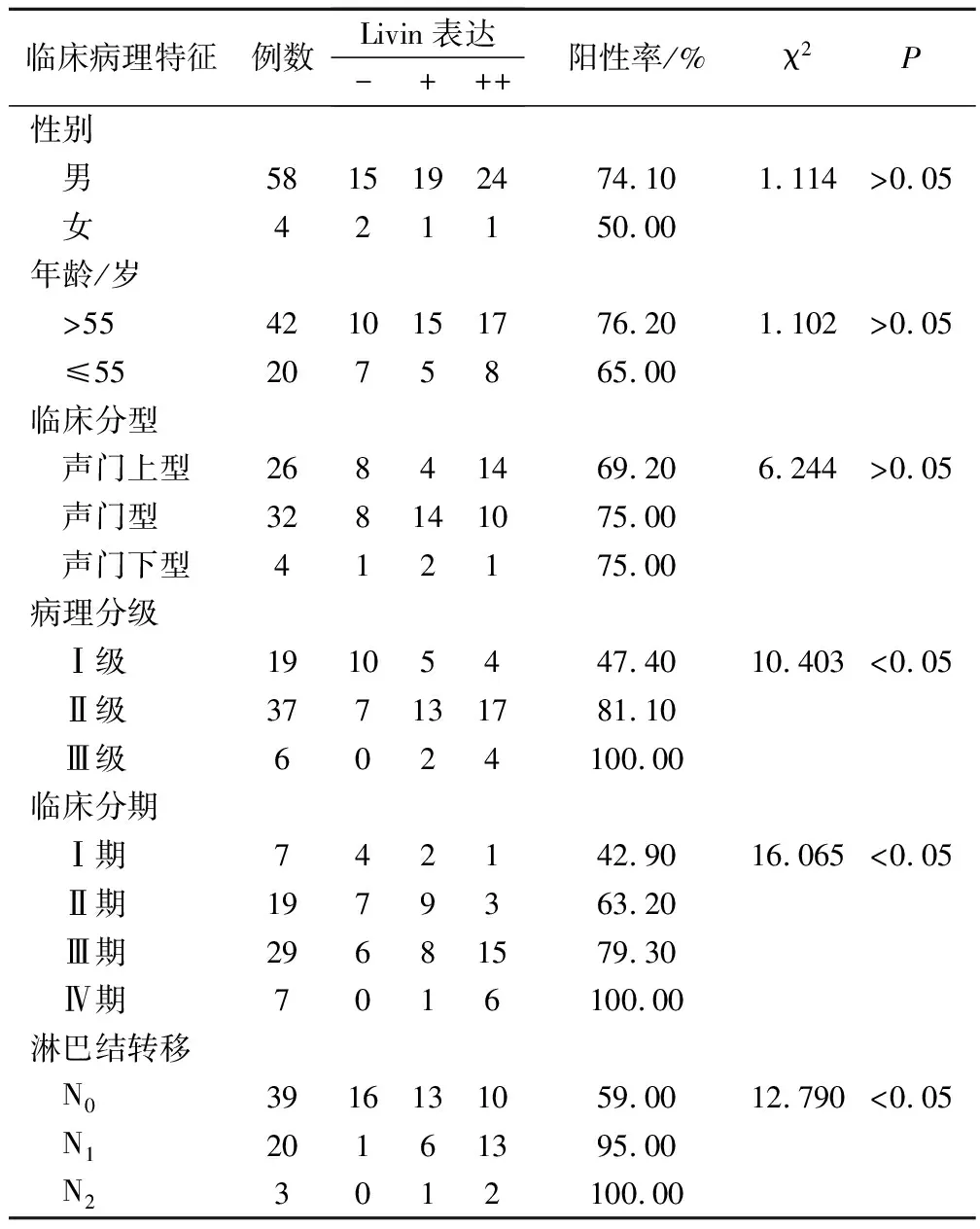
表2 Livin表达与LSCC临床病理特征的关系/例

表3 PTEN在LSCC和癌旁喉组织中的表达/例
2.4 PTEN表达与LSCC临床病理特征的关系
Ⅰ级、Ⅱ级和Ⅲ级LSCC中其阳性表达率分别为78.90%、54.10%、33.30%,有统计学意义(P<0.05);TNM分期Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期LSCC中其阳性表达率分别为85.70%、84.20%、44.80%、29.60%,有统计学意义(P<0.05);淋巴结转移N0、N1、N2LSCC中其表达阳性率分别为71.80%、40.00%、33.30%,差异有统计学意义(P<0.05);声门型、声门上型、声门下型LSCC中其阳性表达率分别为56.20%、61.50%、75.00%,三者间比较差异无统计学意义(P>0.05);男性LSCC患者中其阳性表达率为61.30%,女性为50.00%,两者间差异无显著性(χ2=0.178,P>0.05);年龄>55岁者其阳性表达率为59.50%,≤55岁者其阳性表达率为60.00%,两者间差异无显著性(χ2=0.133,P>0.05)(表4)。
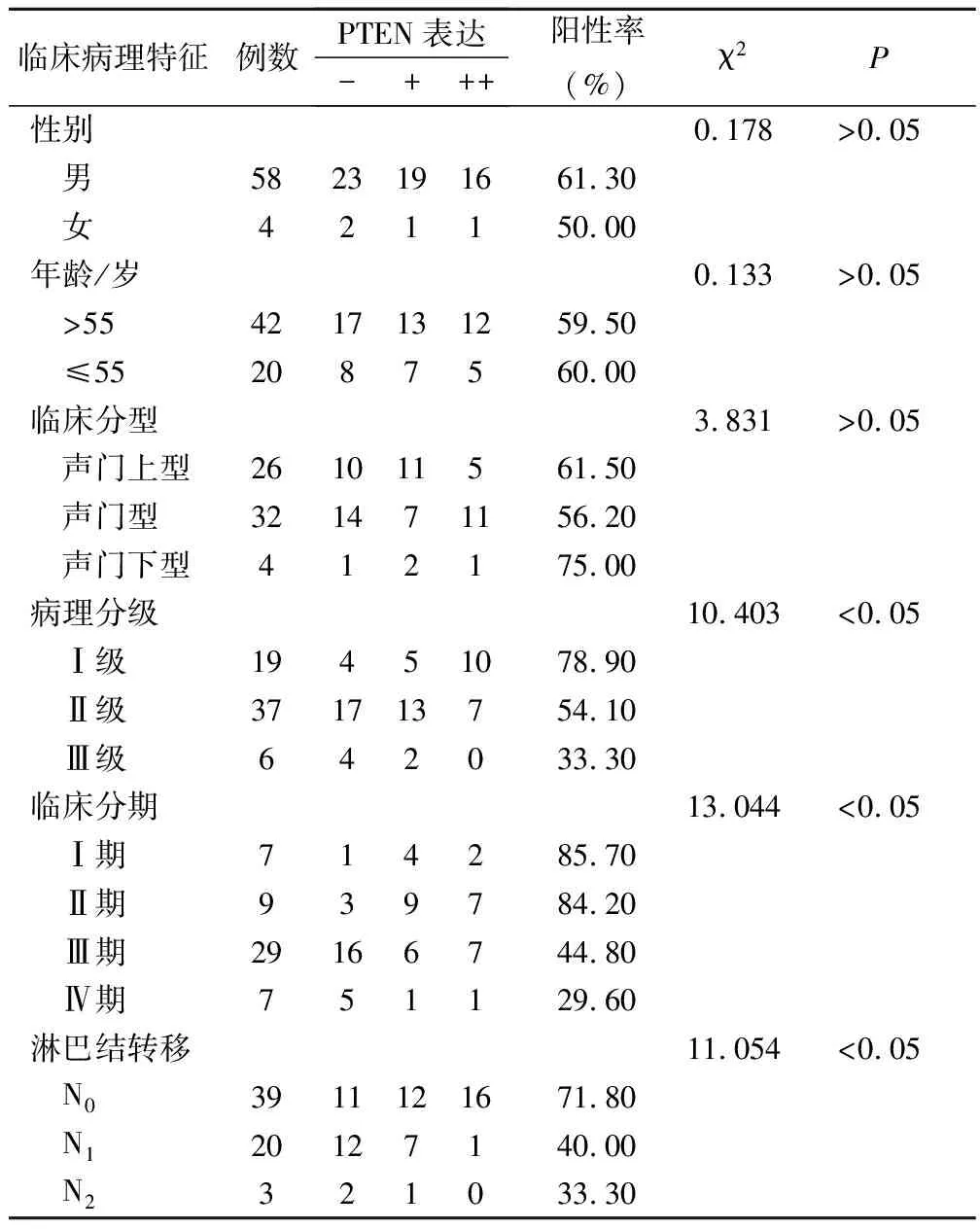
表4 PTEN表达与LSCC临床病理特征的关系/例
2.5 Livin与PTEN表达的相关性
62例LSCC组织中livin基因表达阳性45例,PTEN基因表达阳性37例;livin基因表达阳性而PTEN基因表达阴性22例;livin基因表达阴性而PTEN基因表达阳性14例;livin和PTEN基因表达均为阳性23例;livin和PTEN基因表达均为阴性3例,两者表达呈负相关性(γs=-0.382,P<0.01)(表5)。
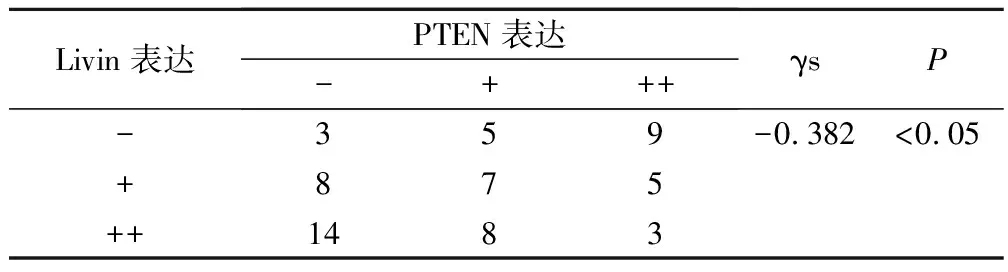
表5 Livin与PTEN表达的相关性/例
3 讨论
喉癌是喉部最常见的恶性肿瘤,其发病率目前有明显增长趋势。喉癌的发病率地区差别也很大,东北地区发病率最高,占全身恶性肿瘤5.7%~7.6%,占耳鼻喉恶性肿瘤的7.9%~35%。在我国部分省市的发病率约为1.5~3.4/10万人,近年来喉癌的发病率有明显增加的趋势。其病理类型以鳞状细胞癌为主,占96%~98%,男性较女性多见,约为7~10∶1,以40~60岁最多。
Livin是最新发现的凋亡抑制蛋白家族(inhibitor of apoptosis proteins,IAPs)中的新成员之一,是从人类基因组cDNA文库中克隆得到的1种蛋白质,特异性表达于人的胚胎组织及大多数人实体瘤细胞和组织,研究表明其Livin抗凋亡功能远远强于Bcl-2家族。人类IAP家族的存在,使肿瘤细胞对缺血缺氧、放化疗等作用产生耐受,从而使肿瘤细胞得以持续生长,而且livin是1种新近发现的细胞凋亡抑制因子,以其为靶点的抑制物及反义Livin能够不仅保护细胞不凋亡,而且具有广谱和低毒的副作用,为肿瘤的基因诊断和治疗提供了新的研究途径。Livin 基因位于人第20号染色体q13.3上,全长46kb,包括7个外显子和6个内含子。与IAP 家族其它成员相似,Livin 也包含1个串联的含有半胱氨酸/组氨酸的杆状病毒IAP 重复区(baculoviral IAP re-peat,BIR)和相邻的羧基末端含有一个环指结构。Livin的抗凋亡活性就主要依赖于其BIR和RNG的结构域。Livin在正常成人的大多数终末分化组织中低表达或不表达,相关研究表明Livin基因大多数恶性肿瘤中能呈高表达如黑色素瘤、宫颈癌、乳腺癌、食管癌、胃癌、膀胱癌、前列腺癌、白血病淋巴瘤以及非小细胞肺癌等。Livin 与Caspases 作用的途径: Livin通过抑制Caspase 的活性,而导致多种途径的细胞凋亡,另外有相关报道Livin 抑制caspases 活性的作用的发挥主要是由BIR 结构域来完成的,它是与caspases 蛋白结合的部位,阻止caspase蛋白在细胞凋亡时执行蛋白切除功能。Livin 与TAK1/JNK1 途径: Livin 基因可激活MAP ( mitogen - activated protein) 激酶JNK1和JNK2,对JNK3 无激活作用。对JNK1的激活作用远远大于JNK2,并且是Livin 对抗TN F-α和ICE介导的细胞凋亡作用的一条重要途径。其它途径: 也有相当一部分IAPs 通过与BIR 结构域和TNF受体结合,沿TNFR1- Tradd- Fadd 途径激活procaspase- 8,从而激活caspase- 3,达到诱导细胞凋亡。随着研究的深入发现:IAPs 还可以通过诱导NF- kB 能激活Akt (丝氨酸/苏氨酸蛋白激酶) 途径、 钙离子结合蛋白等方式发挥其抗凋亡作用。
凋亡抑制是肿瘤细胞的一个普遍特性,IAP家族作为细胞凋亡的调节剂,正日益成为人们关注的癌症治疗的靶点。为恶性肿瘤的基因诊断提供了一定的理论依据。Liu等[2]也证实Livin-α在膀胱癌复发患者中的表达明显高于原发患者,同时2年随访结果显示Livin阴性患者比阳性患者复发率降低31%,因此Livin还可以作为监测膀胱癌早期复发及预后的一个重要标志。Liu等[3]发现反义Livin低核苷酸可诱导细胞凋亡,通过半胱氨酸天冬氨酸的蛋白激酶-3来实现的,说明Livin在膀胱癌抑制其凋亡发生。Hariu等[4]检测Livin可在许多肺癌细胞株和原发性肺癌组织中呈异常表达,而在正常的肺组织中却未见表达。Tanabe等[5]用RT-PCR方法检测了38例非小细胞肺癌(NSCLC)组织及15例非癌肺组织,前者的Livin阳性表达率为76.3%,显著高于后者,其中早期肺癌的阳性表达率为74.2%。Wang[6]的研究表明 检测凋亡蛋白抑制剂,在非小细胞肺癌围手术期患者血清进行了分析趋势来探讨非小细胞肺癌的诊断、分期及预后判断的临床意义,结果表明Livin的量和凋亡抑制剂的量呈反向关系。
PTEN(phosphatase and tensin homology deletedon chromosome 10)是目前人类发现的第一个具有磷酸化酶功能的抑癌基因,作为磷酸肌醇-3激酶(PI3-K)/丝-苏氨酸激酶(AKT)通路的负调控因子,PTEN-PI3K-Akt通路在细胞整合外界刺激的反应中处于核心地位,PTEN功能的缺失与肿瘤的发生密切相关。PTEN基因所编码蛋白的主要功能是参与细胞增殖和凋亡中所发生的去磷酸化作用,这也是PTEN基因抑癌作用的基础。PTEN基因正常表达可以抑制细胞的恶变,抑制肿瘤细胞侵袭、转移和生长,该基因异常将导致蛋白表达下降从而失去抑癌作用。
PTEN定位于染色体10q23,基因全长为200 kb,共403个氨基酸,由9个外显子和8个内含子组成,序列分析显示其氨基酸端区包含有PTP和双特异磷酸酯酶。由N端180个氨基酸的催化区,中部165个氨基酸的C2区和C端50个氨基酸的尾区组成。研究PTEN蛋白的晶体结构表明,它有2个主要的结构域:N-端功能区(磷酸酶结构域)其活性位点是突变热点。C-端含脂质结合C2结构域,维持蛋白质稳定性的PEST结构域和蛋白间相互起作用的PDZ结构域。其中C2结构域介导蛋白质和脂类的结合及蛋白质的膜定位,PDZ结构域可增强PTEN的磷酸酶活性,增强PTEN信号的转导效率[7]。
PTEN的作用机制有以下几个途径:① PTEN促进细胞凋亡。首先,它阻止线粒体释放细胞色素C,并使AKt调节叉头(Forkhead)转录因子(FKHR)磷酸化失活,而这两个因子所诱导的基因(如Fas配体基因)表达对细胞凋亡极为重要。其次AKt使原凋亡因子BAD(Bcl-2家族成员)和半胱天冬蛋白酶-9(caspase)磷酸化而失活。另有相关研究报道,PI3K/AKt对转录因子NF-KB介导的细胞凋亡及CD-95/Fas诱导的细胞有拮抗作用[8]。可见,PI3K/AKt通路的激活,抑制了细胞凋亡,刺激了细胞生长。而PTEN基因具有双特异性磷酸活性,能使PIP3去磷酸化形成PIP2,维持了PIP3低水平,阻断了PI3K/AKt通路,促进细胞凋亡。②PTEN诱导细胞周期的阻滞:PTEN具有双磷酸脂酶特性,它激活PI3K使PIP3脱磷酸化,阻止PI3K调控的生长因子信号转导通路,维持细胞在正常的生长周期中的生长[9]。
PTEN蛋白具有多种生物学功能,通过其磷酸酶活性调节信号转导,进而调控细胞的生长、凋亡、黏附和迁移。是继P53后另一个广泛的与肿瘤关系密切的抑癌基因,在人类多种恶性肿瘤中都存在PTEN基因的异常表达,主要通过基因突变、缺失或者甲基化而失活[10]。PTEN蛋白在胞质中表现出双重特异性磷酸酶活性,在细胞的凋亡、细胞周期阻滞、细胞迁延过程中起关键作用,在恶性肿瘤的发生、发展中起重要作用。
本实验结果分析Livin和PTEN在喉鳞状细胞癌中的表达存在负相关关系,这与国内外的研究结果一致。这对基因的可能的作用机制,Livin和PTEN均参加细胞周期调控和细胞凋亡,两者作用环节一致,但生物学效应相反,在肿瘤的发展中发挥协同效应,随着肿瘤恶性程度加重,Livin表达增高,而PTEN表达减低,Livin的表达受PI3K/AKt(磷脂酰肌醇3激酶)信号传导途径的调控,而PTEN是PI3K/AKt通路的上游基因,对PI3K/AKt介导的细胞凋亡信号有调控作用。作为磷酸脂酶的PTEN在正常情况下抑制了PI3K/AKt通路,从而抑制Livin的表达,但组织发生恶变,PTEN表达下调或者缺失,其对PI3K/AK通路的抑制作用消弱,Livin表达上调,一方面启动细胞周期,促进细胞分裂,另一方面进入细胞核与CDK4(细胞周期素依赖性蛋白激酶)结合抑制凋亡。PTEN可使第二信使PIP3去磷酸化,转变成PIP2,阻断其下游AKt激酶的活化,进而阻断相应的信号传导系统,从而抑制细胞的生长及促进细胞的凋亡。
综上所述,喉鳞状细胞癌的发生、发展是一个很复杂的过程,Livin和PTEN基因在LSCC中的异常表达与临床病理特征的关系尚需大样本的实验研究;两者在LSCC中可能存在的相关性及在LSCC形成及发生发展过程中相互作用的机制尚需进一步研究探讨。
[1] 黄选兆,汪吉宝,孔维佳主编.实用耳鼻咽喉头颈外科学〔M〕.第2版.北京:人民卫生出版社,2008:488-493.
[2] Liu HB,kong CZ,Zeng Y,et al.Livin may serve as a marker for prognosis of bladder cancer relapse and a target of bladder cancer treatment〔J〕.Urol Oncol,2009,27(3):277-283.
[3] Liu C,Wu X,Luo C,et al.Antisense oligonucleotide targeting Livin induces apoptosis of human bladder cancer cell via a mechanism involving caspase〔J〕.J EXP Clin Cancer Res,2010,29:63.
[4] Hariu H,Hirohashi Y,Torigeo T,et al.Aberrant expression and potency as a cancer immunotherapy target of inhibitor of apoptosis protein family,Livin/ML-IAP in lung cancer 〔J〕.Clin Cancer Res,2005,11(3):1000-1009.
[5] Tanabe H,Yagihashi A,Tsuji N,et al.Expression of survi-vin mRNA and livin mRNA in non-small-cell lung cancer〔J〕.Lung Cancer,2004,46(3):299-304.
[6] Wang LN,Mou J,Zhang YB,et al.Inhibitor of apoptosis in lung cancer Livin perioperative clinical research〔J〕.Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2010,26(9):889-890.
[7] Simpson L,Parsons R.PTEN:life as a tumor suppressor -〔J〕.Exp Cell Res,2001,264(1):29-41.
[8] Romashkova JA,Makarov SS.NF-kappaB is a target of AKT in anti-apototic PDGF signalling〔J〕.Nature,1999,401(6748):86-90.
[9] Sulis ML,Parsons R.PTEN:from pathology to biology〔J〕.Trends Cell Biol,2003,13(9):478-483.
[10] 胡 骏,彭开桂.食管癌中抑癌基因PTEN研究进展〔J〕.蚌埠医学院学报,2010,35(5):532-534.

