长托宁对热性惊厥幼鼠海马神经元的保护作用
邵巧燕, 戴锦泉, 吴 斌, 施晓容, 陈林莺, 陈余朋
热性惊厥(febrile seizures,FS)是一种婴幼儿最常见的惊厥性疾病,多发生在6个月~5岁。FS发病机制尚不确定,目前认为是遗传、环境等多种因素相互作用的结果。研究报道,长时间反复发作的FS可导致幼鼠发育过程中脑损伤[1],表现为幼鼠海马神经元细胞凋亡增多、记忆力下降甚至颞叶癫痫的发生[2-3]。因此,FS脑损伤机制探讨及预防治疗是小儿神经学科的重点研究内容之一。抗胆碱能药物长托宁(盐酸戊乙奎醚注射液)是一种新型的抗胆碱药物。有研究表明:予腹腔内注射中等剂量的长托宁能缓解缺氧缺血再灌注后海马区域神经元损伤,起着脑神经元保护作用[4]。本研究将低剂量海人藻酸(kainic acid,KA)与脂多糖(Lipopolysaccharide,LPS)腹腔内注射建造幼鼠FS模型,探讨长托宁干预对FS所致海马CA1区神经元细胞的影响及可能机制。
1 材料与方法
1.1动物与分组 清洁级14日龄SD幼鼠3窝共54只,雌雄各半,体质量40~50 g[福建医科大学实验动物中心,许可证号:SCXK(闽)2004-0002]。幼鼠出生14 d内母乳喂养,母鼠同笼,保持良好生活环境卫生,每日更换食物、饮水。出生后第14 d随机分为盐水对照组、FS模型组、长托宁干预组(n=18);建模后12 h、24 h及48 h各组分别处死幼鼠6只。
1.2试剂 LPS(批号:2010AB4CA24, 美国Sigma公司);KA(批号:2010ACD268, 美国Sigma公司);长托宁(批号:H20020606,成都力斯特制药股份有限公司);原位凋亡细胞试剂盒(美国Roche公司)。
1.3方法
1.3.1模型建立及干预 FS对照组及长托宁干预组幼鼠测定基础体温之后,予腹腔注射LPS (200 μg/kg),肛温仪测量肛温,1次/10 min;2 h后肛温上升至38.5~40 ℃时,注射KA(1.75 mg/kg)于腹腔,盐水对照组给予等量生理盐水腹腔内注射[5-6]。长托宁干预组均在开始造模同时腹腔内注射长托宁(0.45 mg/kg)[4],盐水对照组、FS模型组在相应时间腹腔内注射等量体积生理盐水。观察记录各组幼鼠FS发作时的潜伏期、肛温、持续时间和级别。操作时间在1 d内完成。实验所在环境安静,保持湿度45%~70%,温度26~30 ℃。
1.3.2惊厥临床观察
1.3.2.1惊厥潜伏期及持续时间观察 惊厥潜伏期是指大鼠腹腔注射LPS后至发生惊厥之间的时间,以min为记录单位;惊厥持续时间是指大鼠由刚开始发生惊厥至惊厥停止之间的时间,以min为记录单位。
1.3.2.2惊厥程度分级 应用盲法观察与记录评分[6-7]。记录幼鼠惊厥潜伏期、体温、持续时间及级别(评分):0级:无惊厥 (0分);1级:面部抽动,凝视、咀嚼(1分);2级:点头、湿狗性抖动或搔抓(2分);3级:前肢阵挛或抽搐(3分);4级:伴有后肢站立性全身强直发作(4分);5级:伴站立后并摔倒的全身强直-阵挛样发作(5分)。出现3级以上发作提示造模成功。
1.3.3标本采集 应用乙醚麻醉幼鼠,通过左心室-主动脉插管,肝素钠生理盐水冲管后,再予多聚甲醛磷酸盐缓冲液(PBS 0.1 mmol/L)灌注,断头后迅速剥离海马,放置于40 g/L多聚甲醛中,4 ℃固定24 h,经脱水、石蜡包埋后,再应用振荡切片机从视交叉处始行冠状连续切片,片厚大约5 μm[6]。
1.4海马组织病理学检查 幼鼠海马神经组织应用10 %多聚甲醛固定,予石蜡包埋,只取冠状切面,H-E染色,应用双盲法于显微镜下观察海马CA1区神经元结构改变[6]。
1.5TUNEL法检测神经细胞凋亡 按照检测凋亡细胞试剂盒说明书标记凋亡细胞[6],过程包括:常规切片脱蜡脱水;于蛋白酶K(20 μg/mL溶在Tris/HCl中,pH 7.4~8.0)室温孵育15min;于50 μL TUNEL反应混合溶液湿盒内37 ℃孵育60 min;于50 μL转化剂-POD湿盒中37 ℃孵育30 min;最后于50~100 μL二氨基联苯胺(DAB)底物溶液室温孵育10 min。显微镜下进行分析,细胞核中见棕黄色颗粒者为阳性细胞。每组分别选3张切片,每张切片各选阳性细胞最为集中的5个高倍视野(×400),计算每个高倍视野阳性细胞,并取平均值。
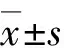
2 结 果
2.1LPS联合KA诱导幼鼠惊厥模型 3组幼鼠在开始药物注射初1 h内肛温无明显改变,差别无统计学意义(F=2.61,P>0.05);2 h后FS模型组及长托宁干预组幼鼠肛温明显升高,4 h达高峰[(39.82±0.23)℃],3组之间比较差别具有统计学意义[F(2 h)=36.41,P<0.01;F(3 h)=276.56,P<0.01;F(4 h)=103.67,P<0.01]。FS模型组、长托宁干预组惊厥时发作肛温差别统计学意义(P>0.05)。在诱导幼鼠FS发作过程中,FS模型组在注射KA后15~30 min均出现点头、流涎、肢体抖动等动作,后较快出现前肢阵挛,进一步发展为全身强直阵挛或摔倒,惊厥呈反复发作,惊厥发生率为100%,多在Ⅳ~Ⅴ级;盐水对照组均无惊厥发作。
2.2长托宁干预对幼鼠惊厥发作影响 FS模型组、长托宁干预组幼鼠惊厥潜伏时间相近。与FS模型组比较,长托宁干预组幼鼠惊厥发作程度减轻,级别多在Ⅲ~Ⅳ级,出现严重惊厥(Ⅳ~Ⅴ级)发生率为55.6%(10/18),FS模型组幼鼠出现严重惊厥发生率为77.8 %(14/18);2组幼鼠惊厥潜伏时间分别为(55.41± 9.93)min和(55.20±11.23)min,差别无统计学意义(t=0.062,P>0.05); 2组惊厥平均持续时间分别为(27.74±10.92)min和(23.74±8.60) min,长托宁干预组可减少惊厥持续时间(t=3.4,P<0.05);2组惊厥平均级别分别为(3.80±0.98)min和(3.18±0.91)min,差别有统计学意义(t=2.05,P<0.05),长托宁可减轻惊厥发作程度(表1)。

表1 各组幼鼠惊厥状况比较
2.3海马神经元病理学检查 盐水对照组海马神经元细胞层次排列齐、染色均匀,胞核居中圆而大,异染色质少,颜色淡蓝,胞质多见突起;FS模型组幼鼠海马CA1区切片上多见神经元变性,表现主要为细胞核染色质粗大,细胞核大小不一,细胞排列紊乱,部分细胞见空泡变。长托宁干预组也出现神经元变性,但程度较轻,总体排列尚整齐,形态接近正常(图1)。
2.4CA1区神经元凋亡细胞数检测 造模后盐水对照组海马CAl区TUNEL阳性细胞数检测数较少,与长托宁干预组比较,FS模型组海马CA1区可见较多TUNEL细胞(图2)。在不同时间点(12 h、24 h及48 h)分别将3组海马CA1区神经元TUNEL阳性细胞数进行比较,差别均有统计学意义[F(12 h)=100.18,P<0.05],[F(24 h)=99.88,P<0.05],[F(48 h)=79.20,P<0.05](表2)。

FS:热性惊厥. A:盐水对照组细胞排列规则,神经元轮廓清晰,胞核大而圆;B:FS模型组海马CA1区神经元细胞可见细胞形态不一,空泡细胞多,排列无序;C:长托宁干预组可见少许神经元变性,细胞排列尚规则.
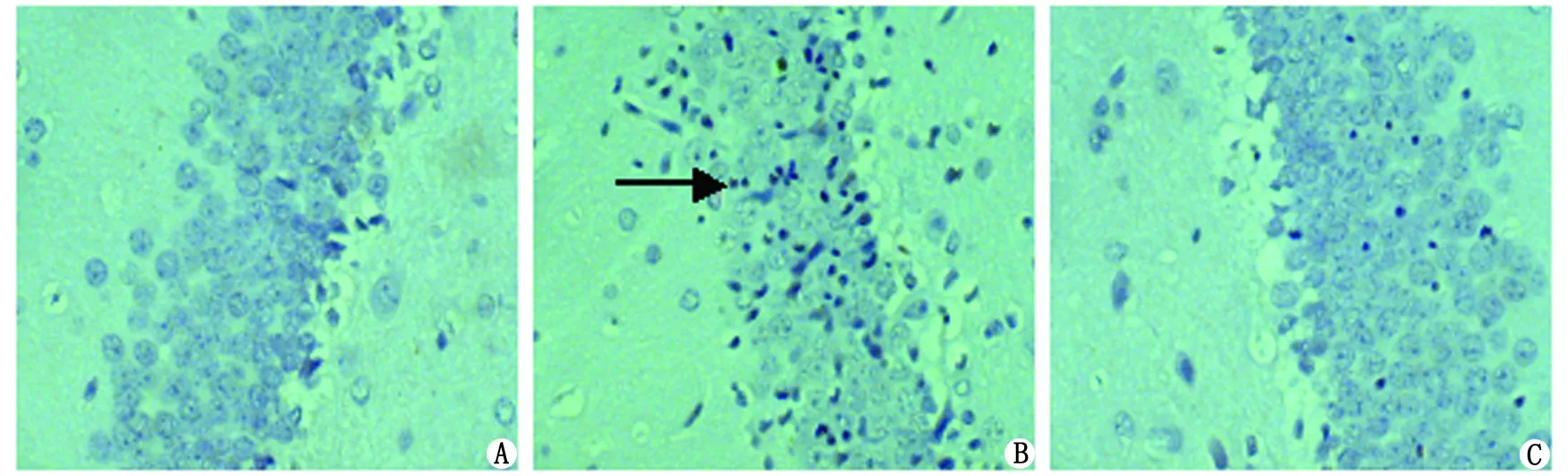
A:盐水对照组海马神经CA1区见少许TUNEL阳性细胞;B:FS模型组海马神经CA1区见较多TUNEL阳性细胞;C:长托宁干预组海马神经CA1区见少量TUNEL细胞.

表2 各组幼鼠海马CA1区TUNEL阳性细胞数比较
3 讨 论
FS是比较常见的儿童中枢神经系统疾病,发病率高。现已证实:长时间FS可导致发育中脑损害,尤其是在婴儿可引起神经传导通路改变,并增加颞叶癫痫的易感性[8-10]。因此,建立合理的FS脑损伤模型,探讨针对FS脑损伤的保护措施十分必要。文献表明,长托宁能够减少缺血再灌注脑损伤作用[11]。本试验研究长托宁对FS幼鼠的海马CA1区神经元的影响,从而进一步了解和明确长托宁对FS所致脑损伤的保护作用。
研究表明,出生后14 d幼鼠的脑发育程度与1岁儿童相当,28~30 d幼鼠的脑发育程度与2岁儿童相当[12],故选用14日幼鼠建立模型最为恰当。采用LPS联合低剂量KA腹腔内注射诱导建立幼鼠FS模型,这是最接近人类FS发作机制的动物模型,也是最常用、最有效的FS模型[6]。FS模型组与长托宁干预组均出现幼鼠体温上升及惊厥样发作表现,惊厥成功率100%,提示造模成功。同时还发现,LPS联合KA诱导FS模型组幼鼠海马CA1区凋亡阳性细胞数明显增多[13],提示FS可导致一定程度的脑损伤。因此,针对FS脑损伤保护方面的研究是十分必要的。
长托宁作为一种新型选择性抗胆碱药物,临床已应用多年,主要是用于麻醉前给药及有机磷中毒治疗。近年来,人们关注到长托宁不但有中枢及周围抗胆碱作用,还有改善微循环、抗氧化应激、减少炎症因子释放及减轻细胞凋亡的作用。研究表明,长托宁可通过抑制细胞外信号相关激酶(ERK1/2)及P38丝裂原活化蛋白激酶(p38MAPK)的活化,可减轻氧化应激反应,缓解脓毒性急性肺损伤、减轻幼鼠单肾动脉缺血再灌注的肾功能[14-15]。由于长托宁较好的血脑屏障通透性,其对中枢神经系统损伤也有类似抗炎疗效。文献报道,采用四动脉结扎法致大鼠全脑缺血再灌注,长托宁治疗可减少谷氨酸释放和谷氨酸受体表达,减轻大鼠海马CA1区神经元缺血再灌注损伤[16]。Huang报道长托宁可阻断NF-κB从细胞浆迁移至细胞核和P38丝裂原活化蛋白激酶的磷酸化,从而减轻由LPS诱导的小神经胶质细胞炎症[16]。以上研究表明,长托宁可能通过抑制细胞外信号相关激酶(ERK1/2)及p38MAPK的活化,减少氧化应激反应对缺血缺氧再灌注脑损伤或LPS诱导的中枢神经系统炎症有保护作用。
FS诱发多次惊厥发生时,大脑处于缺氧及相对缺血状态,对缺氧缺血敏感的海马CA1区域表现更为明显,神经元细胞产生ATP不足,不足以维持细胞内外离子平衡,尤其是ATP依赖性钙离子通道外流受限,细胞内钙超载,由此激发各种兴奋性氨基酸及自由基大量释放,最终导致海马神经元损伤。
本研究采用LPS和KA诱导幼鼠FS发作。LPS是内毒素的主要成分,极微量内毒素就会引起体温上升。KA是兴奋性氨基酸L-谷氨酸的一种类似物,其与谷氨酸受体结合后,可引起神经元去级化从而诱发惊厥发作。建模同时长托宁干预组幼鼠加入长托宁进行干预处理。研究结果表明:与FS模型组比较,长托宁干预组幼鼠惊厥程度较轻、惊厥发作时间较短;H-E染色观察,长托宁干预组幼鼠海马CA1区神经元细胞变性程度较模型组减轻;TUNEL法检测幼鼠海马CA1区神经元凋亡细胞数量较FS模型组明显减少。结果提示,长托宁干预能够在一定程度上减轻FS对幼鼠海马CA1区的神经元损伤,与Shang等研究相符[16],推测长托宁可能是通过减轻海马CA1区神经元细胞凋亡而起到其脑保护作用。
长托宁是一种能通过血脑屏障的高选择性新型抗胆碱类药,对FS所致脑损伤有一定保护作用,其机制尚不十分清楚,结合文献报道,笔者认为其机制可能如下:(1)阻断LPS引起的细胞内激活, 抑制NF-ΚB和p38MAPK活化,阻断细胞因子和炎性介质失控性释放;(2)清除自由基、稳定细胞膜等作用。因此,长托宁可能是一种新型FS脑保护的药物,值得进一步研究。
参考文献:
[1] Mortazavi F, Ericson M, Story D,etal. Spatial learning deficits and emotional impairments in pentylenetetrazol-kindled rats[J].Epilepsy&Behavior,2005,7(4):629-638.
[2] Chang Y C, Huang C C, Huang S C,etal. Long-term effects of febrile seizures[J].ChangGungMedicalJournal, 2008,31(2):125-134.
[3] Céline Dub, Richichi C, Bender R A.etal. Temporal lobe epilepsy after experimental prolonged febrile seizures: prospective analysis[J].Brain,2006,129(4):911-922.
[4] Cao H J,Sun Y J,Zhang T Z,etal. Penehyclidine hydrochloride attenuates the cerebral injury in a rat model of cardiopulmonary bypass[J].CanJPhysiolPharmacol,2013,91(7):521-527.
[5] Heida J G,Teskey G C,Pittman,etal. Febrile convulsions induced by combination of lipopoly-sacch aride and low-dose kainic acid enhance seizure susceptibility, not epilepto-genesis, in rats[J].Epilepsia, 2005,46(12):1898-1905.
[6] 施晓容,邵巧燕,刘俊红,等.脂多糖联合低剂量海人藻酸诱导建立幼鼠FS脑损伤模型[J]. 实用儿科临床杂志,2012,27(18):1432-1435.
[7] Jiang W,Duong T M,DeLanerolle N C,etal. Neuropathology of Hyperthermic seizures in the rat[J].Epilepsia,1999,40(1):5-19.
[8] 常杏芝,秦 炯,吴希如.幼年幼鼠反复FS脑损伤的研究[J].中国当代儿科杂志,2002,4(6):439-442.
[9] Reid A Y,Pittman Q J,Teskey G C,etal. A prolonged experimental febrile seizure results in motor map reorganization in adulthood[J].NeurobiolDis,2012,45(2):692-700.
[10] Dub C M,Ravizza T,Hamamura M,etal. Epileptogenesis provoked by Prolo-nged experimental febrile seizures: Mechanisms and biomarkers[J].Neurosci,2010,30(22):7484-7494.
[11] Wang Y,Ma T,Li M,etal. Regulated hypoxia/reperfusion-dependent modulation of ERK1/2, cPLA2, and Bcl-2/Bax: a potential mechanism of neuroprotective effect of penehyclidine hydrochloride[J].InenationalJNeuroscience,2011,121(8):442-449.
[12] 施晓容,邵巧燕,刘俊红,等. 脂多糖联合海人藻酸诱导的FS导致幼鼠海马神经元凋亡[J].福建医科大学学报,2012,46(2):104-107.
[13] Zhan J,Liu Y,Zhang Z,etal. Effect of penehyclidine hydrochloride on expressions of MAPK in mice with CLP-induced acute lung injury[J].MolBiolRep,2011,38(3):1909-1914.
[14] Wang Y P,Li G,Ma L L,etal. Penehyclidine hydrochloride ameliorates renal ischemia-reperfusion injury in rats[J].JSurgRes,2014,186(1):390-397.
[15] Shang Y,Gu P F,Shang Y,etal.Penehyclidine hydrochloride inhibits glutamate release and related research in global brain ischemia/reperfusion rats[J].ZhongguoYingYongShengLiXueZaZhi,2011, 27(3):353-356.
[16] Huang C,He J,Chen Y,etal. Penehyclidine hydrochloride inhibits the LPS-induced inflammatory response in microglia[J].JSurgRes,2014,188(1):260-267.

