微藻油脂的研究进展
,, ,
(青岛科技大学化工学院,山东青岛 266042)
微藻油脂的研究进展
翟映雪,梁成伟*,张伟,于建生
(青岛科技大学化工学院,山东青岛 266042)
全球能源危机使可再生能源的开发和利用越来越受到人们的关注。与产油农作物相比,微藻凭借其结构简单、生长速度快、有较高的含油率等特点成为生物能源产业最具竞争力的选择之一。本文首先介绍了微藻的种类、藻体中的油脂,然后从影响油脂积累的因素、微藻中油脂的提取和微藻高油脂化基因工程方面进行了阐述,最后对微藻生产生物柴油产业的发展趋势和研究方向进行了展望,为进一步降低微藻产油成本,提高微藻生物柴油经济性提出了一条极有可能实现工业化的潜在高效生产途径。
微藻,能源,生物柴油,综合利用,三羧酸甘油酯
能源是人类生存与发展的生物基础,传统的能量有水、木材、石油、天然气和煤炭等。但是随着全球经济的发展,石油、煤炭等能源的过量消耗,能源正面临枯竭的危机,同时新的能源生产供应系统又未能建立,由此产生了在交通运输、金融等方面的一系列问题,所以寻找新型能源形式成为国际研究的热点[1]。许多国家将注意力转移到可再生生物能源的开发利用上,希望能替代化石能源。生物质能源是指利用生物本身的有机物质直接转化为能源物,其低碳、节能、环保的优势受到全球各国的普遍关注[2-4]。生物柴油属于生物质能源,与石化柴油相比具有较多的优点,如不含硫和芳烃、十六烷值高、可被生物降解、对环境危害小等,且其闪点高,无论是储存、使用还是运输都非常安全,所以成为最受欢迎的石油替代能源之一[3]。
在众多的生物质中,微藻具有生物量大、生长周期短、易培养、含有较多的脂类物质等优点,可直接产生氢气或利用快速热解和直接液化技术生产油品,还有碳减排的功效。多数微藻都是自养性的,利用光合作用的效率非常高,产生的代谢物种类也很多。光合作用是唯一一种能将CO2转化为有机成分的过程,利用太阳能,将无机物转化为氢、高不饱和烷烃、油脂等能源物质。大规模培养微藻,其单位面积是油料作物的10~20倍,并且微藻适应能力强,可以在各种水体环境下生长,如盐碱地、海洋等,不占据陆地有限的耕地面积[5]。表一[2,4]比较了不同生物柴油原料的油脂成分和产量。由表可以看到,高产油微藻的油脂含量高达70%,其产量在136900L/ha/year,高于其他作物。可以说,微藻是当今最有开发前途的能源之一。
近几年,西方发达国家在微藻能源上投巨资进行研发及产业化的消息不断传来,美国2007年启动了微藻能源计划,被称为“微型曼哈顿计划”;2008年10月,英国碳基金公司启动了目前世界上最大的藻类生物燃料项目,投入的2600万英镑将用于发展相关技术和基础设施,该项目预计到2020年实现商业化。2011年我国微藻能源方向首个国家重点基础研究发展计划(“937计划”)项目已经正式启动。到2015年该项目结题时,有望突破微藻制油高成本瓶颈。此外,澳洲、日本、西欧、印度和南非的政府或企业也投入巨资进行微藻生物柴油的研究。这些研究的发展和技术的进步,有助于进一步降低微藻生物柴油的生产成本,使其大规模应用得以早日实现。
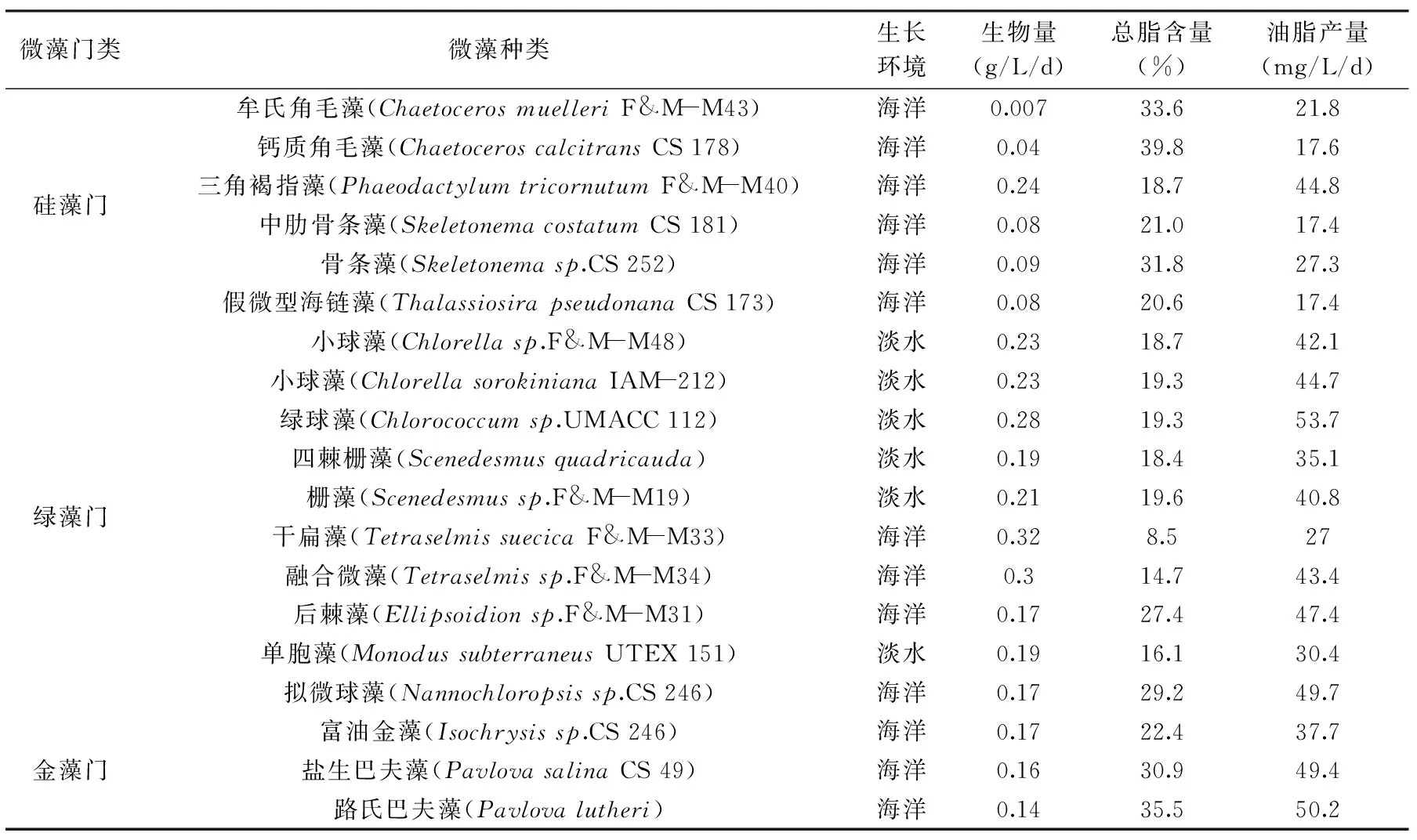
表2 微藻的生物量、总脂含量及油脂产量Table 2 Biomass productivity,lipid content and lipid productivity of microalgal strains
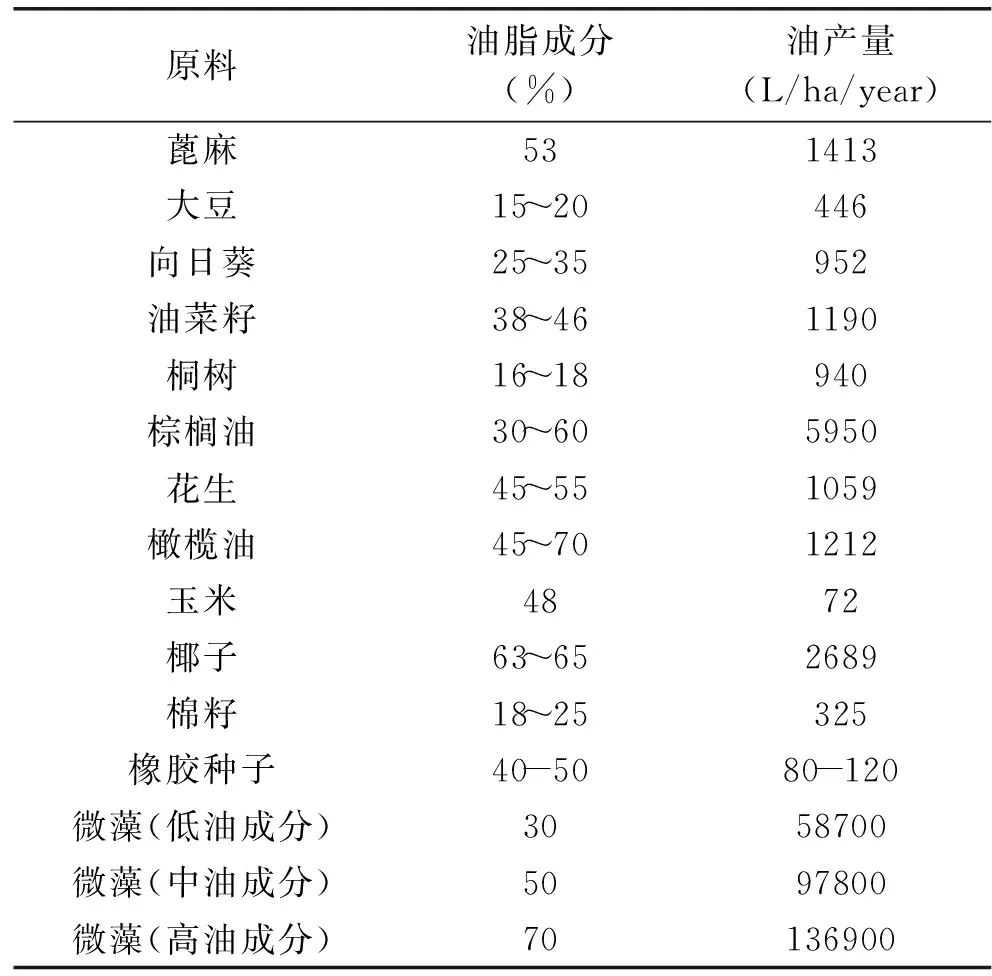
表1 不同生物柴油原料油脂成分和产量Table 1 Comparison of microalgae with other biodiesel feedstocks
1 微藻的种类
微藻种类繁多,广泛分布于海洋、湖泊、陆地等地,是一类细胞结构简单、生物速度快的原核或真核光合微生物[6]。根据微藻细胞所含色素种类、生活史和细胞基本结构,目前常见的微藻主要归于八个门类,分别是:硅藻门、绿藻门、金藻门、蓝藻门、甲藻门、红藻门、隐藻门和黄藻门[7]。含油脂较多的微藻门类集中在硅藻门、绿藻门、金藻门中。Rodolfi[8]等在250mL烧瓶中培养微藻,并比较了这几十种微藻的生物量、总脂含量和油脂产量,如表2所示。
常见的硅藻种类有三角褐藻指藻、角毛藻、小新月菱形藻小环藻等。硅藻同化产物为脂肪、金藻昆布糖和异染小粒。现有研究资料表明[2],在正常生长状态中,各种微藻平均总脂肪含量为干重的22.7%,而在胁迫状态下可达干重的44.6%以上。高等植物是由绿藻进化而来的,所以与其他种类的藻相比,绿藻受到了研究者们得更多关注。培养较多的大细胞绿藻有小球藻、拟微球藻、莱茵衣藻、雨生红球藻等。绿藻门得油脂平均总脂含量为干重的25.5%,在光氧化或营养盐迫等逆境下,细胞总脂含量可高达53.7%。金藻门的微藻主要分布在淡水中,海水中生活的种相对较少。其同化产物是金藻昆布多糖和油滴状脂肪,特别在休眠孢子基包囊中,同化产物含量相当大一部分是油脂。培养较多的单细胞金藻有叉边金藻和球等边金藻等。
2 微藻中油脂
2.1微藻中的油脂类型
微藻中产生的油脂一般包括中性油脂、极性油脂,还有一些非极性脂成分,如蜡酯、固醇酯、甘油三酯,另外像生育酚、类胡萝卜素等异戊烯衍生物也存在于微藻中。微藻中的油脂可以分为两个类别,分别是:贮存脂(非极性脂)和结构脂(非极性脂)。贮存脂中的三酰基甘油酯(TAGs),主要由可转化成生物柴油大部分的饱和脂肪酸和一部分的不饱和脂肪酸组成[1]。结构脂主要由多不饱和脂肪酸组成,长链的多不饱和脂肪酸在生物体尤其是哺乳动物体内起着重要的调节作用。极性脂和固醇类脂是细胞膜的主要组成成分,这些成分使细胞膜具有选择性渗透的特性。同时,这些脂在调节膜的流动性、增加膜的稳定性以及降低水溶性物质的通透性等都起着重要作用。一些极性脂类,除了维持结构稳定的功能外,还是细胞信号通路的关键的中间体,如肌醇脂类、鞘脂类等。
非极性脂类中的TAGs很容易被分解代谢,在新陈代谢过程中它作为能源起了一个重要的作用[9]。一般来说,TAGs在有光照的条件下合成,贮存在细胞质的油滴中,然后在黑暗的条件下用于极性脂的合成[10]。微藻中的TAGs一般是饱和和多不饱和脂肪酸酯化而成,而有些油脂丰富物种中积累大量的长链单不饱和脂肪酸,也可酯化形成TAGs[11-12]。有学者对缺刻源绿藻(Parietochloris incisa)中TAGs积累与其储存叶绿素脂质做出研究,结果表明微藻中的TAGs的主要功能并非只有贮存能量。当环境条件突然改变,不饱和脂肪酸的从头合成变慢,其合成的TAGs用其特有的酰基组结构合成甘油二脂和其他极性脂类,以适应环境变化引起的质膜重组[13-14]。
2.2影响微藻生长及油脂积累的因素
微藻中脂肪酸含量不仅与微藻的种类有关,还受组成个体的基因控制,微藻在正常生长条件下,合成的脂肪酸含量较少。而微藻受到化学刺激,如营养盐、盐度等含量的改变,或物理等胁迫条件的刺激,如光强、温度发生较大的改变,其中的脂肪酸成分的合成和积累会受到较大影响。
2.2.1 营养物质氮和磷 营养物质不仅影响微藻的生长和繁殖,并且对微藻中的油脂和脂肪酸成分的积累有重要作用。大部分微藻种株在氮缺失的条件下,有积累油脂的趋势,特别是三甘油酰酐[15-16]。栅藻(Scenedesmussp.)在氮饥饿条件下油脂达到30%[17],拟微球藻和小球藻分别增加了15.31%和16.41%[18]。童牧[19]等对缺刻源绿藻的研究显示,该藻在完全培养基中的生物量都大于同一培养时间氮饥饿,而同一条件下,总脂肪酸含量提高了1.2倍。还有研究表明,氮缺失条件不仅使雨生红球藻(Haematococcuspluvialis)细胞中油脂含量增加,同时对类胡萝素含量的积累也有显著影响,可能这两种物质在细胞的抗逆反应中起着一定的保护作用[20]。磷饥饿促使大部分微藻总脂肪酸含量增加[21],如缺刻源绿藻(Parietochlorisincisa),球等边金藻(Isochrysisgalbana),角毛藻(Chaetocerossp.)等。但有时候磷饥饿也可促进脂肪酸含量的降低。研究表明,在融合微藻(Tetraselmissp.)中,磷缺失条件下脂肪酸C18∶4ω3,C20∶5ω3和C22∶6ω3产量下降[22]。
2.2.2 温度 一般来说,温度对藻类的影响是随着温度的降低,不饱和脂肪酸含量增加;而随着温度的上升,饱和脂肪酸含量上升[23]。对杜氏盐藻(Dunaliellasalina)在低温下油脂成分的研究较为广泛,温度有30℃降低到12℃,不饱和脂肪酸含量显著降低了20%[10]。丹麦棕鞭藻(Ochromonasdanica)培养温度由15℃上升到30℃时,该藻的生物量和总脂肪酸含量都有明显增加[24]。 然而,有研究者将培养羊角月牙藻(Selenastrumcapricornutum)的温度由25℃降低到10℃,C18∶1的含量有所升高而C18∶2n-6和C18∶4n-3含量下降[25]。Patterson[26]等将小球藻(Chlorellasorokiniana)在不同的温度梯度中培养,该藻种油脂含量没有明显变化。
2.2.3 盐度 Takagi[27]等对杜氏盐藻(Dunaliella)研究表明:该藻可在高盐的环境中生存。将盐浓度从0.5mol/L提高到3.5mol/L,大部分的饱和和不饱和脂肪酸都有显著增加。Chen[28]等人对硅藻的研究也表明,当该藻在高盐浓度的环境中时,盐浓度由10g/L上升到20g/L,不饱和脂肪酸的含量显著增加。雪藻[29]在0.75%盐浓度下培养7h,最高的总脂肪含量增长了2倍,其中中性脂和极性脂别在1%和1.25%的盐浓度下分别增长了68倍和10倍。可见,盐度对一些藻种中总脂肪酸含量的影响十分巨大的。
2.2.4 pH和金属离子 培养基中pH的波动可改变微藻的油脂成分,例如,碱性条件可使小球藻(Chlorella chlor1)中TAG含量大量积累。基于形态学观察,由于碱性pH可抑制微藻生长,所以使微藻中的能量转化形成TAG[30]。金属离子如镉、铁、铜和锌等也可影响一些微藻中油脂成分。EinickerLama[31]等对纤细裸藻(Euglena gracilis)在自养、异养条件下镉离子浓度对其生长的影响进行了研究,结果发现三种培养下,镉离子均能促进该藻单位细胞中总脂含量的积累。在铜离子和锌离子诱导下,除了固醇类得脂含量变化不明显外,其余脂类都有不同程度的增加。此外,Liu[32]等用铁离子诱导对小球藻(Chlorellavulgaris)诱导的研究表明,在该藻对数生长期加入不同浓度的铁离子,其总脂肪酸含量可增加到56.6%。
2.2.5 光照 光是影响微藻生长及其生化成分发生改变的重要因素。不同的光密度和波长通过改变微藻中油脂新陈代谢而改变油脂比例。一般而言,低光强能诱导极性油脂的合成,而高光强则能导致中性油脂的积累。廖启斌[33]等报道三角褐指藻和小球藻不饱和脂肪酸含量随着照度的增加呈下降趋势。谬锦来[34]等人对两株绿藻Pyramidomonassp.和ChlorophyceaeL-4的研究发现,随着光强从39lx变化到3900lx,细胞总脂肪酸含量显著降低。这是因为在最适生长光强条件下,南极冰藻的比生长速度增加,光合产物用以生长所需,因此脂肪的含量较低。而随着光强的降低,2种绿藻的生长速度降低,有限的光合作用产物分配给潜在的能量储存形式,如碳水化合物、脂肪等。
2.2.6 紫外线 紫外对微藻中油脂含量影响的研究主要集中在紫外线A(UV-A)和紫外线B(UV-B)的辐射影响。Srinivas 和 Ochs[35]报道了紫外线A对拟微球藻(Nannochloropsisoculata)中油脂积累的影响。UV-A使该藻中多不饱和脂肪酸含量显著增加。Skerratt[36]对三种南极冰藻Odontellaweissflogii,Chaetocerossimplex和HaptophytePhaeocystis的分析表明,UV-B其总脂肪酸含量,脂肪酸成分和固醇物质含量有一定的影响。扁藻(Tetraselmissp.)在UV-B辐照4h后饱和脂肪酸和单不饱和脂肪含量升高,而多不饱和脂肪酸含量下降了50%。
3 微藻油脂的测定
收集的微藻悬浊液较易腐坏,必须在收集之后迅速处理,对藻液进行脱水和干燥。缩水干燥的方法一般有太阳干燥、低压干燥、喷雾干燥、转鼓式干燥、流化床干燥、冷冻干燥等。
干燥后的微藻,经充分研磨使微藻细胞壁破碎后再进行油脂的提取。传统的提取有机溶剂提取法和索氏提取法,目前使用较为广泛的是荧光染料测定法、傅里叶换红外光谱法和磷酸香草醛法,还有其他的一些方法如铜试剂法、苏丹黑染色法、核磁共振法、超临界CO2提取法、离子液提取法等。
Folch[37]等首先建立了在动物组织中用有机试剂氯仿甲醇提取油脂的方法。Bligh和Dye[38]等将其方法改进,用有机试剂氯仿∶甲醇∶蒸馏水=2∶1∶0.9提取油脂,该方法也适用于藻类总脂的含量的测定。有机试剂提取法成本较为低廉,容易操作,在实验室中适用较为普遍,缺点是需要大量的样品,测量结果所得的油脂总量较低,有机试剂操作有毒性危害身体健康污染环境,操作耗时费力。荧光染料是一种较为新型的测定总脂的方法,倍受研究者的关注。尼罗红、BODIPY505/515都是一种脂溶性荧光染料,其原理是细胞内总脂含量和荧光染料的荧光强度呈显著相关。与传统有机试剂提取法相比,荧光染料测定法无需将细胞破碎,可以直接在细胞活体中加入染料,所需样品量较少,快速操作,灵敏度高。超临界CO2提取法是通过控制气体CO2的温度和压力来改变其溶解度,从样品中提出脂类物质,然后经干燥测定总脂肪酸含量。这种方法提取总脂的效率较高,且较为安全。但其价格昂贵,不适于大规模提取。
4 微藻高油脂化基因工程
除了通过改变微藻生存条件使微藻合成较多的油脂,各国科学家还致力于应用基因工程改造微藻脂肪酸调控途径,改善微藻脂肪酸合成途径,从而实现微藻制备生物柴油的目的。许多研究者已经从莱茵衣藻(C.reinhardtii)分子水平、基因水平、生理学水平进行了研究[39-40]。近十年,微藻基因工程的研究已经取得了较大的进展,如表达序列标签(EST)数据库已经建立;几种微藻的细胞核、线粒体和叶绿体基因的转录组序列已经确定。1990年Roessler[41]首次从小环藻(Cyclotellacryptica)中提取出与脂肪酸合成有关的限速酶乙酰辅酶A羧化酶(ACC)。ACC具有为脂肪酸的合成提供碳源,限制脂肪酸的合成并控制油脂沉积的功能之后成功改造了硅藻Cyclotellacryptica和Naviculasaprophila的基因。目前,正在研究选择合适的分子载体,使ACC基因在细菌、酵母和植物中充分表达,还进一步将修饰的ACC基因引入微藻中以获得更高效表达[6]。
5 展望
微藻能源化涉及到许多环节,包括多学科技术和多行业的参与。微藻的选育涉及到遗传学、生物学,养殖过程关系到土地和农民生产和创收,生长涉及废水、废气的利用方法,采收过程中关系到采收设备的制造,生物活性物质的提取需要化学、化工、生物等技术和设备等。所以说,微藻能源化是一个系统工程,需要各方的全面参与、配合、协调与投入。
另外,要综合利用微藻的生物活性物质,在微藻的大规模、较低成本的培养和采收基础上,首先对微藻中利润较大、有较高价格空间的生物活性物质进行分离提纯,然后再对微藻中的生物油脂进行提取,这样,小小的微藻就产出两类重要的产品。Harun[41]等也提出了关于微藻制备生物能源与产生的甲烷气体综合利用的方案,这有利促进经济和生物柴油产业链的可持续发展。
着眼未来,将微藻培养、采收、深度开发和综合利用形成产学研相结合的产业联盟,将废气、废地、废水有效利用,形成上、中、下游的产业链,降低微藻能源化的成本,提高经济效益,这是微藻能源实施产业化的重要途径和方向所在。
[1]Sharma K K,Schuhmann H,Schenk P M,etal. High Lipid Induction in Microalgae for Biodiesel Production[J]. Energies,2012,5(5):1532-1553.
[2]Ahmad A L,Mat Y N H,Derek C J C,etal. Microalgae as a sustainable energy source for biodiesel production:a review[J]. Renewable and Sustainable Energy Reviews,2011,15(1):584-593.
[3]陈国,赵珺,苏鹏飞,等. 微藻产生物柴油研究进展[J]. 化工进展,2011,10(2):2186-2193.
[4]Janaun J,Ellis N. Perspectives on biodiesel as a sustainable fuel[J]. Renewable and Sustainable Energy Reviews,2010,14(4):1312-1320.
[5]Chisti Y. Biodiesel from microalgae[J]. Biotechnology Advances. 2007,25(3):294-306.
[6]张英伟,刘炜. 微藻能源的研究进展[J]. 海洋科学,2012,6(1):132-138.
[7]刘志媛. 微藻生物柴油[M]. 海口:海南出版社,2010:18-23.
[8]Rodolfi L,Zittelli GC,Bassi N,etal. Microalgae for oil:strain selection,induction of lipid synthesis and outdoor mass cultivation in a low cost photobioreactor. Biotechnology and Bioengineering,2009,102(1):100-12.
[9]Gurr M I,Harwood J L. Lipid Biochemistry:An Introduction[M]. Blackwell:Oxford,1991:p. 320.
[10]Thompson G A. Lipids and membrane function in green algae[J]. Biochimica et Biophysica Acta,1996,1302(2):17-45.
[11]Bigogno C,KhozinGoldberg I,Cohen Z. Accumulation of arachidonic acid-rich triacylglycerols in the microalga Parietochloris incisa(trebuxiophyceae,chlorophyta)[J]. Phytochemistry. 2002,60(2):135-143.
[12]Alonso D L,Belarbi E H,RodríguezRuiz J,etal. Acyl lipids of three microalgae[J]. Phytochemistry. 1998,47(8):1473-1481.
[13]Khozin G I,Cohen Z. The effect of phosphate starvation on the lipid and fatty acid composition of the fresh water eustigmatophyte Monodus subterraneus. Phytochemistry[J]. 2006,67(7):696-701.
[14]Makewicz A,Gribi C,Eichenberger W. Lipids of Ectocarpus fasciculatus(phaeophyceae). Incorporation of[l-14C]oleate and the role of TAG and MGDG in lipid metabolism[J]. Plant Cell Physiol,1997,38(8):952-962.
[15]Yeh K L,Chang J S. Nitrogen starvation strategies and photobioreactor design for enhancing lipid content and lipid production of a newly isolated microalga Chlorella vulgaris ESP-31:Implications for biofuels[J]. Biotechnol,2011,6(1):1358-1366.
[16]Praveenkumar R,Shameera K,Mahalakshmi G,etal. Influence of nutrient deprivations on lipid accumulation in a dominant indigenous microalga Chlorella sp.bum11008:Evaluation for biodiesel production[J]. Biomass and Bioenergy,2012,37(4):60-66.
[17]Li X,Hu H Y,Gan K,etal. Effects of different nitrogen and phosphorus concentrations on the growth,nutriant uptake,and lipid accumulation of a freshwater microalga Scenedesmus sp.[J].Bioresource Technology. 2010,101(14):5494-5500.
[18]Converti A,Casazza A A,Ortiz E Y,etal. Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production[J]. Chemical Engineering and Processing. 2009,48(6):1146-1151.
[19]童牧,于水燕,欧阳珑玲,等. 氮饥饿与磷饥饿促使缺刻缘绿藻花生四烯酸含量增加的比较[J]. 水产学报,2011,35(3):763-773.
[20]Zhekisheva M,Boussiba S,KhozinGoldberg I,etal. Accumulation of oleic acid in Haematococcus pluvialis(Chlorophyceae)under nitrogen starvation or high light is correlated with that of astaxanthin esters[J]. Journal of Phycology,2002,38(2):325-331.
[21]罗梦柳,桑敏,张成武,等. 氮、磷对缺刻缘绿藻生长、总脂及花生四烯酸积累的影响.天然产物的研究与开发[J]. 2010,32(3):378-382.
[22]Reitan K I,Rainuzzo J R,Olsen Y. Effect of nutrient limitation on fatty acid and lipid content of marine microalgae[J].Journal of Phycology,1994,30(6):972-979.
[23]Renaud S M,Thinh L V,Lambrinidis G,etal. Effect of temperature on growth,chemical composition and fatty acid composition of tropical Australian microalgae grown in batch cultures[J]. Aquaculture,2002,211(1):195-214.
[24]Aaronson S. Effect of incubation temperature on the macromolecular and lipid content of the phytoflagellate Ochromonas danica[J]. Journal of Phycology,1973,9(1):111-113.
[25]Dewaele A,Guyot F,McLarnonRiches C J,etal. Effects of environmental factors and metals on Selenastrum capricornutum lipids. Phytochemistry[J]. 1998,49(5):1241-1247.
[26]Patterson G. Effect of culture temperature on fatty acid composition of Chlorella sorokiniana[J]. Lipids,1970,5(7):597-600.
[27]Takagi M,Yoshida T. Effect of salt concentration on intracellular accumulation of lipids and triacylglyceride in marine microalgae Dunaliella cells[J]. Journal of Bioscience and Bioengineering,2006,101(3):223-226.
[28]Chen G Q,Jiang Y,Chen F. Salt-induced alterations in lipid composition of diatom nitzschia laevis(bacillariophyceae)under heterotrophic culture condition[J]. Journal of Phycology,2008,44(5):1309-1314.
[29]Na L,We D,Jiang X L,etal. Regulation of lipid metabolism in the snow alga Chlamydomonas nivalis in response to NaCl stress:An integrated analysis by cytomic and lipidomic approaches[J]. Biochemistry,2012,47(7):1163-1170.
[30]Guckert J B,Cooksey K E. Triglyceride accumulation and fatty acid profile changes in Chlorella(chlorophyta)during high ph-induced cell cycle inhibition[J]. Journal of Phycology,1990,26(1):72-79.
[31]EinickerLamas M,Mezian G A,Fernandes T B,etal. Euglena gracilis as a model for the study of Cu2+and Zn2+toxicity and accumulation in eukaryotic cells[J]. Environmental Pollution,2002,120(3):779-786.
[32]Liu Z Y,Wang G C,Zhou B C. Effect of iron on growth and lipid accumulation in Chlorella vulgaris[J]. Bioresource Technology,2008,99(11):4717-4722.
[33]廖启斌,李芊,李文权,等.光辐射对海洋微藻脂肪酸含量的效应[J].海洋技术,2002,21(1):46-48.
[34]缪锦来,王 波,阚光锋,等. 环境因子对2种南极绿藻脂肪含量和脂肪酸组成的影响[J]. 海洋科学,2005,29(1):4-11.
[35]Srinivas R,Ochs C. Effect of UV-A irradiance on lipid accumulation in Nannochloropsis oculata[J]. Photochemistry and Photobiology. 2012,88(3):684-689.
[36]Skerratt J H,Davidson A D,Nichols P D,etal. Effect of UV-B on lipid content of three antarctic marine phytoplankton[J]. Phytochemistry,1998,49(4):999-1007.
[37]Folch J,Lees M,Sloane-Stanley G H. A simple method for the isolation and purification of total lipids from animal tissues[J]. Journal of Biological Chemistry,1957,226(1):497-509.
[38]Bligh E G,Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology,1959,37(8):106-110.
[39]Merchant S S,Kropat J,Liu B,etal. Chlamydomonas as a reference organism for understanding algal triacylglycerol accumulation[J]. Current Opinion in Biotechnology,2011,23(3):352-363.
[40]Boyle N R,Page M D,Liu B,etal. Three acyltransferases and a nitrogen responsive regulator are implicated in nitrogen starvation-induced triacylglycerol accumulation in Chlamydomonas[J]. The Journal of Biological Chemistry,2012,287(19):15811-15825.
[41]Roessler P G. Purification and characterizatio n of acetyl-coa carboxylase from the Diatom Cyclotella cryptica[J]. Plant Physiology,1990,92(1):73-78.
[42]Harun R,Davidson M,Doyle M,etal. Technoeconomic analysis of an integrated microalgae photobioreactor,biodiesel and biogas production facility[J]. Biomass and Bioenergy,2011,35(1):741-747.
Advances on Microalgae as Sustainable Energy Source for Biodiesel Production
ZHAIYing-xue,LIANGCheng-wei*,ZHANGWei,YUJian-sheng
(Qingdao University of Science And Technology,Qingdao 266042,China)
The global energy crisis has stimulated the need to find alternative energy resources.Microalgae is a promising source of biofuel due to their simple cellular structure,higher growth rate,and higher lipid content than conventional oleaginous vegetable crops. In this article,the strains of microalgae and lipid in microalgae is introduced. Consequently,the factor of lipid accumulation in microalgae,methods of lipid extraction,genetic engineering of microalgae to increase lipid production are elucidated independently. Finally,trends and research areas in microalgae-biodiesel industry are proposed,and the integrated technology will further reduce the cost microalgal lipid production whilst making this process to be economical for the production of biodiesel.
microalgae;energy;biodiesel;comprehensive utilization;triacylglycerols
2013-08-12 *通讯联系人
翟映雪(1988-),女,硕士研究生,研究方向:微藻生物能源。
国家自然科学基金(31000135);青岛市基础研究项目(11-2-4-3-(5)-jch)。
TS222+.1
A
1002-0306(2014)17-0000-00
10.13386/j.issn1002-0306.2014.17.001

