ERK1/2 MAPK通路在Eca109细胞体外增殖和迁移中的作用及其机制
刘凤霞,牛淑亮,李建勇,郑树涛,卢晓梅,刘文亚
(新疆医科大学 1.基础医学院 人体解剖学教研室; 2.第一附属医院 医学研究中心;3.第一附属医院 影像中心, 新疆 乌鲁木齐 830011)
ERK1/2 MAPK通路在Eca109细胞体外增殖和迁移中的作用及其机制
刘凤霞1,牛淑亮1,李建勇1,郑树涛2,卢晓梅2,刘文亚3*
(新疆医科大学 1.基础医学院 人体解剖学教研室; 2.第一附属医院 医学研究中心;3.第一附属医院 影像中心, 新疆 乌鲁木齐 830011)
目的观察ERK1/2 MAPK通路在食管鳞状细胞癌(ESCC)Eca109细胞系增殖和迁移中的作用并探讨其作用机制。方法使用MAPK(ERK1/2)抑制剂U0126处理Eca109细胞;细胞计数检测细胞增殖;倒置显微镜下观察细胞形态;实时荧光定量PCR(qRT-PCR)检测ERK1/2 mRNA;Western blot检测总ERK1/2(t-ERK1/2)和磷酸化ERK1/2(p-ERK1/2);MTT和细胞划痕实验检测细胞增殖和迁移能力;qRT-PCR检测MicroRNA-21(miR-21)。结果20 μmol/L浓度的U0126可抑制Eca109细胞生长(Plt;0.05),破坏细胞正常形态,ERK1/2 MAPK通路的活化在蛋白质水平被抑制(Plt;0.05),Eca109细胞增殖和迁移明显减弱(Plt;0.05),显著下调miR-21的表达(Plt;0.05)。结论ERK1/2 MAPK信号通路抑制可减弱Eca109细胞增殖和迁移,其可能的作用机制之一与其抑制miR-21表达有关。
ERK1/2;Eca109细胞;增殖;迁移;MicroRNA-21
食管癌是最常见的恶性肿瘤之一,在恶性肿瘤中其发病率位居第9位,死亡率居第6位[1],其中食管鳞癌占食管癌的90%以上。目前的治疗以手术切除治疗为主,结合放化疗综合进行,虽然这些方法对某些早期发现的恶性肿瘤可起到根治性作用,但多数食管癌患者确诊时已处于晚期阶段,对这些患者仅仅起到姑息性治疗作用,5年生存率仅为10%左右[2],中位生存时间仅8~13个月[3],患者最终死于肿瘤的转移和复发。细胞外信号调节蛋白激酶(extracellular signal regulated protein kinase, ERK)相关的细胞内信号传导途径被认为是经典的丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号传导途径。ERK1/2正常定位于胞质内,当激活后进入细胞核,ERK肽链的183位苏氨酸和185位酪氨酸均发生磷酸化为该激酶活化所必须[4]。活化的ERK1/2信号传导途径作用于多种转录因子及核蛋白,促进某些基因的转录与表达,参与肿瘤细胞增殖、分化、迁移、侵袭和凋亡等多种生物学效应,ERK1/2的过度表达在细胞恶性转化及演进中起着重要的作用。因此研究ERK1/2 MAPK通路在食管鳞癌Eca109细胞体外增殖和迁移中的作用及其作用机制,有望为食管鳞癌的早期诊断、早期防预、早期治疗提供线索并且希望为联合治疗注入新的思路。
1 材料与方法
1.1 主要试剂
食管鳞癌细胞系Eca109 (中国科学院上海生命科学研究院细胞资源中心),胎牛血清(FBS)、DMEM培养基(Gibco公司),U0126(Promega公司),用234 μL二甲基亚砜(DMSO)重悬1 mg U0126,即可得到浓度为10 mmol/L的储存液,无抗无血清DMEM培养液稀释U0126储存液成所需浓度工作液,顺铂(齐鲁药业有限公司),Trizol、WesternBreeze 免疫检测试剂盒(Invitrogen公司),DMSO、methylthiazolyl blue tetrazolium(MTT)(Sigma公司),PrimeScriptTMone step RT-PCR kit反转录试剂盒、SYBR Premix(大连宝生物公司), RIPA裂解液、BCA蛋白定量试剂盒(博迈德公司),ERK1/2抗体(Celling Signaling Technology 公司), β-tubulin抗体(Santa Cruz Biotechnology公司),RT-PCR引物由TaKaRa公司设计并合成,引物序列见表1。

表1 qRT-PCR引物序列Table 1 Primer sequence for qRT-PCR
1.2 方法
1.2.1 细胞培养和U0126干预: Eca109细胞分为4个组,分别是对照组(NC)、DMSO组、U0126组和抗肿瘤药物顺铂组(DDP)。5×105个/孔接种6孔板,含有5%胎牛血清的DMEM培养液,37 ℃、5% CO2的培养箱内孵育,正常培养24 h达到80%汇合,用磷酸缓冲液(PBS)洗去悬浮细胞,20 μmol/L浓度的MAPK(ERK1/2)抑制剂U0126干预Eca109细胞。
1.2.2 细胞计数:在显微镜下用10×物镜观察计数四角大分格中的细胞数, 细胞数/mL=(4大格细胞数之和/4)×104×稀释倍数,每组设6个复孔。
1.2.3 倒置显微镜下观察细胞形态:倒置显微镜下放大200倍观察各组细胞0、24、48和72 h细胞形态学变化并采集图像,每组设6个复孔。
1.2.4 qRT-PCR扩增:Trizol方法抽提细胞中的总RNA,反转录试剂盒将RNA反转录为cDNA。qRT-PCR反应体系为20 μL,模板2 μL(2 μg),β-actin、ERK1/2的上、下游引物(表1)各0.5 μL(10 pmol),SYBR 10 μL、 ddH2O 7 μL,扩增条件:95 ℃预变性3 min;95 ℃变性5 s,57.8 ℃退火30 s,40个循环。分别以miR-21和U6反转录引物行反转录反应,miR-21和U6的特异性引物(表1)进行qRT-PCR,反应参数为95 ℃预变性10 min;95℃变性15 s,60 ℃退火30 s,40个循环,每组设6个复孔。
1.2.5 Western blot:1×106个细胞加入RIPA裂解液80 μL,12 000r/min离心5 min,收集上清,BCA法测定蛋白质浓度。取50 μg蛋白质于10%十二烷基磺酸钠(SDS)聚丙烯酰胺凝胶中,25 mA/胶恒定电流电泳至分离胶底端;80 V恒定电压、常温、100 min转至PVDF膜上,封闭1 h。加入β-tubulin、t-ERK1/2、p-ERK抗体(1∶1 000稀释于一抗稀释液中)于4 ℃过夜。加入通用性二抗,室温反应2 h,显色试剂作用直至条带出现,ddH2O终止显色反应。信号条带利用Quantity one软件进行灰度扫描,每组实验重复6次。
1.2.6 MTT检测细胞增殖:5×104个/孔接种于96孔培养板中,标准条件下培养过夜,更换培养液。分别于U0126处理后0、24、48、72和96 h加入5 g/L MTT,20 μL/孔, 37 ℃培养4 h。去上清加入150 μL DMSO, 37 ℃避光摇动10 min,ELISA读板机(490 nm)测定吸光度,每组均设置6个复孔。
1.2.7 细胞划痕实验:用无菌枪头对孔内细胞做划痕,PBS冲洗细胞,正常培养。0、24、48和72 h通过倒置显微镜观察细胞划痕并采集图像,用刻度尺测量划痕宽度,评估伤口愈合程度。
1.3 统计学分析
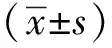
2 结果
2.1 不同浓度U0126对Eca109细胞增殖的影响
U0126对Eca109细胞增殖的抑制具有浓度依赖性,20 μmol/L浓度的U0126可明显抑制细胞增殖,并且抑制效果温和(Plt;0.05)(图1),能够达到研究的要求,故后续研究都采用20 μmol/L浓度的U0126干预细胞。
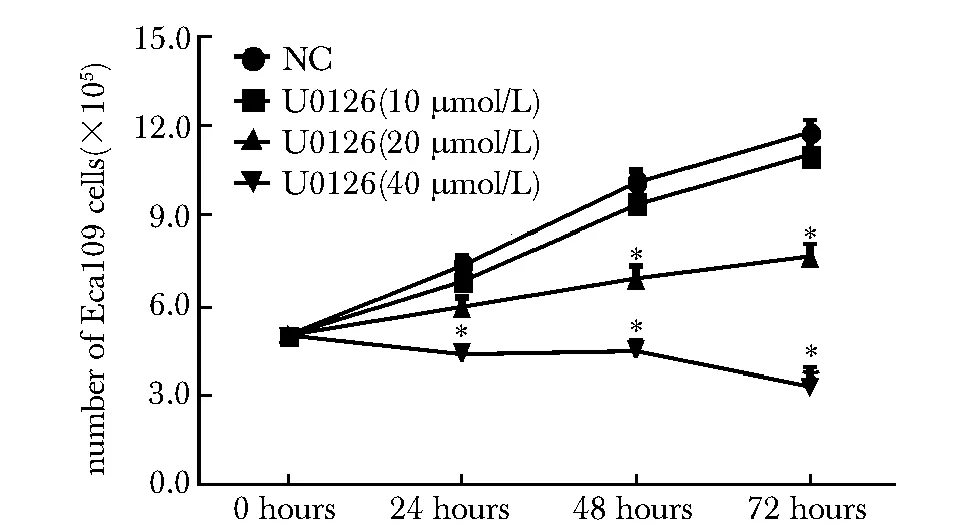
*Plt;0.05 compared with NC group图1 不同浓度U0126对Eca109细胞增殖的影响Fig 1 The effect of different concentration of U0126 on the proliferation of Eca109 cell line
2.2 U0126对Eca109细胞形态的影响
20 μmol/L浓度的U0126显著改变Eca109细胞的形态结构。与NC和DMSO组相比,U0126组细胞变得比较小,呈梭状或叠瓦样,多边形,轮廓不清,胞膜多棱角,核及核仁不清,胞质内粗糙,可见多量粉尘样细胞器堆积物,细胞易老化,汇合后排列不够紧密,铺路石样外观不典型,相互接壤处模糊,上皮膜边缘不整齐(图2)。
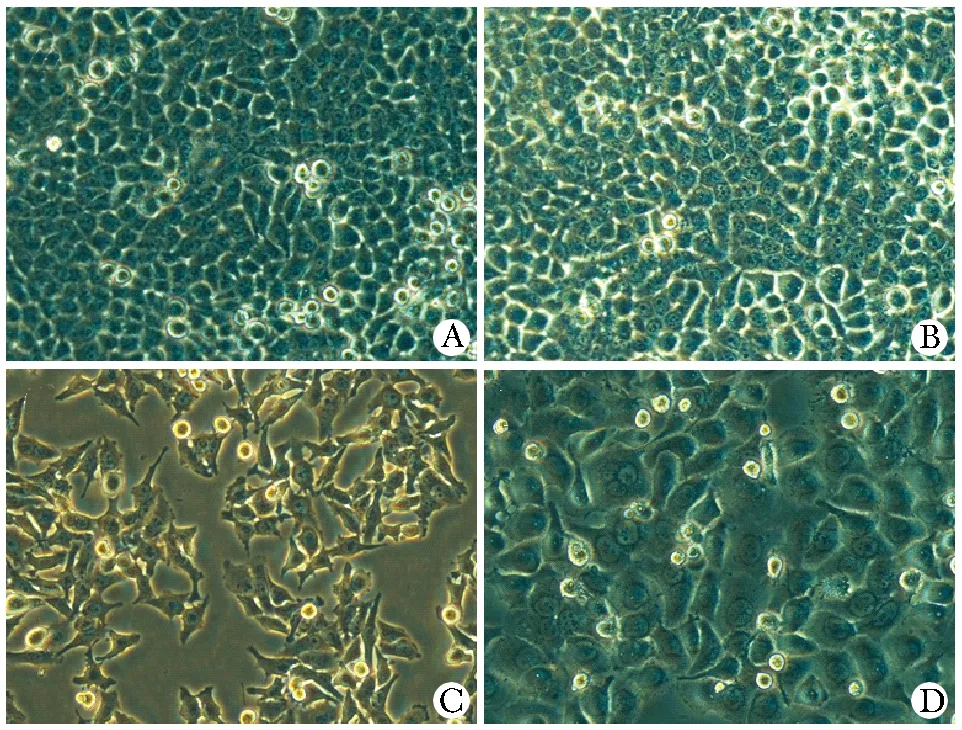
A.NC group;B.DMSO group;C.U0126 group;D.DDP group图2 U0126干预后Eca109细胞形态Fig 2 Cell morphology in Eca109 cell line after dealed with U0126(×200)
2.3U0126对Eca109细胞中ERK1/2MAPK通路的影响
Eca109细胞经浓度为20 μmol/L的U0126处理48和72 h后,与NC组和DMSO组相比,U0126组和DDP组中ERK1/2 mRNA表达无明显变化(图3),U0126组和DDP组中t-ERK1/2蛋白表达无变化,而U0126组中p-ERK1/2表达明显抑制 (Plt;0.05)(图4)。
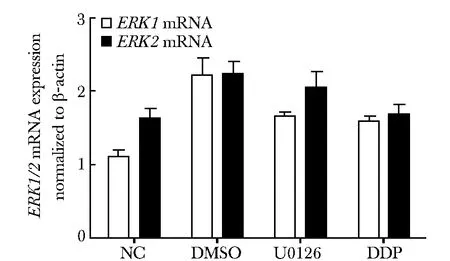
图3 U0126对ERK1/2 mRNA表达的影响Fig 3 The effect of U0126 on ERK1/2 mRNA
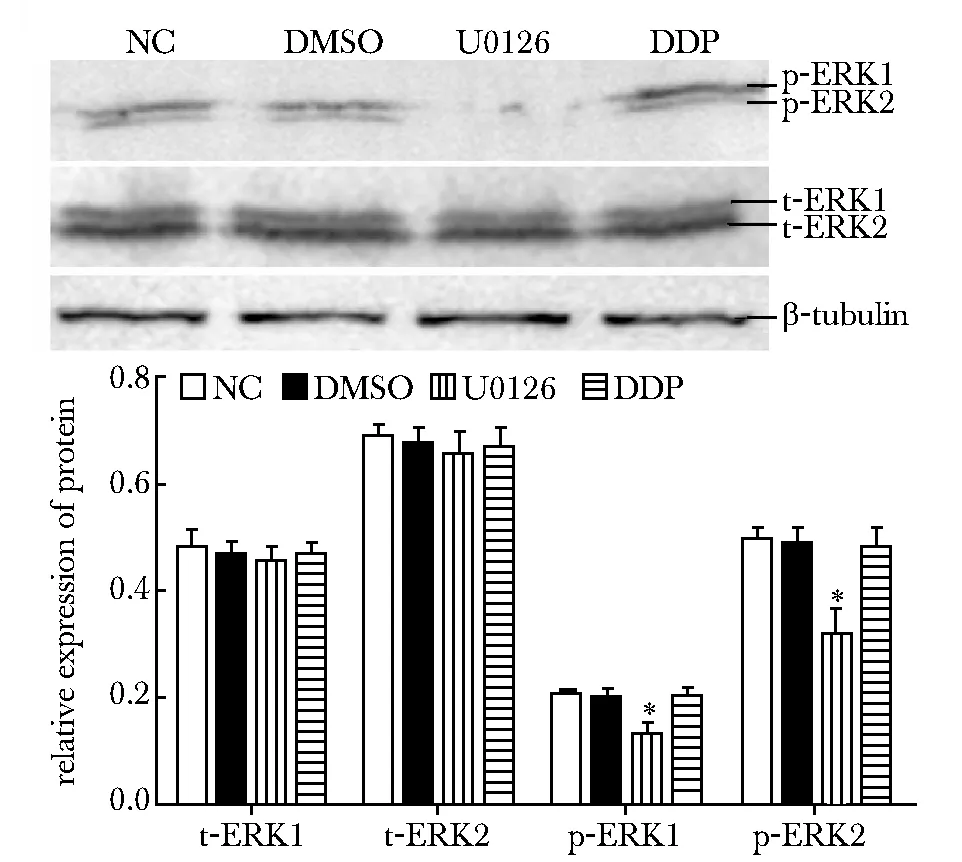
*Plt;0.05 compared with NC and DMSO group图4 U0126干预后Eca109细胞中ERK1/2蛋白表达Fig 4 The effect of U0126 on ERK1/2 protein expression in Eca109 cell line
2.4ERK1/2MAPK通路对Eca109细胞增殖的影响
食管癌Eca109细胞经浓度为20 μmol/L的U0126处理0、24、48、72和96 h后,与NC和DMSO组相比,U0126和DDP组中细胞增殖明显被抑制(Plt;0.05),与抗肿瘤药物DDP组相比,U0126组细胞增殖变化差异不显著(图5)。
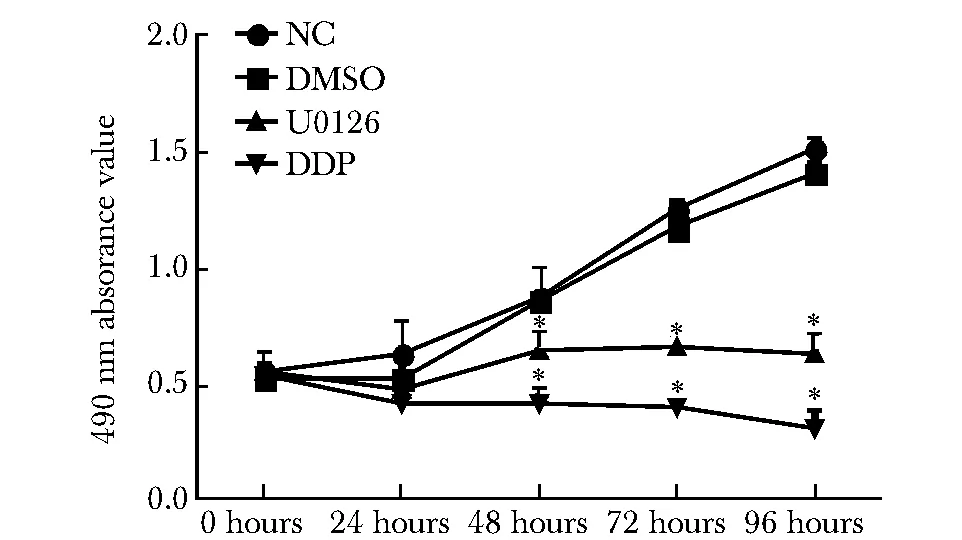
*Plt;0.05 compared with NC and DMSO group图5 U0126干预后Eca109细胞增殖Fig 5 The porliferation of Eca109 cell after dealed with U0126
2.5ERK1/2MAPK通路对Eca109细胞迁移的影响
食管癌Eca109细胞经浓度为20 μmol/L的U0126处理0、24、48 和72 h后, 与NC和DMSO组相比,U0126和DDP组中细胞迁移明显被抑制(Plt;0.05),与抗肿瘤药物DDP组相比,U0126组细胞增殖变化差异不显著(图6)。
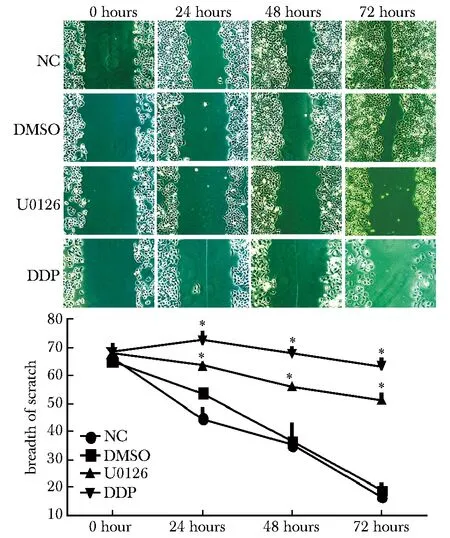
*Plt;0.05 compared with NC and DMSO group图6 细胞划痕实验检测U0126干预后Eca109细胞迁移Fig 6 Wound scratch assay detected the migration of Eca109 cell after dealed with U0126
2.6ERK1/2MAPK通路对Eca109细胞中miR-21表达的影响
食管癌Eca109细胞经浓度为20 μmol/L的U0126处理48 h后, 与NC组和DMSO组相比,U0126组中miR-21表达明显下调(Plt;0.05)(图7)。
3 讨论
ERK1/2 MAPK通路阻断可抑制胃癌、乳腺癌等细胞凋亡、促进细胞侵袭,并且抑制miR-21及其靶基因表达[5-7]。MiR-21是microRNA家族中的一个亚型,在大多数恶性肿瘤中,如胃癌[8]、结直肠癌[9]、胰腺癌[10]等细胞或组织中,miR-21的表达均显著升高。本研究发现20 μmol/L浓度的U0126在蛋白质水平明显阻断Eca109细胞中ERK1/2 MAPK通路活化,并且使其失去正常细胞形态结构。ERK1/2 MAPK通路活化被阻断后,Eca109细胞增殖和迁移明显被抑制,细胞中miR-21表达显著下调,这些结果表明ERK1/2 MAPK通路阻断可抑制Eca109细胞增殖和迁移,其可能的机制之一是ERK1/2 MAPK信号通路正调控具有癌基因作用的miR-21表达。本研究进一步揭示ERK1/2在食管鳞癌中发挥癌基因的作用,为解决食管鳞癌癌增殖和迁移问题提供一定的理论依据,也将会为临床上食管鳞癌的治疗及预后判断提供新的思路和方法。
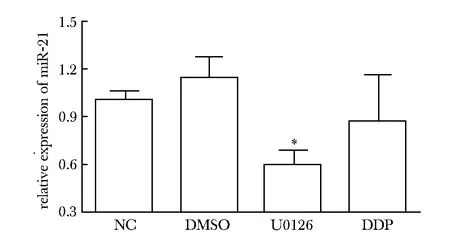
*Plt;0.05 compared with NC and DMSO group图7 U0126干预后Eca109细胞中miR-21表达下调Fig 7 U0126 downregulated the miR-21 expresson in Eca109 cell line(±s,n=6)
[1] Parkin DM, Bray F, Ferlay J,etal. Estimating the world cancer burden:Globocan 2000 [J]. Int J Cancer, 2001, 94:153-156.
[2] Ekman S, Dreilich M, Lennartsson J,etal. Esopha-geal cancer: current and emerging therapy modalities [J]. Expert Rev Anticancer Ther, 2008,8:1433-48.
[3] González Ortiz DI, Toro DH. Esophageal cancer subtypes and survival rates at the VA Caribbean Healthcare System: a 10-year experience[J]. Bol Asoc Med P R, 2009,101:14-17.
[4] Whitmarsh AJ,Davis RJ.Transcription factor AP-1 regulation bymitogen-activated protien kinase signal transduction pathway[J]. Mol Med,1996,74: 589-607.
[5] Lim SC, Duong HQ, Parajuli KR,etal. Pro-apoptotic role of the MEK/ERK pathway in ursode-oxycholic acid-induced apoptosis in SNU601 gastric cancer cells[J]. Oncol Rep, 2012, 28: 1429-34.
[6] Ling M, Li Y, Xu Y,etal. Regulation of miRNA-21 by reactive oxygen species-activated ERK/NF-κB in arsenite-induced cell transformation[J]. Free Radic Biol Med, 2012, 52: 1508-1518.
[7] Huang TH, Wu F, Loeb GB,etal. Up-regulation of miR-21 by HER2/neu signaling promotes cell invasion[J]. J Biol Chem, 2009,284: 18515-18524.
[8] Yamanaka S, Olaru AV, An F,etal. MicroRNA-21 inhibits Serpini1, a gene with novel tumour suppressive effects in gastric cancer[J]. Dig Liver Dis, 2012,44:589-596.
[9] Faltejskova P, Besse A, Sevcikova S,etal. Clinical correlations of miR-21 expression in colorectal cancer patients and effects of its inhibition on DLD1 colon cancer cells[J]. Int J Colorectal Dis, 2012, 27: 1401-1408.
[10] Moriyama T, Ohuchida K, Mizumoto K,etal. MicroRNA-21 modulates biological functions of pancreatic cancer cells including their proliferation, invasion, and chemoresistance[J]. Mol Cancer Ther, 2009, 8:1067-1074.
The role and mechanism of ERK1/2 MPAK
pathway in proliferation and migration of Eca109 cell lineinvitro
LIU Feng-xia1, NIU Shu-liang1, LI Jian-yong1, ZHENG Shu-tao2, LU Xiao-mei2, LIU Wen-ya3*
(1.Dept. of Anatomy, College of Basic Medicine;2.Medical Research Center, the First Affiliated Hospital;3.Dept. of Radiology,the First Affiliated Hospital,Xinjiang Medical University, Urumqi 830011,China)
ObjectiveTo investigate the role and mechanism of ERK1/2 MPAK pathway in regulating proliferation and migration of Eca109 cell lineinvitro.MethodsWe treated Eca109 cells with MAPK(ERK1/2)inhibitor(U0126); cell counting method detected the cell proliferation; Cell morphology was observed under inverted microscope;qRT-PCR detectedERK1/2 mRNA level; Western blot determined the expression of ERK1/2 protein level; MTT and Wound scratch assay detected cell proliferation and migration; qRT-PCR examined miR-21 expression.ResultsCell growth was inhibited by U0126 at 20 μmol/L doses(Plt;0.05), destroyed the normal cell morphology; inactivited ERK1/2 MPAK pathway at protein level(Plt;0.05); inhibition of ERK1/2 MPAK pathway repressed cell proliferation and migration of Eca109 cells and downregulated the expression ofmiR-21(Plt;0.05).ConclusionsInhibition of ERK1/2 MPAK pathway inhibits proliferation and migration of Eca109 cells, one of the most possible mechanism is associated it’s effect onmiR-21 expression.
ERK1/2; Eca109 cell; proliferation; migration; MicroRNA-21
2013-06-15
2013-10-09
新疆自治区科技厅面上项目(2012211A080)
*通信作者(correspondingauthor): wenyaliu2002@163.com.cn
1001-6325(2014)03-0345-05
研究论文
R 735.1
A

