CCN5对肝癌细胞系HepG2增殖、迁移和侵袭能力的影响及其作用机制
李海军,孟宪飞,董志意,刘亚峰
(榆林市第一医院 普通外科,陕西 榆林 719000)
CCN5对肝癌细胞系HepG2增殖、迁移和侵袭能力的影响及其作用机制
李海军*,孟宪飞,董志意,刘亚峰
(榆林市第一医院 普通外科,陕西 榆林 719000)
目的研究CCN5过表达对人肝癌细胞增殖、迁移和侵袭能力的影响及其作用机制。方法以人HepG2细胞为研究对象,构建CCN5过表达载体,转染人HepG2细胞,使CCN5在人HepG2细胞中过表达,分别采用细胞增殖检测试剂盒、Transwell小室法观察其对HepG2细胞增殖、迁移及侵袭能力的影响;采用Western blot检测Smad2及p44/42MAPK磷酸化水平。结果CCN5成功在人HepG2细胞中过表达,较对照组、CCN5过表达组,细胞增殖、迁移及侵袭能力相比受到明显抑制(Plt;0.05);Smad2及phospho-p44/42磷酸化水平也受到明显抑制。结论CCN5过表达可抑制人肝癌的形成。
CCN5;肝癌细胞;增殖;迁移;侵袭
肝癌(hepatocellular carcinoma, HCC)具有恶性程度高,易复发、转移、预后差等特点,是最为常见、恶性程度及死亡率最高的肿瘤之一,占全世界所有癌症的6%,是全球第3大致死癌症[1]。近年来,尽管肝癌的诊治取得了较大进展,但关于肝癌细胞的增殖、侵袭机制至今尚未完全阐明,肝癌手术切除后的复发转移是影响疗效的主要原因之一。因此,肝癌细胞增殖、侵袭转移这一领域的实验研究不仅有重要的理论意义,而且有重要的应用价值。
CCN5又称WISP-2,CCN家族的重要成员,在生长因子调控的细胞增殖中具有重要作用。CCN5已经被证实与癌症的形成,特别是乳腺癌的形成具有密切的关系[2],CCN5在人乳腺癌细胞中的表达量与正常乳腺细胞相比具有差异性[3],CCN5主要可以在非侵袭性乳腺癌细胞和非侵袭性病变区检测到,而在侵袭性区域表达量逐渐降低,甚至检测不到,表现出CCN5具有抑癌作用[4]。结合本实验室的前期研究基础,推测CCN5可能在肝癌的发生中也起到类似的作用。
本研究以人肝癌细胞系HepG2细胞为模型,采用脂质转染法研究CCN5过表达对HepG2细胞增殖、迁移和侵袭能力的影响及其作用机制,以期为肝癌的预防提供新的方向。
1材料与方法
1.1 材料
1.1.1 细胞:人肝癌细胞系HepG2(中科院上海细胞所),由本实验室保存。
1.1.2 主要试剂:ECL发光试剂盒、RIPA总蛋白提取试剂盒和BCA蛋白测定试剂盒(碧云天生物技术研究所);山羊抗人β-actin单克隆抗体、鼠抗人Smad2多克隆抗体、兔抗人phospho-Smad2单克隆抗体、鼠抗人CCN5单克隆抗体、HRP-标记的驴抗山羊二抗、HRP标记山羊抗兔二抗和HRP标记兔抗鼠二抗(Abcam公司);兔抗人phospho-p44/42 MAPK单克隆抗体(Pllabs公司);小鼠抗人MAPK单克隆抗体(SouthernBiotech公司);RNAiso plus kit、PrimeScript® RT reagent kit、SYBR® Premix Ex TaqTMⅡ kit (Takara公司);细胞增殖检测试剂盒:CellTiter 96® AQueous One Solution Cell Proliferation Assay 试剂盒(Promega公司)。
1.2 方法
1.2.1 引物设计:用于RT-PCR的引物序列:CCN5-P1(上游引物:5-CACCAACTTTCTGCCCTTGT-3, 下游引物:5-ATCTCCAGTTGGCAGAATCG-3), β-actin(上游引物:5-ACCACAGCTGAGAGGGAAATCG-3,下游引物:5-AGAGGTCTTTACGGATGTCAACG-3);用于基因克隆的引物序列:CCN5-P2(上游引物:5-AAAGACTCACAGGTCCGCC-3,下游引物:5-GGACC ATCTTCCATCAGCC-3);用于蛋白表达的引物序列:CCN5-P3(上游引物:5-GCGGATCCATGAGAGGCAC ACCGAAGACCC-3,含BamHⅠ酶切位点, 下游引物: 5-GCGGAATTCCTAGAAGGCACTGTTTTGTGGA CTGC-3含ECoRⅠ酶切位点)。
1.2.2 表达载体的构建:扩增CCN5目的片段(以CCN5-P2为引物),16 ℃条件下,与pMD19-T载体进行连接反应,并将连接产物转化于感受态大肠杆菌DH5α,培养后对其进行筛选,挑选阳性菌落摇菌并提取质粒,电泳鉴定后获得重组质粒pMD19T-CCN5。以重组质粒为模板,扩增CCN5编码区序列(以CCN5-P3为引物),应用BamHⅠ、EcoRⅠ对扩增产物进行双酶切,并用T4 DNA连接酶将其与真核表达载体pcDNA3.1(+)连接,获得重组表达载体pcDNA3.1(+)-CCN5。
1.2.3 重组质粒转染HepG2细胞:细胞转染按照Lipofectamine 2000试剂盒说明书进行,实验分为两组CCN5过表达组,简称转染组;及空载体转染组。24 h后采用RT-PCR及Western blot检测各组的转染效率。
1.2.4 细胞增殖实验:依照CellTiter 96® AQueous One Solution Cell Proliferation Assay Kit试剂盒操作说明,对细胞存活率进行测定。
1.2.5 Real-time PCR:采用RNAiso plus kit试剂盒提取HepG2细胞中的总RNA,按照试剂盒要求操作。按实验室常规方法进行PCR扩增。定量PCR采用的体系为:dNTPs 2 μL,10×缓冲液5 μL,上下游引物各10 pmol,Pfu酶0.5 μL,模板2 μL,加三蒸水至总体积50 μL;扩增条件为:预变性94 ℃ 5 min,进入循环,变性94 ℃ 1 min,退火60 ℃ 1 min,延伸72 ℃ 3 min,30个循环后,72 ℃延伸5 min。以β-actin为内参,依据2-ΔΔCT法[5]计算各组细胞mRNA的相对表达量。
1.2.6 Western blot:应用RIPA总蛋白提取试剂盒提取各组HepG2细胞总蛋白,BCA蛋白定量试剂盒测定蛋白浓度,采用12% SDS聚丙烯酰胺凝胶电泳进行蛋白分离,采用半干法将蛋白转移到PVDF膜上,转膜90 min后,将膜取出,放入5%脱脂奶粉中,37 ℃封闭1 h,再将膜放入稀释好的一抗工作液中(工作浓度1∶200)4 ℃孵育过夜,洗膜后放入HRP标记的相应二抗(1∶2000)中37 ℃孵育1 h。 洗膜后采用ECL化学发光试剂盒显色。以β-actin作为内参。
1.2.7 细胞迁移检测:Transwell小室实验检测细胞迁移:取CCN5过表达HepG2细胞制备细胞悬液,调整细胞浓度至2.5×104个/mL,接种至96孔板上,每孔200 μL。培养24 h后,用0.25%胰蛋白酶消化细胞,并用1%牛血清培养基洗涤细胞2次,制备细胞悬液,调整细胞浓度为5×105个/mL,取200 μL细胞悬液接种于Transwell上室中,并在下室中加入培养基,24 h后倒置Transwell小室,滤膜下表面朝上,自然风干,结晶紫染色,分析CCN5过表达对HepG2细胞迁移的影响。以空载体组及未转染组作为空白对照。
1.2.8 细胞侵袭能力测定:将CCN5过表达的人肝癌细胞HepG2细胞消化成单细胞悬液,无血清培养基洗3次,将细胞悬液浓度调整成2×105个/mL备用。预先将Matrigel(提前12 h)用无血清培养基DMEM稀释成1∶3浓度,均匀地铺满Transwell小室上室的聚碳酸酯膜,室温放置1 h,使Matrigel凝固形成基质膜。Transwell下腔室加入700 μL含10%胎牛血清的DMEM培养基,小室内接种200 μL无血清细胞悬液,培养18 h后取出Transwell膜,预冷的PBS洗涤2次,4%多聚甲醛固定15 min,0.1%结晶紫染色5~10 min,显微镜下拍照,统计穿过Transwell膜的细胞数[6]。实验重复3次。空载体组及未转染组作对照。
1.3 统计学分析
采用SPSS 16.0软件进行数据分析,数值均采用(均数±标准差)表示,采用t检验进行显著性分析。
2 结果
2.1 CCN5转染效率测定
与正常对照组相比,转染组CCN5 mRNA及蛋白表达水平显著上升(Plt;0.05)(图 1)。

*Plt;0.05 versus control group图1 转染后CCN5表达变化情况Fig 1 CCN5 mRNA and protein level after transfection
2.2 CCN5过表达对HepG2细胞增殖影响
CCN5过表达组细胞增殖率显著低于对照组,为86.5%(Plt;0.05)(图 2)。

*Plt;0.05 versus control group图2 转染对HepG2细胞增殖率的影响Fig 2 Effect of transfection on HepG2 proliferation
2.3 CCN5过表达对HepG2细胞迁移影响
培养24 h后,对照组跨膜数为72±7显著高于CCN5过表达组的56±6(Plt;0.05)。
2.4 CCN5过表达HepG2细胞侵袭影响
对照组细胞侵袭个数为78±6显著高于CCN5过表达组的35±4,(Plt;0.05)。
2.5 CCN5过表达对Smad2磷酸化水平影响
CCN5过表达后,HepG2中Smad2蛋白的表达没有显著变化,而Smad2磷酸化水平显著下降(Plt;0.05)(表1,图3)。
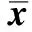
表1 对照组、空载体组及CCN5过表达组在HepG2中p-Smad2、p-p44/42MAPK表达Table 1 Expression of p-Smad2 and p-p44/42MAPK in HepG2 for control, vector group and CCN5 overexpression group(±s, %, n=3)
*Plt;0.05 compared with control group.

图3 CCN5过表达对Smad2磷酸化水平影响Fig 3 Effect of CCN5 overexpression on p-Smad2
2.6 CCN5过表达对MAPK磷酸化水平影响
转染后,CCN5过表达组p44/42MAPK蛋白表达未被抑制,而p-p44/42MAPK蛋白表达则受到抑制(Plt;0.05)(表1,图4)。
3 讨论
肝癌患者死亡的主要原因是肿瘤细胞的增殖和侵袭,也是导致恶性肿瘤患者临床治疗预后差,易复发的主要原因[7]。肿瘤细胞的增殖和侵袭是癌基因与抑癌基因共同参与调节的复杂过程,可以通过肿瘤增殖、侵袭相关基因的过度表达或下调,以及一系列基因产物的共同作用,对肿瘤增殖、侵袭转移整个过程进行调控[8]。本实验中CCN5过表达后,HepG2细胞的增殖速率、迁移及侵袭明显下降,说明CCN5对调控肝癌细胞的增殖和侵袭起着重要的作用。

图4 CCN5过表达对Phospho-p44/42 MAPK磷酸化水平影响Fig 4 Effect of CCN5 overexpression on Phospho-p44/42 MAPK
Smad2是TGF-β通路的下游分子,被TGF-β受体Ⅱ磷酸化后,再与Smad3及Smad4结合,形成复合体,进入细胞质,和序列特异的DNA结合蛋白CRB/P300等结合,启动TGF-β信号通路,激活特定靶基因,介导细胞生长阻滞、凋亡等,TGF-β/Smad通路任何基因失活,均可导致生长失控,从而诱发肿瘤发生[9-10]。有研究者[11]应用免疫组化证实Smad2磷酸化可能与肝癌的恶化进程有关。本实验中,CCN5过表达后,P-Smad2表达量显著下降,进一步证实了肝癌形成与TGF-β/Smad通路的密切关系。
本实验中,CCN5过表达后,P44/42MAPK蛋白表达量未见变化,而p-p44/42MAPK的表达却受到抑制。在肝癌细胞系中,P44/42MAPK磷酸化具有促进肿瘤生长的作用[12]。在结肠癌和乳腺癌中,也发现了类似的情况。因此,推测CCN5过表达可抑制p-p44/42MAPK,进而抑制细胞增殖,其具体机制还有待于进一步研究。
[1] Hernandez-Gea V, Toffanin S, Friedman SL,etal. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma[J]. Gastroenterology, 2013, 144:512-527.
[2] Banerjee SK, Banerjee S. CCN5/WISP-2: A micromanager of breast cancer progression[J]. J Cell Commun Signal, 2012, 6:63-71.
[3] Saxena N, Banerjee S, Sengupta K,etal. Differential expression of WISP-1 and WISP-2 genes in normal and transformed human breast cell lines[J]. Mol Cell Biochem, 2001, 228:99-104.
[4] Banerjee S, Dhar G, Haque I,etal. CCN5/WISP-2 expression in breast adenocarcinoma is associated with less frequent progression of the disease and suppresses the invasive phenotypes of tumor cells[J]. Cancer Res, 2008, 68:7606-7612.
[5] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25:402-408.
[6] Choi ET, Engel L, Callow AD,etal. Inhibition of neointimal hyperplasia by blocking alpha V beta 3 integrin with a small peptide antagonist GpenGRGDSPCA[J]. Journal of vascular surgery: official publication, the Society for Vascular Surgery [and] International Society for Cardiovascular Surgery, North American Chapter, 1994, 19:125-134.
[7] Tsujimoto M, Aozasa K, Nakajima Y,etal. Hepatocellular carcinoma with sarcomatous proliferation showing an unusual and wide‐spread metastasis[J]. Pathol Int, 2011, 34:839-845.
[8] Kojiro M. Pathology of hepatocellular carcinoma[J]. Mol Gene Liver Neoplasia, 2011:37-48.
[9] 任韫卓, 段惠军, 史永红, 等. p-Smad2/3, Smad7在大鼠实验性肾间质纤维化模型中的表达[J]. 基础医学与临床, 2006, 26:871-876.
[10] 王柏春, 阎承慧, 李野, 等. 转化生长因子β1 抑制食管癌细胞的生长[J]. 基础医学与临床, 2004, 24:522-527.
[11] Wu SK, Wang BJ, Yang Y,etal. Expression of PTEN, PPM1A and P-Smad2 in hepatocellular carcinomas and adjacent liver tissues[J]. World J Gastroenterology, 2007, 13:4554-4559.
[12] Fujii H, Itoh Y, Yamaguchi K,etal. Chemokine CCL20 enhances the growth of HuH7 cells via phosphorylation of p44/42 MAPKinvitro[J]. Biochem Biophys Res Commun, 2004, 322:1052-1058.
Effect of CCN5 on proliferation, migration and invasion of hepatoma carcinoma cell line HepG2 and the mechanism
LI Hai-jun*, MENG Xian-fei, DONG Zhi-yi, LIU Ya-feng
(Dept. of General Surgery, the First Hospital of Yulin,Yulin 719000, China)
ObjectiveTo study the effect of CCN5 on proliferation, migration and invasionof hepatoma carcinoma cells and the mechanism.MethodsHepatocyte high expression system of CCN5 was constructed and transfected HepG2 cells to make CCN5 overexpression, and thencell proliferation detection reagent box and transwell chamber were used to determine the effect of CCN5 overexpression on proliferation, migration and invasion of HepG2. To further study the mechanism, phosphorylation levels of Smad2 and p44/42MAPK were determined.ResultsCCN5 was overexpressed in HepG2 cells. After that, the proliferation, migration and invasion of the CCN5 overexpression group were significantly inhibited (Plt;0.05) compared with the normal control group. Phosphorylation levels of Smad2 and p44/42MAPK were also significantly inhibited.ConclusionsOverexpression of CCN5 can inhibit proliferation, migration and invasion of HepG2.
CCN5; hepatoma carcinoma cell; proliferation; migration; invasion
2013-05-16
2013-09-24
*通信作者(correspondingauthor): lihaijun161@163.com
1001-6325(2014)03-0376-05
研究论文
R 34
A

