沉默PARG基因增强局部对结肠癌的免疫应答
王洁琼,李 戈
(泸州医学院 附属医院 1.细胞学教研室;2.泌尿外科,四川 泸州 646000)
沉默PARG基因增强局部对结肠癌的免疫应答
王洁琼1,李 戈2*
(泸州医学院 附属医院 1.细胞学教研室;2.泌尿外科,四川 泸州 646000)
目的探讨沉默结肠癌PARG基因后对肿瘤局部免疫状态的影响。方法以PARG-shRNA慢病毒载体转染CT26细胞为实验组,未转染CT26细胞和空载体转染CT26细胞为对照组,分别将各组细胞在BALB/C小鼠脾包膜下接种形成肝转移模型;Western blot法检测脾脏移植瘤中PARG蛋白的表达;免疫荧光双标法检测脾脏中B220+DEC205+DC和CD11c+CD11b+DC,用激光共聚焦显微镜观察上述细胞;免疫荧光单标记法检测脾脏中CD4+T细胞及CD8+T细胞,用激光共聚焦显微镜观察上述细胞;ELISA法检测各组小鼠血清中IL-10和IL-12的表达。结果PARG基因沉默后,脾脏移植瘤中PARG蛋白的表达量明显较对照组降低(Plt;0.05);脾脏组织中B220+DEC205+DC较对照组显著减少;而CD11c+CD11b+DC较对照组明显增多(Plt;0.05);脾脏组织中的CD4+T细胞及CD4+/CD8+比值较对照组明显升高(Plt;0.05);血清中IL-10的表达较对照组明显减少而IL-12的表达较对照组显著增多(Plt;0.05)。结论沉默结肠癌PARG基因可通过影响DC及T细胞的增殖分化,增强肿瘤局部的免疫反应。
PARG;细胞因子;免疫机能;大肠癌
肿瘤的发生发展是一个多基因改变的过程,同时,机体的免疫状态也与肿瘤的发生发展有着密切的关系。聚腺苷二磷酸核糖核苷水解酶(poly-ADP-ribose glycohydrolase, PARG)与炎性反应、缺血再灌注损伤、肿瘤等的发生发展都有着密切的关系。研究表明,在结肠癌中沉默PARG基因,可通过抑制肿瘤细胞的增殖、黏附、血管生成等抑制肿瘤的肝转移[1]。那么,在结肠癌中抑制PARG基因能否通过改变机体的免疫状态,从而进一步影响肿瘤的发展?基于此,本实验通过检测结肠癌PARG基因沉默后,脾脏组织中DC及T细胞的变化,探讨免疫状态的改变在结肠癌发生发展中的作用。
1 材料与方法
1.1 动物与主要试剂
SPF级BALB/C小鼠,雌性,6~8周龄,体质量18~20 g,由重庆医科大学实验动物中心提供(合格证号SCXK,渝20020001)。抗PARG抗体和抗DEC205抗体(Abcam公司)。抗CD11b抗体(Santa Cruz公司)。抗B220抗体、抗CD11c抗体、抗CD4抗体和抗CD8抗体(Bioss 公司)。IL-10和IL-12 ELISA试剂盒(BD公司)。
1.2 常规培养细胞
小鼠结肠癌 CT26细胞系(四川大学华西医院魏于全教授惠赠)。将PARG-shRNA慢病毒载体及慢病毒空载体(Sigma公司)转染结肠癌CT26细胞,并筛选获得稳定的转染慢病毒PARG-shRNA载体和空载体的CT26细胞系。各组CT26细胞常规培养备用。
1.3 组织的获取
分别在各组小鼠脾包膜下接种相应的CT26细胞建立肝转移动物模型,14 d后处死各组小鼠,取脾脏组织,液氮保存备用;同时取各组小鼠眼眶血,低温离心取上清,-80 ℃保存备用。
1.4 Western blot检测PARG蛋白的表达
将液氮中各组小鼠的脾脏肿瘤组织裂解、匀浆,并按蛋白提取试剂盒说明提取总蛋白,BCA法测定蛋白浓度。将蛋白经电泳后转移至PVDF膜上,抗PARG抗体(一抗)4 ℃过夜,相应的IgG(二抗)室温孵育2 h,ECL试剂盒化学发光显影。采用Bio-Rad凝胶成像仪拍摄图像, Quantity One软件进行相对定量分析。
1.5免疫荧光双标法检测B220+DEC205+DC及CD11c+CD11b+DC
将液氮中各组小鼠的脾脏组织进行连续冰冻切片,丙酮固定5 min,BSA 37 ℃孵育30 min,生物素标记抗小鼠DEC205单克隆抗体(1∶50,PBS稀释)和抗小鼠B220多克隆抗体(1∶100,PBS稀释)、抗小鼠CD11c和CD11b多克隆抗体(1∶50,PBS稀释)混合作为一抗,4 ℃孵育过夜,相应的PE 标记的抗生物素(streptavidin)(1∶50,PBS稀释)和FITC 标记的山羊抗兔IgG(1∶100,PBS稀释)、FITC 标记的小鼠抗兔IgG(1∶50,PBS稀释)和CY3标记的驴抗山羊IgG(1∶50,PBS稀释)混合作为二抗,避光于37 ℃孵育1 h,阴性对照组中以PBS代替一抗,常规封片后激光共聚焦显微镜观察并照相。
1.6免疫荧光单标法检测CD4+T细胞及CD8+T细胞
将液氮中各组小鼠的脾脏组织进行连续冰冻切片,丙酮固定5 min,BSA 37 ℃孵育30 min,抗小鼠CD4及CD8多克隆抗体(1∶50,PBS稀释)分别作为一抗,4 ℃孵育过夜,FITC 标记的山羊抗兔IgG(1∶50,PBS稀释)作为二抗,分别避光于37 ℃孵育1 h,常规封片后激光共聚焦显微镜观察并照相,阴性对照组中以PBS代替一抗。
1.7ELISA法检测各组小鼠血清中IL-10及IL-12的表达
按照ELISA法试剂盒说明书中的操作步骤,将保存于-80 ℃各组小鼠的血清分别进行检测,以观察各组小鼠血清中IL-10和IL-12的变化。测量A=450 nm(15 min内),绘制出标准曲线,并计算直线回归方程,最后根据样品的A值计算出相应样品的实际浓度(10-9g/L)。
1.8 统计学分析
2 结果
2.1PARG-shRNA慢病毒载体转染CT26细胞接种小鼠后脾脏移植瘤PARG的变化
PARG-shRNA慢病毒载体转染CT26细胞接种的小鼠脾脏移植瘤中,PARG蛋白的表达明显低于对照组(Plt;0.05) (图1,表1)。
2.2脾脏中B220+DEC205+DC数量的变化
PARG基因沉默组小鼠脾脏中B220+DEC205+DC的数量较对照组明显降低(Plt;0.05)(图2,表2)。
2.3脾脏中CD11c+CD11b+DC数量的变化
PARG基因沉默组小鼠脾脏中CD11c+CD11b+DC的数量较对照组显著增多(Plt;0.05)(图3,表2)。

1.untransfected group; 2.empty vector control group; 3.PARG-silenced group图1 各组小鼠脾脏移植瘤PARG蛋白表达Fig 1 Expression of PARG protein in spleen transplant carcinoma in different groups
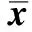
表1 各组小鼠脾脏移植瘤中PARG蛋白的表达Table 1 The expression of PARG protein in spleen trans- plant tumor of various groups (±s,n=6)
*Plt;0.05 compared with untransfected or empty vector control group.

A.untransfected group; B. empty vector control group; C. PARG-silenced group;1.DEC205+DC(PE); 2.B220+DC(FITC); 3.B220+DEC205+DC(PE,FITC)
图2各组小鼠脾脏中B220+DEC205+DC的表达
Fig2TheexpressionofB220+DEC205+DCinspleenindifferentgroups(×40)

A.untransfected group; B.empty vector control group; C.PARG-silenced group;1.CD11b+DC(CY3); 2.CD11c+DC(FITC); 3.CD11c+CD11b+DC(CY3,FITC)

图3 各组小鼠脾脏中CD11c+CD11b+DC的表达Fig 3 The expression of CD11c+CD11b+DC in spleen in different groups(×40)
*Plt;0.05 compared with untransfected or empty vector control group.
2.4脾脏中CD4+/CD8+T淋巴细胞比值的变化
在PARG基因沉默组中CD4+/CD8+的值明显较对照组增大(Plt;0.05)(图4,表3)。

表3 各组小鼠脾脏中CD4+/CD8+T淋巴细胞比值Table 3 The ratio of CD4/CD8 in spleen for various
*Plt;0.05 compared with untransfected or empty vector control group.
2.5PARG基因沉默对小鼠血清中IL-10及IL-12表达的影响
PARG基因沉默组中,IL-10的含量较未转染组和空载体组明显降低,差异具有统计学意义(Plt;0.05);而PARG基因沉默组中IL-12的含量明显较未转染组和空载体组增多(Plt;0.05)(表4)。

A.CD4+T(FITC); B.CD8+T(FITC); 1.untransfected group; 2.empty vector control group; 3.PARG-silenced group图4 脾脏中CD4+T淋巴细胞及CD8+T淋巴细胞Fig 4 CD4+T cell and CD8+T cell in spleen of various groups(×40)
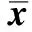
表4 各组小鼠血清中IL-10和IL-12的含量Table 4 The content of IL-10 and IL-12 in serum of various mice groups(±s,n=6)
*Plt;0.05 compared with untransfected or empty vector control group.
3 讨论
机体的免疫功能与肿瘤的发生、发展密切相关,细胞免疫作为肿瘤免疫的核心,T淋巴细胞在其中发挥着重要作用。CD4+T细胞与CD8+T细胞比例的稳态维持着机体正常的免疫应答。当其比值下降时,患者的免疫机能降低,导致肿瘤增殖[2]。有文献报道,大肠癌患者的CD4+T细胞比例显著减低,同时,CD4+/CD8+比值也明显降低;且随着TNM分期的增加,CD4+T细胞比例及CD4+/CD8+比值逐渐减少[3]。
树突状细胞(dendritic cell, DC)是目前已知功能最强大的抗原呈递细胞,主要包括髓样DC和浆样DC,其中髓样DC表型为CD11b+, CD11c+,促进CD4+T细胞向Th1分化;而浆样DC则主要表现为B220+,CD19-,促进CD4+T细胞向Th2或Tr分化[4-5]。文献报道,CD11c+CD11b+髓样细胞能够通过促进肿瘤细胞的凋亡发挥抗肿瘤作用[6];B220+DEC205+DC可通过调节淋巴细胞的增殖分化在肝脏移植免疫耐受中发挥作用[7]。也有报道称[8],小鼠肝脏中诱导出的B220+/DEC205+DC对大肠癌肝转移有促进作用。
IL-10作为重要的免疫调节和抗炎因子,不仅能调节DCs的分化和增殖,同时也能直接影响T细胞的功能[9]。IL-10最初被认为是诱导Th2反应的特异性细胞因子。后来证实,IL-10也与Tr反应密切相关[10]。而IL-12作为重要的抗癌因子,在腺瘤中的含量明显高于其在结肠癌中的含量,且IL-12能够抑制小鼠结肠癌的肝转移[11]。
PARG 是主要的PAR水解酶。研究表明,在人大肠癌lovo细胞中敲除PARG基因,可降低大肠癌lovo细胞的基质黏附、运动及侵袭能力,抑制lovo细胞的增殖及分化能力[12]。在小鼠结肠癌模型中沉默PARG基因,可通过抑制肿瘤细胞的增殖、黏附、血管生成等抑制肿瘤的肝转移[1]。那么,沉默PARG基因后,肿瘤局部的免疫状态是否改变及发生了何种改变呢?
本研究表明,在PARG基因沉默后,耐受性的B220+DEC205+DC显著减少而反应性的CD11c+CD11b+DC明显增多,且CD4+T细胞及CD4+/CD8+比值明显升高;血清中免疫抑制性因子IL-10的表达明显减少而抗肿瘤因子IL-12的表达显著增多。综上所述,在结肠癌中沉默PARG基因后,可引起肿瘤局部免疫状态的改变,促进Th1反应的增强,Th2及Tr反应的减弱,从而增强局部的免疫能力,进而抑制肿瘤的侵袭转移,其具体详尽机制有待进一步研究。
[1] 杨怡,王娅兰,王洁琼,等.PARG基因沉默对小鼠结肠癌CT26细胞肝转移的影响[J]。基础医学与临床,2012,32:54-57.
[2] Yasutomo K. The cellular and molecular mechanism of CD4/CD8 lineage commitment [J]. J Med Invest, 2002, 49: 1-6.
[3] 杨祖贻,罗洁,宋秀云,等. 肺癌、肝癌、大肠癌、乳腺癌患者免疫功能的临床研究[J]. 四川医学, 2005, 26: 754-755.
[4] Lonial S, Torre C, David E,etal. Regulation of alloimmune responses by dendritic cell subsets[J]. Exp Hematol, 2008, 36:1309-1317.
[5] Lu L, Bonham C A, Liang X,etal. Liver-derived DEC205+B220+CDl9-dendritic cells regulate T cell responses [J]. Immunol, 2001,166:7042-7052.
[6] Nirmala P, Elisabeth M-H, Gunther B,etal. Infiltrating CD11b+CD11c+cells have the potential to mediate inducible nitric oxide synthase-dependent cell death in mammary carcinomas of HER-2/neu transgenic mice[J]. International Journal of Cancer, 2010, 126:896-908.
[7] Wang YL, Zheng N, Lu ZB,etal. In vivo expansion of two distinct dendritic cells in mouse liver and its impact on liver immune regulation[J]. Liver Transplantation, 2006, 12:1850-1861.
[8] 柯奇周,王娅兰,于红. 小鼠肝B220+/DEC205+树突状细胞对结肠癌肝转移的影响[J]. 解剖学杂志, 2009, 32:724-727.
[9] Silvia C, Cristina A, Andrea lS,etal. Regulatory activity of autocrine IL-10 on dendritic cell functions[J]. Immunol, 2001, 166:4312-4318.
[10] Ng TH, Britton GJ, Hill EV,etal. Regulation of adaptive immunity; the role of interleukin-10 [J]. Frontiers In Immunological Tolerance, 2013,4:129-132.
[11] Shen F, Li JL, Cai WS,etal. Interleukin-12 prevents colorectal cancer liver metastases in mice [J]. Onco Targets and Therapy, 2013,6:523-526.
[12] Pan J, Fauzee NJ, Wang YL,etal. Effect of silencing PARG in human colon carcinoma Lovo cells on the ability of HUVEC migration and proliferation [J]. Cancer Gene Therapy, 2012,19:715-722.
SilencingPARGenhances local immune response to colon carcinoma
WANG Jie-qiong1, LI Ge2*
(1.Dept. of Cytology; 2.Dept. of Urologic Surgery, Luzhou Medical College, Luzhou 646000, China)
ObjectiveTo investigate the effect of silencingPARGon local immune status in colon carcinoma.MethodsLentivirus PARG-shRNA(Short hairpin RNA) was transfected into CT26 cells as experiment group, the CT26 cells without any treatment or treated with Lentivirus empty vector served as control group. Animal models for liver metastases of colon carcinoma were established by splenic subcapsular inoculation of each group of CT26 cells in Balb/c mice. The expression of PARG protein in spleen transplant tumor was detected by Western blot analysis. Immunofluorescence double labeling assay was used for the numbers detection both of B220+DEC205+DC and CD11c+CD11b+DC in the spleen. CD4+T cells and CD8+T cells in the spleen were tested by immunofluorescence single staining. All of these cells were observed by confocal laser scanning microscope. The levels of IL-10 and IL-12 in serum were measured by enzyme-linked immunosorbent assay (ELISA).ResultsThe expression of PARG in spleen transplant tumor was reduced in PARG-silenced group compared to that in control groups(Plt;0.05). In PARG-silenced group, the amounts of B220+DEC205+DC were less and the numbers of CD11c+CD11b+DC were more in spleen than that in control groups(Plt;0.05). The numbers of CD4+T cells and the ratio of CD4+/ CD8+in spleen of PARG-silenced group were increased compared to that in control groups(Plt;0.05). The serum levels of IL-10 were lower but the serum content of IL-12 were higher in PARG-silenced group than that in control groups(Plt;0.05).ConclusionsSilencingPARGcould strengthen the local immune response to colon cancer by effect on the proliferation and differentiation of DC and T cells.
PARG; cytokine; immune function; colon carcinoma
2013-08-14
2013-11-21
*通信作者(correspondingauthor): wangjq1048@sina.com
1001-6325(2014)03-0391-06
研究论文
R735.3+4
A

