复方鸦胆子油软胶囊质量标准及初步药效学研究
王 娉 ,王 坚 ,黄绳武
(1.浙江中医药大学,浙江杭州 310053; 2.浙江大学医学院附属儿童医院,浙江杭州 310003)
复方鸦胆子油软胶囊主要由鸦胆子油和蟾皮超微粉两味药组成,鸦胆子油是从苦木科植物鸦胆的干燥成熟果实中提取得到的脂肪油,具有清热解毒[1]、抗疟、抗炎和抗肿瘤的作用[2-4],是一种疗效确切、毒副作用小的抗肿瘤药物[5],可用于治疗肺癌、肺癌脑转移、肝癌、胃癌[6]和乳腺癌等多种恶性肿瘤,临床上与化疗药合用可提高疗效,毒副反应少,很少出现恶心、呕吐、厌食、脱发、血细胞计数下降和骨髓抑制等常规化疗药的毒副反应[7-8]。蟾皮具有清热解毒、利水消肿的功能,用于治疗咽喉肿痛、肿瘤等[9]。化学成分研究表明,华蟾酥毒基和脂蟾毒配基是蟾皮中抗肿瘤活性成分。本试验采用薄层色谱(TLC)法定性鉴别鸦胆子油和蟾皮微粉,并采用气相色谱(GC)法测定复方鸦胆子油软胶囊中油酸含量,高效液相色谱法(HPLC)测定华蟾酥毒基和脂蟾毒配基的总含量,制备S180腹水型肿瘤小鼠模型,考察其对肿瘤的药效作用。
1 材料与方法
1.1 实验材料
1.1.1 实验仪器 SP-Ⅲ型条带电动点样器,Goodsee-Ⅰ型薄层色谱摄影仪,GC-14A气相色谱仪,CP225D准微量电子分析天平,METTLER TOLEDO电子天平,高效液相色谱仪,LC2130输液泵(配梯度洗脱和在线洗脱装置),LC2030紫外检测器,手动进样器,色谱工作站,T2000P OLYMPUS-CKX41倒置万能显微镜,AB104-N电子分析天平,BILON电热恒温水浴箱,TGLA-16高速离心机。
1.1.2 药物与试剂 油酸对照品(111621-201004)、亚油酸(111622-20101004)、华蟾酥毒基对照品(10803-200605)、脂蟾毒配基对照品(110718-200507)均由中国生物制品检定所提供;乙酸乙酯,三氯甲烷,丙酮,环己烷,复方鸦胆子油软胶囊(自制,批号20121113、20121103、20121027),复方鸦胆子油软胶囊(自制,20121123),环磷酰胺冻干粉针剂,生理盐水,台盼蓝。小鼠S180腹水型肿瘤细胞(由浙江省医科院提供)。
1.1.3 实验动物 ICR小鼠100只[SPF级,雌雄各半,4w~6w,体重(20±2)g,浙江中医药大学实验动物中心提供]。
1.2 方法与结果
1.2.1 薄层方法研究
1.2.1.1 薄层色谱条件 油酸薄层条件:硅胶板GF254,以105℃活化30min,取出备用;展开剂为石油醚-乙酸乙酯-冰醋酸(8.5∶1.5∶0.1),预饱和 30min,置展开缸内展开。挥去溶媒,碘蒸汽熏蒸显色,紫外灯下观察。蟾皮薄层条件:硅胶板GF254,以105℃活化30min,取出备用;展开剂为环己烷-三氯甲烷-丙酮(4∶3∶3),展开,取出,晾干,喷以 10%硫酸乙醇溶液,加热至斑点显色清晰。
1.2.1.2 对照品溶液配制 称取鸦胆子油0.051g,加正己烷1.0mL溶解,制备鸦胆子油对照溶液备用;称取油酸对照品0.011g,加正己烷1.0mL溶解,制备油酸对照溶液备用;分别称取华蟾酥毒基对照品1.4mg、脂蟾毒配基对照品1.4mg,置10mL容量瓶中,加甲醇定容,制备华蟾酥毒基和脂蟾毒配基混合对照溶液备用。
1.2.1.3 供试品溶液配制 取3批制剂各4粒,剖开取内容物,加正己烷10mL,超声5min,过膜,制备供试品溶液1备用。取3批制剂各10粒,剖开取内容物,加甲醇20mL,加热回流60min,过滤,滤液过膜,摇匀制备供试品溶液2备用。
1.2.1.4 样品测定 依法对样品进行鉴别,鸦胆子油薄层色谱结果显示:供试品色谱中在与鸦胆子油对照液、油酸对照溶液相应位置上显相同暗黑色斑点,阴性无干扰。蟾皮薄层色谱结果显示:供试品色谱中在与对照品色谱相应的位置上,显相同的一个绿色及一个蓝色斑点,阴性无干扰。结果见图1、图2。
1.2.2 GC测定复方鸦胆子油软胶囊中油酸含量
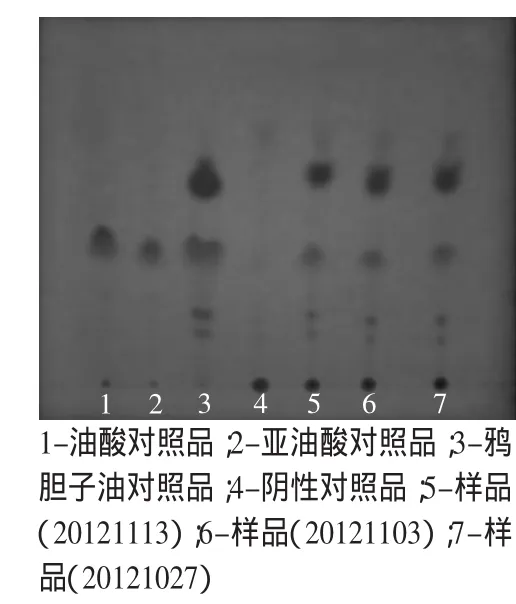
图1 复方鸦胆子油软胶囊油酸薄层鉴别结果

图2 复方鸦胆子油软胶囊蟾皮薄层鉴别结果
1.2.2.1 色谱条件 色谱柱:DM-Inert Wax毛细柱(30mm×0.25mm×0.25μm);柱温:150℃;进样口温度:250℃;检测器温度:250℃;载气为高纯氮,流速1.0mL/min;恒流分流比 30∶1,柱前压 10psi。柱温采用程序升温方式,150℃(停留1min)-200℃(10℃/min,停留 2min)-220℃(10℃/min,停留 10min)。在本色谱条件下,样品中油酸与其他成分能够达到基线分离,且分离度大于1.5,理论塔板数按油酸峰面积计算,不低于40000。对照品、溶剂、空白、样品色谱图见图3~图6。
图3 对照品色谱图

图4 溶剂色谱图

图5 空白色谱图

图6 样品色谱图
1.2.2.2 对照品溶液制备 精密称取油酸对照品33.8mg,至25mL容量瓶中,加正己烷溶解并稀释至刻度,摇匀,制成 1.352mg/mL 对照品溶液[10]。
1.2.2.3 供试品溶液制备 取复方鸦胆子油软胶囊内容物适量,置10mL容量瓶中,加正己烷定容,取1mL按照对照品溶液的制备项操作,即得样品溶液。
1.2.2.4 线性关系考察 精密吸取1.352mg/mL油酸对照品溶液 0.4mL、0.8mL、1.2mL、1.6mL、2.0mL、2.4mL至15mL具塞试管中加入0.5moL/L氢氧化钾甲醇溶液2mL,在60℃恒温水浴中皂化25min;待油珠完全溶解后,放冷,加入15%三氟化硼乙醚溶液2mL,摇匀,在60℃恒温水浴中甲酯化2min,放冷,精密加入正己烷2.0mL,充分振摇2min;加入过饱和氯化钠溶液适量,使正己烷溶液上浮至瓶颈,立即吸取上层有机液,用0.5g无水硫酸钠脱水,制得系列对照品溶液;分别精密吸取对照品溶液进样,测定峰面积,以面积为纵坐标,以对照品溶液的浓度为横坐标,绘制标准曲线。油酸在0.2704mg/mL~1.6224mg/mL范围内线性关系良好。回归方程:Y=433993X+4816,相关系数R=0.9996。
1.2.2.5 精密度实验 取复方鸦胆子油软胶囊的供试品溶液一份,连续进样6次,结果各峰面积相对标准偏差小于3%。
1.2.2.6 重复性实验 取复方鸦胆子油软胶囊样品,分别平行制备6份供试品溶液,进样测定,计算含量,相对标准偏差小于3%。
1.2.2.7 稳定性实验 取复方鸦胆子油软胶囊供试品一份,分别于 0h,2h,4h,6h,8h,10h 进样测定,峰面积相对标准偏差小于3%。
1.2.2.8 回收率实验 精密量取对照品溶液适量于容量瓶中,按供试品溶液制备方法分别平行制备6份加样回收溶液,进样测定,计算回收率,其平均回收率在95%~105%之间。
1.2.2.9 含量测定 依法测定6份复方鸦胆子油软胶囊中油酸含量,平行测定,结果见表1。

表1 复方鸦胆子油软胶囊中油酸含量测定结果
1.2.3 HPLC测定华蟾酥毒基和脂蟾毒配基含量
1.2.3.1色谱条件色谱柱:kromasil C18(4.6mm×250mm,5μm)(瑞典);流动相:乙腈(A)-水(B)(50∶50);流速:1mL/min;柱温:30℃;检测波长:296nm。对照品、空白、样品、溶剂色谱图见图7~图10。
1.2.3.2 对照品溶液制备 取华蟾酥毒基对照品1.4mg、脂蟾毒配基对照品1.4mg,置10mL容量瓶中,加甲醇定容,即得。
1.2.3.3 供试品溶液制备 取胶囊内容物适量,置50mL锥形瓶中,加甲醇,称重,加热回流1h,放冷,加甲醇至恒重,摇匀,过微孔滤膜(0.45μm),取续滤液。

图7 溶剂色谱图

图8 空白色谱图

图9 对照品色谱图

图10 样品色谱图
1.2.3.4 线性关系考察 标准曲线的制备:分别将对照品溶液稀释成 0.0056mg/mL,0.0168mg/mL,0.0280mg/mL,0.0392mg/mL,0.0504mg/mL,0.0616mg/mL,分别进样10μL分析,以样品峰面积对样品浓度作图,得华蟾酥毒基标准曲线:Y=11351573.9796X+20148.6143,相关系数R=0.9998;脂蟾毒配基标准曲线:Y=5590923.4694X+14457.3048,相关系数R=0.9996;线性范围0.0056mg/mL~0.0616mg/mL。
1.2.3.5 精密度实验 取复方鸦胆子油软胶囊的供试品溶液1份,连续进样6次,结果各峰面积相对标准偏差小于3%。
1.2.3.6 重复性实验 取复方鸦胆子油软胶囊样品,分别平行制备6份供试品溶液,进样测定,计算含量,相对标准偏差小于3%。
1.2.3.7 稳定性实验 取复方鸦胆子油软胶囊供试品 1份,分别于 0h,2h,4h,6h,8h,10h 进样测定,峰面积相对标准偏差小于3%。
1.2.3.8 回收率实验 精密量取对照品溶液适量于容量瓶中,按供试品溶液制备方法分别平行制备6份加样回收溶液,进样测定,计算回收率,其平均回收率在95%~105%之间。
1.2.3.9 含量测定 依法测定9份复方鸦胆子油软胶囊中华蟾酥毒基和酯蟾毒配基的含量,平行测定,结果见表2。

表2 复方鸦胆子油软胶囊中华蟾酥毒基和酯蟾毒配基含量测定结果
1.2.4 复方鸦胆子油软胶囊初步药效学研究之抑瘤率实验
1.2.4.1 S180荷瘤小鼠模型建立 于液氮罐中取出S180腹水型肿瘤细胞株1支,置于37℃电热恒温水浴箱内,轻轻摇动令其尽快融化。取出冻存管,用酒精消毒后开启,用吸管吸出细胞悬液,注入离心管并滴加15%胎牛血清RPMI-1640培养基,常规离心,制成瘤细胞混悬液,台盼蓝计数约为1×107/mL瘤细胞。取0.2mL(1×106~2×106个瘤细胞)接种于腹腔。传代3次后选择接种7d的S180荷瘤小鼠,脱颈处死,抽取小鼠腹腔内腹水,用生理盐水适当稀释后,计数,调整浓度至2×107/mL,用无菌注射器吸取瘤细胞混悬液0.2mL注射在小鼠左前肢腋下,每只0.2mL。
1.2.4.2 分组与给药 取50只接种后的ICR小鼠,称重记录体重,按体重和性别随机分为5组:高剂量组(换算成鸦胆子生药量189.2mg/kg,蟾皮316.8mg/kg,0.2mL/10g体重)、中剂量组(换算成鸦胆子生药量94.6mg/kg,蟾皮158.4mg/kg,0.2mL/10g体重)、低剂量组(换算成鸦胆子生药量47.3mg/kg,蟾皮79.2mg/kg,0.2mL/10g体重)、模型组(生理盐水,0.2mL/10g体重)、环磷酰胺组(环磷酰胺2.5mg/kg,0.1mL/10g体重)。环磷酰胺组采用腹腔注射方式,其余组采用灌胃给药。
1.2.4.3 数据收集与指标检测 连续灌胃给药11d,给药期间观察记录小鼠的一般情况(饮食、外观、行为、分泌物、排泄物、中毒表现和死亡情况等),定期称荷瘤小鼠体重,停药后第2天记录体重,脱颈处死后解剖,剥取肿瘤组织、脾脏、胸腺,电子天平称重,记录。记录给药前后小鼠体重变化、平均瘤重,计算抑瘤率;根据解剖后小鼠胸腺和脾脏重量,计算胸腺指数和脾脏指数。运用SPSS 16.0软件对相关数据进行统计学处理,计量资料采用均数±标准差(±s)表示,组间计量资料比较采用t检验。
1.2.4.4 各组小鼠抑瘤率及胸腺指数和脾脏指数比较 在给药前期(1~6d)小鼠的一般情况总体良好;在接种后5d~7d,可以直观看见小鼠腋下肿大的瘤块;在给药后期(7d~11d)随着瘤体的增大,部分小鼠活动能力减弱,进食减少。模型组、低剂量组小鼠后期体重增长缓慢,皮毛凌乱无光泽;高剂量组小鼠体重增长趋势稳定,皮毛柔顺且有光泽。
与模型组比较,环磷酰胺组和复方鸦胆子油高、中、低剂量组小鼠平均肿瘤重量降低,脾脏指数升高,差异有统计学意义(P<0.05),表明复方鸦胆子油软胶囊给药后可以改善小鼠的机体免疫力,提高免疫器官的脏器指数。结果见表3、表4。
表3 各组小鼠抑瘤实验结果比较 (g,±s)

表3 各组小鼠抑瘤实验结果比较 (g,±s)
注:与模型组比较,1)P<0.05
组别 n 实验前体质量 实验后体质量 平均肿瘤重量 抑瘤率(%)模型组 10 20.34±1.32 24.43±2.78 1.330±0.142 -环磷酰胺组 10 23.49±1.13 27.58±5.51 0.818±0.1091) 38.51低剂量组 10 20.19±1.11 25.05±2.48 1.037±0.2341) 22.08中剂量组 10 20.44±1.02 25.13±2.31 0.947±0.3471) 28.87高剂量组 10 19.24±1.12 25.31±2.34 0.868±0.1931) 34.82
表4 各组小鼠胸腺指数和脾脏指数比较 (mg/g,±s)

表4 各组小鼠胸腺指数和脾脏指数比较 (mg/g,±s)
注:与模型组比较,1)P<0.05
组别 n 胸腺指数 脾脏指数模型组 10 12.209±0.334 34.328±1.252环磷酰胺组 10 9.953±0.945 44.838±0.5771)低剂量组 10 11.903±0.467 38.692±1.1351)中剂量组 10 12.409±0.656 42.277±1.2461)高剂量组 10 12.079±0.357 44.838±0.7641)
1.2.5 生命延长率实验 取50只接种后的ICR小鼠,分组、给药同1.2.4.2。从给药第11天开始停止给药,继续饲养观察,在观察期间记录小鼠的一般情况(饮食、外观、行为、分泌物、排泄物、中毒表现和死亡情况等),定期称荷瘤小鼠体重,记录小鼠的死亡情况。运用SPSS 16.0软件对相关数据进行统学处理。计量资料采用均数±标准差(±s)表示,组间计量资料比较采用t检验。
结果表明,未形成腹水前,小鼠的一般状态良好,但是随着腹水的增多,小鼠行动减缓,进食少,精神状态极差。环磷酰胺组和复方鸦胆子油高、中、低剂量组荷瘤小鼠的生存天数均提高,与模型组比较,差异有统计学意义(P<0.05),结果见表5。
2 讨 论
薄层板和展开缸应预饱和至少15min,薄层板使用之前需活化。3批复方鸦胆子油软胶囊样品,油酸的含量最高为0.664%,最低为0.622%,故建议将复方鸦胆子油软胶囊中油酸的检查限度设定为0.622%。华蟾酥毒基和脂蟾毒配基总含量最高为0.0246%,最低为0.0209%,故建议将复方鸦胆子油软胶囊中华蟾酥毒基和脂蟾毒配基总含量的检查限度设定为0.0209%。脾脏和胸腺是机体重要的免疫器官,二者对细胞毒剂高度敏感,在化疗药物作用下明显萎缩,其组织结构较快地发生严重损伤。从延长患者生命,提高患者生存质量的角度出发,抑瘤率和生命延长率是验证一种药物是否有效的药效学的2个整体评估指标。

表5 各组生命延长率实验结果
3 结 论
本实验采用薄层色谱法、气相色谱法和高效液相色谱,以不同指标分别对复方鸦胆子油软胶囊的质量进行了较全面的评价,并对建立的方法进行了详尽的方法学考察,为复方鸦胆子油软胶囊质量标准的提高提供了实验依据,可进一步指导安全有效的用药。本实验采用ICR小鼠S180腹水瘤模型观察鸦胆子油给药对荷瘤小鼠生命延长率以及抑瘤效果的影响。同时设生理盐水组作阴性对照,环磷酰胺化疗组为阳性对照。实验结果表明,复方鸦胆子油软胶囊不仅能延长荷瘤小鼠的生存天数,还可以抑制肿瘤生长,具有良好的药理作用,为临床的推广应用提供了依据。
[1]李慧,王一涛.近 10年软胶囊剂的国内外研究进展[J].中国中医药信息杂志,2003,10(2):78-79.
[2]崔福德.药剂学[M].6版.北京:人民卫生出版社,2008:165.
[3]王士清,严铭铭,叶豆丹,等.三黄前必治软胶囊制备工艺的研究[J].中华中医药学刊,2011,29(11):2437-2439.
[4]哈娜,杨习江,赵宇新.均匀设计和回归分析优化安神宁软胶囊的制备工艺[J].医药导报,2010,29(4):515-518.
[5]Zhang H,Yang J Y,Zhou F.Seed oil of brucea javanica induces apoptotic death of acute myeloid mleukemia cells via both the death receptors and the itochondrial-related pathways[J].Evid Based Complement Alternat Med,2011(2):1155-1169.
[6]Gao H,Lamusta J,Burstein S.Tumor cell selective cytotoxicity and apoptosis induction by an herbal preparation from brucea javanica[J].N Am J Med Sci(Boston),2011,4(2):62-66.
[7]陈培丰,朱国猛.鸦胆子油乳在肿瘤防治中的意义[J].实用肿瘤学杂志,2005,19(3):238-240.
[8]吴树强,贾勇士,吕世良.鸦胆子油乳肝动脉灌注治疗转移性肝癌[J].中国肿瘤,2008,13(8):523-524.
[9]曾洋,张爱军,文筱.干蟾皮的研究进展[J].中国医药科学,2011,15(1):29-31.
[10]Tomka I,Engel D,Brocker E,et al.Method for manufacturing a shape body containing a starch,a homogenized mass containing starch and a device for manufacturing a soft capsule:US,6790495[P].2004-09-14.

