大丽轮枝菌菌核型菌株T-DNA插入突变体库的构建及微菌核发育异常突变体的筛选
梁 曼, 邓 晟, 张 昕, 林 玲
(1.南京师范大学生命科学学院,江苏 南京 210046;2.江苏省农业科学院植物保护研究所,江苏 南京 210014)
大丽轮枝菌(Verticillium dahliae)引起的棉花黄萎病已成为中国棉花生产上的第一大病害,是棉花可持续生产的主要障碍之一。微菌核是病原菌在土壤中的主要存活结构和病害的初侵染来源,也是病害防治的直接靶标[1-2]。因此,明确微菌核形成和发育的机制对于深入研究棉花黄萎病的流行规律和制定防治措施具有重要意义。前人对于大丽轮枝菌微菌核的研究主要集中于微菌核的形态、大小、分布,微菌核的分离培养技术以及影响微菌核萌发与存活的因素等[2-4]。但是,对于调控大丽轮枝菌微菌核发育的内在分子机理研究的很少。
农杆菌介导的遗传转化(Agrobacterium tumefaciens-mediated transformation,ATMT)技术已成为研究真菌基因功能的有效工具之一,通过ATMT方法将T-DNA随机插入至真菌基因组中构建突变体库,并根据突变体的表型筛选获得相关功能基因,已成功运用于多种植物病原真菌的功能基因研究[5-7]。江苏省农业科学院植物保护研究所土传种传病害实验室同样用ATMT方法,将自己构建的双向GFP启动子诱捕载体1300-bisGFP-hyg转入大丽轮枝菌菌丝型强致病力菌株V07DF2中,构建了包含6 000个转化子的T-DNA插入突变体库。从其中60个转化子中筛选出6个丧失致病力和11个致病力显著降低的突变体菌株,并对其中1个致病力显著降低的突变体菌株24C9进行了深入的分析,该菌株为单拷贝 T-DNA插入,插入位点为 VdUGPU基因(VDAG_03025)的启动子区域[8]。但是从该突变体库中的1 000个转化子中仅筛选获得1株微菌核发育异常的突变体菌株43F11,该突变株为双拷贝TDNA插入,在查氏-根培养基上培养一个月后能够产少量黑色微菌核,但在查氏平板上生长与野生型V07DF2一致,不产生微菌核。为了获得更多的微菌核发育异常的突变体菌株,就需要进一步扩建大丽轮枝菌T-DNA插入突变体库。
由于大丽轮枝菌的菌落形态变异很大,根据在PDA培养基上生长时形成微菌核的多少可将大丽轮枝菌分为不产微菌核的菌丝型、产生少量黑色微菌核的中间型和产生大量黑色微菌核的菌核型这3种培养类型[9]。为此,我们用同样的方法,将双向GFP启动子诱捕载体1300-bisGFP-hyg转入菌核型菌株V08DF1中,并同时用1300-HYG-sGFP荧光标记载体转化V08DF1,构建大丽轮枝菌菌核型菌株V08DF1的突变体库,试图从菌丝型菌株V07DF2库中筛选出能够产生微菌核的突变体菌株,并从菌核型菌株V08DF1库中找出微菌核发育受阻的突变体菌株,为进一步克隆微菌核发育相关的基因及揭示微菌核形成和发育的机制奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 菌株和质粒 大丽轮枝菌菌核型菌株V08DF1,分离自江苏棉花黄萎病病株,保存于江苏省农业科学院植物保护研究所。农杆菌菌株AGL-1由江苏省农业科学院农业生物技术研究所张保龙研究员惠赠。1300-bisGFP-hyg双向GFP启动子诱捕载体[8]和 1300-HYG-sGFP 荧光标记载体[10]由江苏省农业科学院植物保护研究所保存。
1.1.2 试剂 潮霉素(Hygromycin,hyg)B和Southern杂交试剂盒来源于 Roche公司。PCR体系(TransTaq DNA Polymerase High Fidelity)购于北京全式金生物技术有限公司。其他常规试剂及抗生素均为国产分析纯。
1.2 方法
1.2.1 大丽轮枝菌菌株V08DF1对潮霉素的耐受性检测 采用PDA平板培养,设置潮霉素质量浓度梯度为 0 μg/ml、25 μg/ml、50 μg/ml、100 μg/ml、150 μg/ml、200 μg/ml,每个梯度 3 次重复,接种大丽轮枝菌菌株V08DF1,置于25℃恒温条件下,黑暗培养14 d,观察菌落生长情况。
1.2.2 农杆菌介导的遗传转化和转化子的保存农杆菌介导的大丽轮枝菌的转化参见已报道的方法[8],大丽轮枝菌菌株 V08DF1分别用1300-bisGFP-hyg双向GFP启动子诱捕载体和1300-HYG-sGFP荧光标记载体进行转化。挑取在硝酸纤维素膜上长出的转化子,转接至装有含50 μg/ml潮霉素B、200 μg/ml头孢噻肟和 200 μg/ml羧苄青霉素的 PDA的96孔平板上,然后对阳性转化子进行单孢分离,-70℃保存在含25%甘油的PDA液体培养基中,即获得了大丽轮枝菌菌株V08DF1的T-DNA插入转化子。
1.2.3 微菌核发育异常突变体菌株的筛选 对采用1300-bisGFP-hyg双向GFP启动子诱捕载体构建的1 000个转化子用由查氏和查氏-根培养基进行筛选。查氏-根培养基是在传统查氏培养基的基础上加入棉花根物质,具体制备步骤参照Deng等[8]的方法进行,通过启动子捕获模块找到参与微菌核发育相关的基因。对采用1300-HYG-sGFP荧光标记载体构建的1 000个转化子由查氏与PDA培养基进行筛选,分别吸取5 μl-70℃保存的转化子,滴在查氏、查氏-根或PDA固体培养基的中央,25℃黑暗培养30 d,每隔7 d观察各转化子的菌落形态,比较其菌落直径、菌丝形态、气生菌丝多少、是否产生色素、是否产生微菌核等培养特性,比较其生物学特性与野生型菌株的差异。从中筛选出产微菌核能力与野生型菌株明显不同的突变体菌株,即找出微菌核发育受阻,不产微菌核的突变体菌株。
1.2.4 微菌核发育异常突变体菌株T-DNA插入的PCR验证 微菌核发育异常的突变体菌株在PDA液体培养基中,25℃、150 r/min,培养7 d后,取新鲜菌丝提取基因组DNA。根据转化载体中T-DNA片段上的潮霉素抗性基因设计特异性引物[11],HYG检测上游引物:5'-GACAGCGTCTCCGACCTGATGC-3',HYG检测下游引物:5'-TGGGGCGTC GGTTTCCACTATC-3',由上海生工生物工程技术服务有限公司合成。PCR反应体系为25 μl:H2O 16.25 μl、DNA 2.00 μl、HYG-S 1.00 μl、HYG-A 1.00 μl、BuffeⅠ(含 Mg2+)2.50 μl、dNTP Mixture 2.00 μl、Taq DNA Polymerse 0.25 μl;反应条件为 95℃预变性5 min;95℃变性1 min,58℃退火45 s,72℃延伸1 min,共35个循环,最后72℃延伸5 min。用1%的琼脂糖凝胶电泳检测PCR扩增结果。
1.2.5 微菌核发育异常突变体菌株T-DNA插入拷贝数的验证 使用Roche公司的DIG High Prime DNA Labeling and Detection Starter KitⅠ试剂盒分析T-DNA插入的拷贝数。各步骤均按照试剂盒说明书进行,首先,用HYG检测引物扩增943 bp潮霉素抗性基因片段用于合成杂交探针,接下来将微菌核发育异常突变体的gDNA(约25 μg)分别用BstX I、HindⅢ37℃过夜完全酶切,并将酶切产物用1%的琼脂糖凝胶电泳,然后用毛细管转移法将核酸转移并固定于尼龙膜上,最后,在尼龙膜上进行杂交与显色。
2 结果
2.1 大丽轮枝菌菌核型菌株V08DF1突变体库的构建
在开始进行ATMT转化大丽轮枝菌菌核型菌株V08DF1试验之前,先检测菌株V08DF1对潮霉素B的耐受性。结果显示,于25℃,在PDA培养基上黑暗培养14 d后,潮霉素B质量浓度梯度为50 μg/ml时,即可抑制V08DF1的生长,其对潮霉素B耐受性的检测结果与V07DF2一致。
采用农杆菌介导的遗传转化对大丽轮枝菌菌核型菌株V08DF1进行转化,转化率为1.60×10-4。对转化子进行单孢分离保存,建立了大丽轮枝菌菌核型菌株V08DF1的突变体库,共保存2 000个转化子,其中包括用1300-bisGFP-hyg双向GFP启动子诱捕载体转化获得的1 000个转化子,以及用1300-HYG-sGFP荧光标记载体转化获得的1 000个转化子。
2.2 转化子菌落形态的观察及微菌核发育异常突变体菌株的筛选
对1 000个用1300-bisGFP-hyg双向GFP启动子诱捕载体进行转化的转化子采用查氏和查氏-根培养基进行培养14 d后,观察各转化子的菌落特征,结果显示,41个突变体菌株的菌落特征与野生型菌株V08DF1有明显差异,包括11个菌落直径明显变小的突变体菌株,12个菌落中菌丝稀疏的突变体菌株,12个没有气生菌丝的突变体菌株,1个产红色素的突变体菌株和5个微菌核发育异常的突变体菌株。在这5个微菌核发育异常的突变体菌株中,突变体菌株5G4在查氏和查氏-根培养基上培养14 d后,均不产生微菌核,而其余4个微菌核发育异常突变体菌株9G4、10E1、11A6、11B7只在查氏平板上不产生微菌核,而在查氏-根培养基仍然能够产生少量微菌核(图1)。
对1 000个用1300-HYG-sGFP荧光标记载体进行转化的转化子采用PDA和查氏培养基进行筛选,培养14 d后发现89个突变体菌株的菌落特征与野生型菌株V08DF1有明显差异,部分菌落形态异常突变体菌株表型如图2所示,包括19个菌落直径明显变小的突变体菌株,25个菌落中菌丝稀疏的突变体菌株,27个没有气生菌丝的突变体菌株,4个产红色素的突变体菌株,5个菌丝颜色微黄的突变体菌株和9个微菌核发育异常的突变体菌株。在这9个微菌核发育异常的突变体菌株中,2H3和12I3这2个突变体菌株在PDA和查氏平板上培养14 d都不产生微菌核,其余7个微菌核发育异常突变体菌株1C2、6I7、7E6、10B5、11C3、11G3、12C8 只在查氏平板上不产生微菌核,而在PDA平板上与野生型V08DF1一致,产生大量黑色微菌核,部分微菌核异常的突变体菌株表型如图3所示。
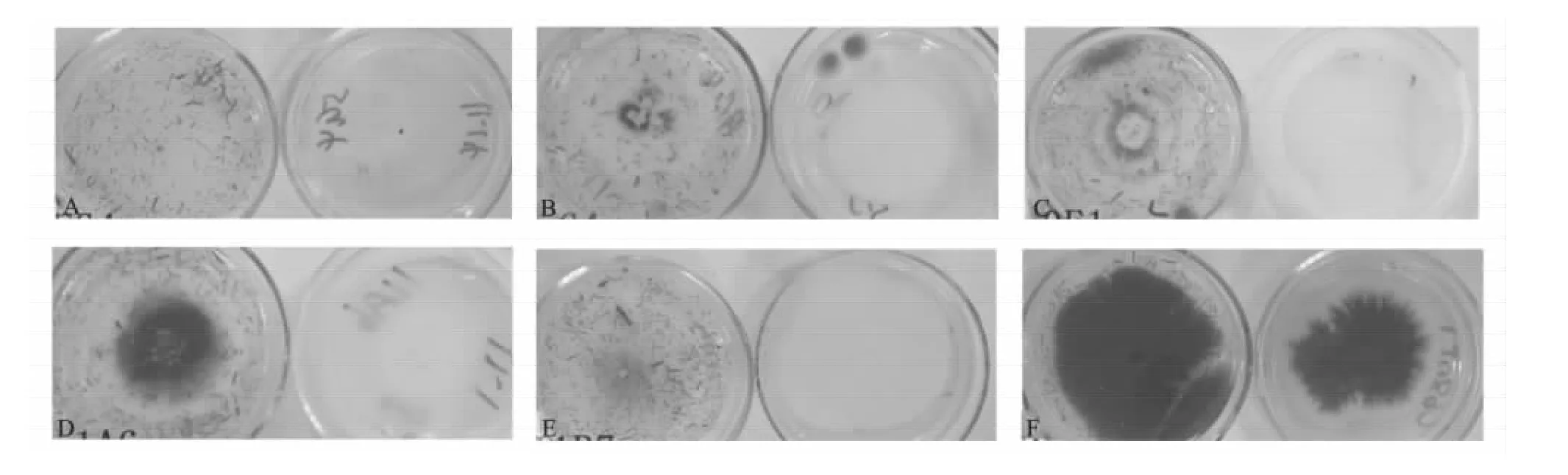
图1 用查氏和查氏-根培养基筛选V08DF1库中微菌核发育异常的突变体菌株Fig.1 The mutants with abnormal microsclerotia development screened from V08DF1 library on Czapek-Dox medium and Czapek-Dox plus cotton root extract medium
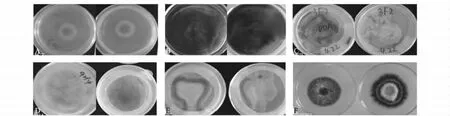
图2 V08DF1库中菌落形态异常的突变体菌株Fig.2 The mirphological mutants in V08DF1 library

图3 用查氏和PDA培养基筛选V08DF1库中微菌核发育异常的突变体菌株Fig.3 The mutants with abnormal microsclerotia development screened from V08DF1 library on PDA medium and Czapek-Dox medium
2.3 微菌核发育异常突变体菌株T-DNA插入的PCR验证
对筛选出的14个微菌核发育受阻,不产生微菌核的突变体菌株 1C2、2H3、5G4、6I7、7E6、9G4、10B5、10E1、11A6、11B7、11C3、11G3、12C8、12I3进行T-DNA插入的PCR验证。以这些突变体菌株的基因组DNA为模板,均能PCR扩增出943 bp的潮霉素抗性基因(图4)。由此断定,T-DNA已经整合到基因组DNA中,成功实现了转化。
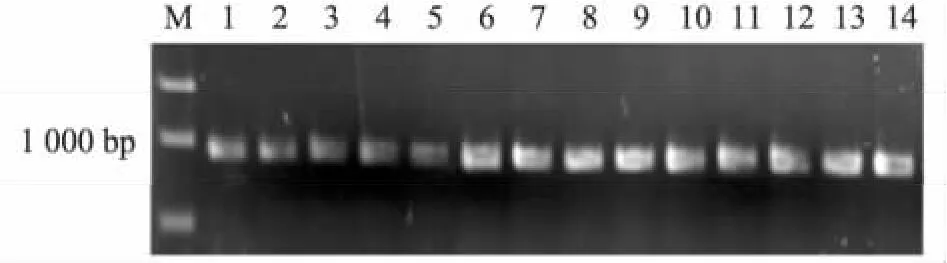
图4 PCR检测微菌核发育异常突变体菌株的潮霉素抗性基因Fig.4 Detection of hygromycin B resistance gene in the mutants with abnormal microsclerotia development by PCR amplification
2.4 微菌核发育异常突变体T-DNA插入拷贝数的验证
通过Southern杂交对筛选出的14个微菌核发育异常的突变体菌株进行T-DNA插入拷贝数的验证。结果显示,7个微菌核发育异常的突变体菌株为单拷贝,分别为 1C2、2H3、6I7、10B5、10E1、12C8、12I3;5 个为双拷贝,分别为 5G4、7E6、9G4、11C3、11G3;2个为三拷贝,分别为11A6、11B7。单拷贝插入的微菌核异常突变体菌株的Southern杂交结果如图5所示。
3 讨论
最近几年来,随着大丽轮枝菌基因组序列的测定和基因表达信息的丰富,系统插入突变技术、基因敲除技术的应用,极大推动了大丽轮枝菌微菌核形成发育分子机制的研究,但总体仍处于起步阶段。目前,已报道的与微菌核发育相关的基因只有为数不多的几个,并且大多与致病性相关。通过基因敲除验证,发现参与大丽轮枝菌微菌核发育并且与致病性相关的基因有7个,分别为VMK1(编码促分裂素原活化蛋白激酶)[12]、VdPKAC1(编码 cAMP依赖性蛋白激酶 A 的催化亚基)[11,13]、VdGARP1(编码 1个富含谷氨酸的蛋白质)[14]、VdSNF1(编码蔗糖非发酵蛋白质激酶)[15]、VGB(编码 G蛋白质的 β 亚基)[16]、Vta2(编码粘附的转录激活因子)[17]和VdMsb(编码1种跨膜粘蛋白质)[18]。另外还有1个基因VMK1(编码1种真菌疏水蛋白质)参与了大丽轮枝菌微菌核的形成,但不是致病必需的因子[19-20]。目前已经发现的这些基因仅仅揭开了大丽轮枝菌微菌核发育机制的冰山一角,外界环境和内在因子引发大丽轮枝菌微菌核发育的途径、靶标位点以及作用方式都还需要进一步揭示。
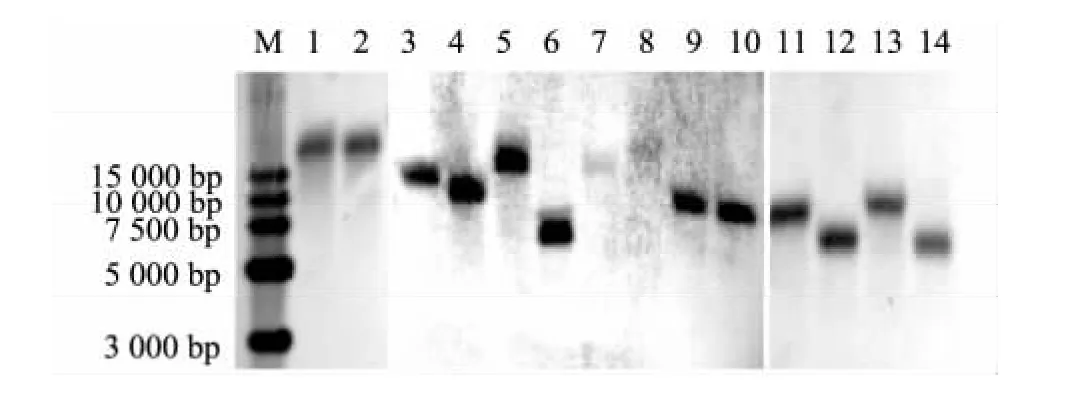
图5 微菌核发育异常突变体菌株的Southern杂交分析Fig.5 Southern-blot analysis of T-DNA insertion in the mutants with abnormal microsclerotia development
正向遗传学途径研究基因功能的方法是在获得功能丧失突变体的基础上分离和鉴定控制该表型的基因。我们通过ATMT方法将T-DNA随机插入至大丽轮枝菌基因组中,建立了大丽轮枝菌菌核型菌株V08DF1的T-DNA插入突变体库,从2 000个转化子中筛选出14个微菌核发育异常的突变体菌株,表明这些突变体菌株中与微菌核形成发育相关的基因,被T-DNA的插入破坏了。进一步通过Southern杂交,筛选出7个单拷贝插入的突变体菌株1C2、2H3、6I7、10B5、10E1、12C8 和 12I3,表明这 7 个被T-DNA插入破坏的基因是大丽轮枝菌微菌核形成发育过程中的关键基因,这些突变体菌株是研究大丽轮枝菌微菌核形成发育机制的好材料。
[1] 林 玲,张 昕,邓 晟 .棉花黄萎病研究进展[J].棉花学报,2014,26(3):260-267.
[2] ISAAC I,MACGARVIE Q D.Germination of resting bodies in Verticillium species[J].Nature,1962,195:826-827.
[3] 杨家荣,商鸿生,高立强.土壤环境因素对棉花黄萎病菌微菌核存活的影响[J].植物病理学报,2004,34(2):180-183.
[4] WILHELM S.Long evity of the Verticillium wilt fungus in the laboratory and field[J].Phytopathology,1955,45:180-181.
[5] CHEN X L,YANG J,PENG Y L.Large-scale insertional mutagenesis in Magnaporthe oryzae by Agrobacterium tumefaciens-mediated transformation[J].Methods in Molecular Biology,2011,722:213-224.
[6] MULLINS E D,CHEN X,ROMAINE P,et al.Agrobacteriummediated transformation of Fusarium oxysporum:An efficient tool for insertional mutagenesis and gene transfer[J].Phytopathology,2001,91(2):173-180.
[7] 徐荣旗,汪佳妮,陈捷胤,等.棉花黄萎病菌T-DNA插入突变体表型特征和侧翼序列分析[J].中国农业科学,2010,43(3):489-496.
[8] DENG S,WANG C,ZHANG X,et al.Bidirectional promoter trapping T-DNA for insertional mutagenesis in Verticillium dahliae[J].Canadian Journal of Microbiology,2014,60(7):445-454.
[9] 宋晓轩,朱荷琴,郭金城.棉花黄萎病(Verticillium dah1iae Kleb.)安阳菌系致病力分化研究[J].中国农业科学,1997,30(1):13-18.
[10]邓 晟,王彩月,张 昕,等.大丽轮枝菌的绿色荧光蛋白标记[J].江苏农业学报,2012,28(5):1197-1199.
[11]邓 晟,张 昕,林 玲.蛋白激酶A催化亚基VdPKAC1对菌丝型大丽轮枝菌V07DF2培养性状及致病力的调控[J].中国农业科学,2014,47(17):3382-3391.
[12] RAUYAREE P,OSPINA-GIRALDO M D,KANG S,et al.Mutations in VMK1,a mitogen-activated protein kinase gene,affect microsclerotia formation and pathogenicity in Verticillium dahliae[J].Current Genetics,2005,48(2):109-116.
[13] TZIMA A K,PAPLOMATAS E J,RAUYAREE P,et al.Roles of the catalytic subunit of cAMP-dependent protein kinase A in virulence and development of the soilborne plant pathogen Verticillium dahliae[J].Fungal Genetics and Biology,2010,47:406-415.
[14] GAO F,ZHOU B,LI G Y,et al.A glutamic acid-rich protein identified in Verticillium dahliae from an insertional mutagenesis affects microsclerotial formation and pathogenicity[J].Plos One,2010,5:e15319.
[15] TZIMA A K,PAPLOMATAS E J,RAUYAREE P,et al.Vd-SNF1,the sucrose nonfermenting protein kinase gene of Verticillium dahliae,is required for virulence and expression of genes involved in cell-wall degradation[J].Molecular Plant-Microbe Interactions,2011,24:129-142.
[16] TZIMA A K,PAPLOMATAS E J,TSITSIGIANNIS D I,et al.The G protein β subunit controls virulence and multiple growthand development-related traits in Verticillium dahliae[J].Fungal Genetics and Biology,2012,49(4):271-283.
[17] TRAN V T,BRAUS-STROMEYER S A,KUSCH H,et al.Verticillium transcription activator of adhesion Vta2 suppresses microsclerotia formation and is required for systemic infection of plant roots[J].New Phytologist,2014,202(2):565-581.
[18] TIAN L,XU J,ZHOU L,et al.VdMsb regulates virulence and microsclerotia production in the fungal plant pathogen Verticillium dahliae[J].Gene,2014,550:238-244.
[19] KLIMES A,DOBINSON K F.A hydrophobin gene,VDH1,is involved in microsclerotial development and spore viability in the plant pathogen Verticillium dahliae[J].Fungal Genetics and Biology,2006,43:283-294.
[20] KLIMES A,AMYOTTE S G,GRANT S,et al.Microsclerotia development in Verticillium dahliae:Regulation and differential expression of the hydrophobin gene VDH1[J].Fungal Genetics and Biology,2008,45:1525-1532.

