减蛋下降综合征病毒重组Knob-S基因在杆状病毒系统中的表达及其免疫原性鉴定
郑 金, 陈 滔,, 陆吉虎, 高 峰,, 候继波, 黎满香, 唐应华
(1.湖南农业大学动物医学院,湖南 长沙 410128;2.江苏省农业科学院/国家兽用生物制品工程技术研究中心,江苏 南京210014)
减蛋下降综合征(EDS)是由减蛋下降综合征病毒(EDS virus,EDSV)引起的以产蛋率下降为特征的传染病。本病的主要传播方式是垂直传播,也可通过呼吸道水平传播。所有年龄的鸡均可感染,但幼鸡感染后不表现任何临床症状,母鸡只是在产蛋高峰期表现明显[1]。EDSV由11条大小不等的蛋白质组成,纤突蛋白质是EDSV的主要衣壳蛋白质,纤突蛋白质包括3个结构域,即Tail、Shaft和Knob区,Knob区不但可识别宿主细胞受体而且能增强病毒的吸附能力[2],Knob-S蛋白质存在良好的免疫原性[3]。
本试验选用昆虫杆状病毒表达系统,对EDSV的Knob-S蛋白质进行真核表达、纯化,经Western blotting和间接免疫荧光分析,确定表达的蛋白质具有免疫原性,为研究Knob-S蛋白质的生物学活性及相关疫苗奠定基础。
1 材料与方法
1.1 质粒、菌株、细胞、试验动物
大肠杆菌DH5α、pFastBac-1、转座用大肠杆菌宿主菌 DH10Bac、pMD18-T-Knob-S、草地贪夜蛾卵巢细胞(Spodoptera frugiperda)均由江苏省农业科学院保存。6周龄非免海兰褐雏鸡,购自北京华都峪口禽业集团。
1.2 主要试剂
EDSV-76由江苏省农业科学院国家兽用生物制品工程技术研究中心保存。BamHⅠ、HindⅢ工具酶、Ex Taq DNA 聚合酶、IPTG、DNA marker DL2000、DL15000、蛋白质 Marker、X-gal、T4 DNA 连接酶、DNA胶回收试剂盒和质粒小提试剂盒均购自宝生物工程有限公司,优级胎牛血清、Grace’s培养基、Sf-900ⅡSFM培养液、LipofectamineTM2000均购自Invitrogen公司,FITC标记的羊抗鸡的抗体为Promega公司产品,DMEM与RPMI1640培养基为GIBCO公司产品,细胞培养板为Costar公司产品,其余试剂均为进口或国产分析纯。
1.3 引物设计与合成
以EDSV-76疫苗株为模版,根据已发表的纤突蛋白质Knob-S氨基酸序列,利用Primer Premier 5.0生物软件设计1对引物,于上、下游引物分别引入BamHⅠ、HindⅢ酶切位点,F:5'-GCGGGATCCCA TGTTGACTTTGGCTTATGATTCCAC-3',R:5'-ATAAAGCTTCTACTGTGCTCCAACATATG-3',下划线部分为酶切位点,扩增片段长为708 bp,引物由南京金斯瑞生物科技公司合成。
1.4 Knob-S基因的扩增、克隆
提取pMD18-T-Knob-S质粒,作为PCR扩增的模板,产物经10 g/L的琼脂糖凝胶电泳鉴定和切胶回收后连接到pMD18-T中,转化于DH5α感受态细胞,挑取白斑,提取质粒进行PCR和酶切鉴定。鉴定正确的质粒送上海美吉生物技术有限公司测序,测序正确的质粒命名为p-Knob-S。
1.5 重组杆状病毒的构建
将重组质粒p-Knob-S和pFastBac-1质粒用BamHⅠ和HindⅢ双酶切,回收目的片段连接获得重组转座载体pFast-Knob-S。将重组质粒pFast-Knob-S转化入DH10Bac感受态细胞,获得插入Knob-S基因的重组杆状病毒穿梭载体rBac-Knob-S。3次蓝白斑筛选纯化后,按 Bac-to-Bac杆状病毒表达系统说明书中改良的碱裂解法提取重组Bacmid的DNA,用M13上、下游通用引物进行PCR扩增,确定目的基因插入是否成功。将rBac-Knob-S在脂质体介导下转染Sf9细胞,感染4~5 d时,收集出现明显感染症状的细胞上清液,作为第1代重组病毒,传代3次后筛选到含有Knob-S基因的重组杆状病毒rAcV-Knob-S种子液。
1.6 重组杆状病毒滴度的测定
取10支1.5 ml灭菌EP管,每管中加入含有2%FBS 的 Grace’s培养基 900 μl,在第一管中加入100 μl第3代病毒原液,倍比稀释至第10管,最高稀释度为1×10-10,弃去已铺好的96孔细胞培养板内的培养液,用Grace’s培养基清洗1遍,每列细胞板依次加入100 μl所稀释的病毒滴度,最后两列为阴性对照,对照内加入 100 μl含有 2%FBS的Grace’s培养基,置于培养箱内,观察细胞状态并记录阳性孔中细胞病变情况,直到阴性细胞脱落老去,结果按Karber法计算。
1.7 Western blotting和间接免疫荧光(IFA)检测重组Knob-S基因在Sf9细胞中的表达
收集rBac-Knob-S感染后4~5 d的病变细胞,用PBS洗涤3次后,再用 PBS重悬,进行 Western blotting[4]。收集 rBac-Knob-S感染后完全病变的细胞,同时以未感染的Sf9昆虫细胞和与空杆状病毒感染的Sf9昆虫细胞为对照,固定后用鸡抗EDSV阳性血清和FITC标记的羊抗鸡二抗检测表达蛋白质,荧光显微镜下观察结果。
1.8 抗原的制备
重组杆状病毒调整到浓度为1 ml 1×106.0TCID50后,按每1 ml病毒接种100 ml的细胞(细胞密度约为1 ml 1×106个),共接种200 ml细胞,接毒后96~120 h收获细胞,PBS洗3次,10 ml PBS重悬(浓缩20倍),超声裂解,4℃以5 000 r/min离心10 min,弃掉沉淀。
1.9 疫苗的制备及动物免疫
将重组蛋白质经初步离心纯化后与吐温混合制备水相,将此水相与油相按 1∶3(体积比)混合并充分乳化,制成油乳剂疫苗并于4℃冰箱放置。将30只6周龄非免海兰褐雏鸡随机分成3组,每组10只,杆状病毒表达蛋白质各组每羽份免疫0.3 ml(含50 μg的重组病毒)。免疫后第2、3、4和5周分别采血检测抗体效价。另设空Bacmid转染Sf9细胞对照组和不免疫空白对照组。免疫后第 2、3、4和 5周分别采血,以EDS-76病毒作为检测抗原,检测血清血凝抑制抗体(HI)效价。
2 结果
2.1 重组穿梭载体的构建及鉴定
分别以 rBac-Knob-S和 rBac-pFast为模板,用M13通用引物进行PCR,扩增出的重组空载体大小为2 430 bp,重组载体大小为3 000 bp左右,与预期结果相符(图1)。
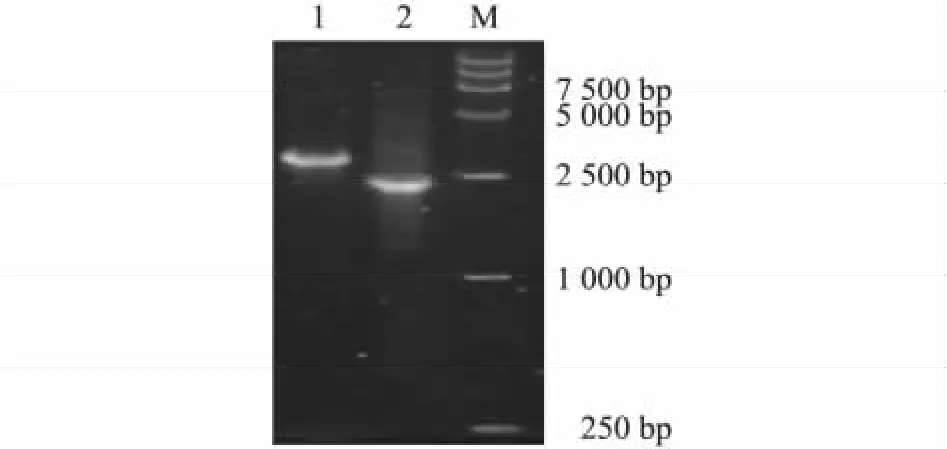
图1 重组rBac-Knob-S PCR鉴定Fig.1 Ⅰdentification for the recombinant rBac-Knob-S with PCR
2.2 重组杆状病毒滴度的测定
用Karber法计算病毒滴度,结果表明,前5个病毒稀释度产生的细胞病变率为 100%,10-6、10-7、10-8、10-9、10-10稀释的病毒产生的细胞病变率分别为 75.0%、37.5%、0、0 和0。
根据细胞的病变率计算重组杆状病毒的病毒滴度,病毒滴度用组织培养半数感染量(TCID50)表示。
lgTCID50=L+d(S-0.5)
L:最低稀释度对数,为-1;d:稀释度对数之间的差值,为-1;S:阳性孔比率总和,为1+1+1+1+1+0.75+0.375+0=6.125。
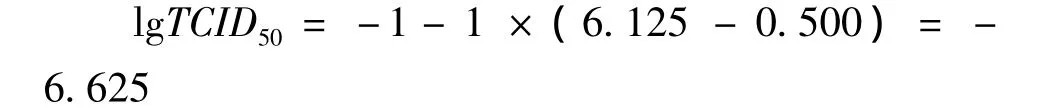
即0.1ml重组杆状病毒的TCID50为10-6.625。
2.3 重组蛋白质Western blotting鉴定
经Western blotting检测,重组杆状病毒表达产物转印反应后出现特异性蛋白质杂交带(图2),表明利用杆状病毒在昆虫细胞Sf9内表达的重组蛋白质可与鸡阳性血清发生特异性免疫反应,从而证实其具有生物学活性。
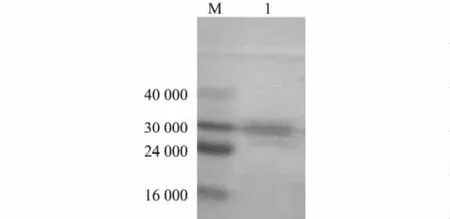
图2 重组杆状病毒表达蛋白质的Western blotting鉴定Fig.2 Western blotting analysis of recombinant rBac-Knob-S
2.4 间接免疫荧光检测
经IFA检测,rBac-Knob-S感染的Sf9细胞具有很强的特异性荧光(图3A),而健康Sf9细胞(图3B)无荧光,杆状病毒感染的Sf9细胞(图3C)无荧光,说明Knob-S基因得到表达,并且表达产物位于细胞内。
2.5 血清中HI抗体的检测
重组Knob-S蛋白质免疫后第2、3、4和5周采血,分离血清,HI检测的抗体效价见表1,结果显示,重组Knob-S蛋白免疫后第2周即可产生较高抗体,

图3 重组病毒的间接免疫荧光(ⅠFA)检测Fig.3 Ⅰdentification of recombinant bacmid by indirect immunofluorescence assay
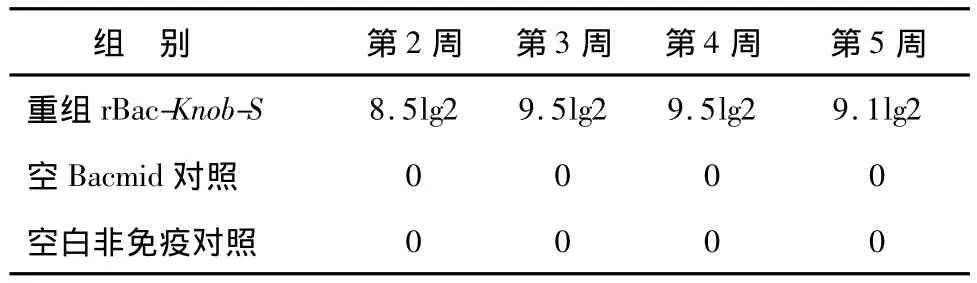
表1 抗EDSV HⅠ抗体效价Table 1 The hemagglutinin inhibition(HⅠ)antibody titers against EDSV
3 讨论
目前减蛋下降综合征病毒(EDSV)的疫苗是EDSV用鸭胚增殖,并灭活制备成油苗,用以预防EDS-76,现阶段并无SPF鸭胚用于繁殖病毒,若灭活不完全,则有可能造成巨大的经济损失,存在很大的安全隐患。利用昆虫杆状病毒表达系统(BEVS)体外表达具有生物活性蛋白质国内外均有文献报道[5-10],该系统具有对外源蛋白质加工后修饰的功能,容易从无血清培养上清液中纯化蛋白质,无内毒素污染等优点。该系统与大肠杆菌等原核表达的外源蛋白质相比能更好保持其免疫原性。
本试验以AV-127株基因组为模板,利用PCR方法扩增纤突蛋白质基因的Knob-S区,将其克隆到真核表达载体pFastBac1中,经双酶切证实重组质粒构建正确后构建穿梭载体rBac-Knob-S,经三轮筛选后得到阳性菌落,提取病毒基因组转染Sf9细胞,在细胞中可见很强的亮绿色荧光,说明在Sf9细胞中高效表达了该蛋白质。病毒的滴度测定结果表明,重组Knob-S病毒感染Sf9细胞后,细胞出现病变死亡,说明融合表达的Knob-S蛋白质有细胞毒性。通过Western blotting检测,确定了Knob-S蛋白质的生物学活性,与预期结果相符,表明表达的蛋白质具有与天然蛋白质相似的构象和相同抗原性。动物免疫试验结果表明,真核表达重组蛋白质的抗体效价较高,说明该真核表达蛋白质具有较好的免疫原性。
[1] W卡尼尔B.禽病学[M].10版.北京:中国农业大学出版社,1999.
[2] TOMKO R P,JOHANSSON C B,TOTROV M,et al.Expression of the adenovirus receptor and its interaction with the fiber knob[J].Experimental Cell Research,2000,255(1):47-55.
[3] FINGERUT E,GUTTER B,GALLILI G,et al.A subunit vaccine against the adenovirus egg-drop syndrome using part of its fiber protein[J].Vaccine,2003,21(21):2761-2766.
[4] 陈 滔,唐应华,陆吉虎,等.产蛋下降综合征病毒纤突蛋白Knob-S区原核表达及其活性分析[J].动物医学进展,2012,33(6):41-44.
[5] KOST T A,CONDREAY J P,JARVIS D L.Baculovirus as versatile vectors for protein expression in insect and mammalian cells[J].Nature Biotechnology,2005,23(5):567-575.
[6] SHEN X,HU G,JIANG S,et al.Engineering and characterization of a baculovirus-expressed mouse/human chimeric antibody against transferrin receptor[J].Protein Engineering Design and Selection,2009,22(12):723-731.
[7] WANG Y,SUN Y,TIAN Z,et al.Protection of chickens against infectious bronchitis by a recombinant fowlpox virus co-expressing IBV-S1 and chicken IFNγ[J].Vaccine,2009,27(50):7046-7052.
[8] NAGATA T,ISHIKAWA S,SHIMOKAWA E,et al.High level expression and purification of bioactive bovine interleukin-18 using a baculovirus system[J].Veterinary Immunology and Immunopathology,2002,87(1):65-72.
[9] 唐应华,吴培培,宫玉珍,等.肾型传染性支气管炎病毒的鉴定和结构蛋白的表达[J].中国兽医科学,2011,41(10):1034-1040.
[10]李东卫,郭莹莹,刘在斯,等.禽流感病毒 NS1蛋白在杆状病毒表达系统中的表达[J].动物医学进展,2012,33(6):27-31.

